有机化学:第一章 有机化合物分子结构基础
- 格式:ppt
- 大小:3.91 MB
- 文档页数:67
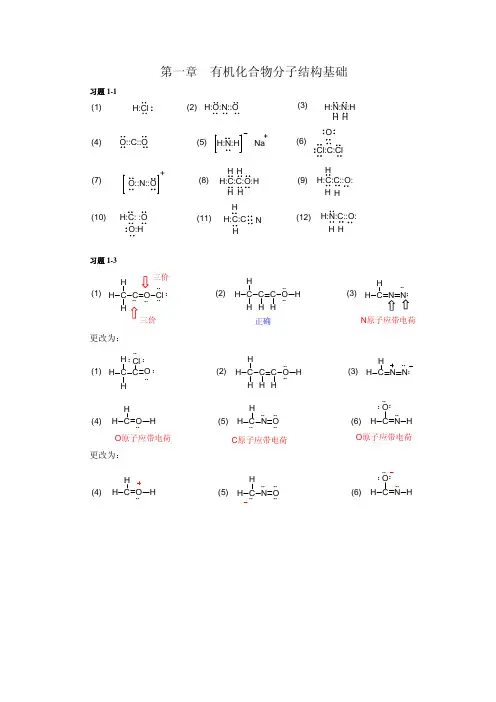
第一章 有机化合物分子结构基础习题1-1H:Cl(2)H:O:N::O(3)H:N:N:H H H (1)O::C::O Cl:C:ClO(4)(5)Na(6)+(7)(8)(9)H:C:C:O:H H H H H H:C:C::O:HH H H:C: :OO:H(10)(11)H:C:C H H(12)NH:N:C::O:H H习题1-3C C H H HO Cl :::::(1)(2)C C HH H C O ::::H H (3)H C N N H三价三价正确N 原子应带电荷更改为:C H H H O ::::(1)(2)C C HH H C O ::::H HH (3)H N N HCl ::::(4)(5)(6)C O HH H H H O ::C OH H::::O 原子应带电荷C 原子应带电荷O 原子应带电荷更改为::::(4)(5)(6)C O HH HH C HN O ::C N OH H::::习题1-3(1)CH 3CHCH 2CH 2CH 2Cl(2)CH 3CHCH 2CH 2CHCH 3OH OCH 3ClBrOHOCH 3(3)C CH 3H 3C CH 3CH 2CH 2Cl(4)(CH 3)2NCH 2CH 2CH 3N(5)CH 3CH 2COCH 3(6)(CH 3)2CHCH 2CHOH OO习题1-4(1)可以,因为轨道可以有效重叠成键,如下图(a );(2)不可以,因为轨道间不是同位相相加,故不能有效重叠成键,如下图(b )和(c )。
(a)(b)(c)习题1-5*(1)因为反键分子轨道上有一个电子,只具有相对稳定性;(2)因为成键与反键分子轨道都全部充满电子,体系能量没有有效降低,所以不能稳定存在; (3)两个氮原子的2p 轨道各有3个单电子,它们相互结合形成三个成键轨道和三个反键轨道,而6个电子将在成对地填充在三个成键轨道上,所以N 2分子可以稳定存在;(4)O 2-可以看成是1个O (4个2p 电子)与1个O -(5个2p 电子)结合而成,各自的3个2p 轨道组成3个成键和3个反键轨道,9个电子在成对填充满3个成键轨道后,还有3个电子在反键轨道,因此,该负离子具有相对稳定性。

第一章 有机化合物分子结构基础习题1-1H:Cl(2)H:O:N::O(3)H:N:N:H HH (1)O::C::O O(4)(5)Na(6)+(7)(8)(9)H:C:C:O:H H H H H H:C:C::O:HH H H:C: :O O:H(10)(11)H:C:C H H(12)NH:N:C::O:H H习题1-3C C H H O Cl :::::(1)(2)C C HH C O ::::(3)H N N H三价三价正确N 原子应带电荷更改为:C H H O ::::(1)(2)C C HH C O ::::H (3)H N N HCl ::::(4)(5)(6)O HH H H H O ::OH H::::O 原子应带电荷C 原子应带电荷O 原子应带电荷更改为::::(4)(5)(6)O HH HH C H N O ::C N OH H::::第二章 饱和碳氢化合物习题2-1 (1) C 6H 14:CH 3CH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 2CHCH 33CH 3CH 2CHCH 2CH 3CH 3CHCHCH 3CH 32CH 33H 33CH 33(2) C 7H 16: CH 3CH 2CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 2CH 3CH 3CH 2CHCH 2CH 2CH 333CH 3CHCHCH 2CH 3CH 3CHCH 2CHCH 3CH 32CH 2CH 3H 33H 33CH 33 CH 3CH 22CH 3CH 3CH 2CHCH 2CH 3CH 332CH 3H 3C C CHCH 3CH 3H 33习题2-2CH 3CHCHCHCH 2CH 2CH 33CH 32CH 3(1)(2)CH 2CH 3H 3CCH 31o1o 1o 1o1o2o 2o 2o2o2o 2o 2o1o1o1o3o 3o 3o 3o3o3o习题2-3(1) 2,3,4-三甲基已烷 2,3,4-trimethylhexane (2) 4-甲基-3-乙基庚烷 3-ethyl-4-methylheptane习题2-4(1)(2)<>CH 2CH 2CHCH 33CH 2CHCH 2CH 33CHCH 33CH 2C=CH 23CH 2CH 2CHO C CH 33OCH 3CH 2CHCH 3CH 2CCH 33<>(3)(4) CH 3CH 3H 3COCH 3(5)(6)><OCH 3习题2-5(1) 2,3,5-三甲基-4-丙基庚烷 2,3,5-trimethyl-4-propylheptane (2) 3-甲基-4,5-二乙基庚烷 3,4-diethyl-5-methylheptane习题2-6(1) 2,2-二甲基-5-(1,2-二甲基丙基)壬烷2,2-dimethyl-5-(1,2-dimethylpropyl)nonane(2) 4,4-二甲基-5-乙基辛烷 5-ethyl-4,4-dimethyloctane习题2-7(1) 2,3-dimethylhexane CH 3CHCHCH 2CH 2CH 3H 33(2) 2,2-二甲基-4-丙基辛烷CH 32CHCH 2CH 2CH 2CH 33CH 32CH 2CH 3(3) 4-isopropyl-2,4,5-trimethylheptaneCH 3CHCH 2H 3CHCH 3H 3CHCH 2CH 33H 3C (4) 2,5-二甲基-4-异丁基辛烷CH 3CHCH 22CH 2CH 332CH(CH 3)2CH 3(5) 4,4-dimethyldecaneCH 3CH 2CH 22CH 2CH 2CH 2CH 2CH 3CH 2CH 32CH 3(6) 4-(1,1-dimethylethyl)octane CH 3CH 2CH 2CHCH 2CH 2CH 2CH 3C 3H 3C CH 3习题2-8H-H 重叠张力4.0 kJ·mol -1 H-CH 3重叠张力6.0 kJ·mol -1 CH 3- CH 3重叠张力11.0 kJ·mol -1 CH 3- CH 32邻位张力3.8 kJ·mol -1习题2-9ABCDEF能量A = C = E < B = D < F习题2-10ABCDEF能量A<C=E<B=F<D习题2-112,2,3,3-四甲基丁烷的构造式为(CH 3)3C-C(CH 3)3绕C2-C3σ键旋转只有两种极限构象(类似乙烷)。



有机化学精品课程第一章绪论第一节有机化学的研究对象一、有机化合物和有机化学1、有机化学、有机化合物的定义有机化学(organic chemistry)是研究有机化合物的来源、制备、结构、性能、应用以及有关理论和方法学的科学,是化学学科的一个分支,它的研究对象是有机化合物。
什么是有机化合物呢?早期化学家将所有物质按其来源分为两类,人们把从生物体(植物或动物)中获得的物质定义为有机化合物,无机化合物则被认为是从非生物或矿物中得到的。
现在绝大多数有机物已不是从天然的有机体内取得,但是由于历史和习惯的关系,仍保留着“有机”这个名词。
象人类认识其它事物一样,人们对有机化合物和有机化学的认识也是逐步深化的。
自从拉瓦锡(Lavoisier.A.L)和李比希(Von Liebig.J.F)创造有机化合物的分析方法之后,发现有机化合物均含有碳元素,绝大多数的含氢元素,此外,很多的有机化合物还含氧、硫、氮等元素。
于是,葛美林(Gmelin.L)凯库勒(KeKule .A)认为碳是有机化合物的基本元素,把“碳化合物称为有机化合物”,“有机化学定义为碳化合物的化学”。
后来,肖莱马(Schorlemmer,c.)在此基础上发展了这个观点,认为碳的四个价键除自己相连之外,其余与氢结合,于是就形成了各种各样的碳氢化合物——烃,其他有机化合物都是由别的元素取代烃中的氢衍生出来的,因此,把有机化学定义为研究烃及其衍生物的化学。
2、有机化合物的特性(1)对热不稳定,容易燃烧等),和无机化合物比较起来,除了极少数例外(如可作灭火剂的CCl4有机化合物不很稳定,受热容易分解,也很容易燃烧。
而且大多数有机化合物燃烧后变成气体,不留残渣,这和无机化合物不易着火,不能燃尽有所不同,所以,我们常用燃烧试验来区别化合物是有机物还是无机物。
(2)熔点较低有机化合物的熔点较低,一般在250。
C以下,只有极少数超过300。
C(3)难溶于水,易溶于有机溶剂除少数例外,大多数有机化合物难溶或不溶于水,易溶于酒精、乙醚、丙酮、汽油或苯等有机溶剂。

有机化学教案第一章第一章有机化合物的结构与性质一. 学习目的和要求1. 掌握有机化学的定义。
2. 掌握有机化合物区别于无机化合物的特点。
3. 掌握共价键理论的要点、共价键的均裂、异裂、共价键的属性及重要参数。
理解有机化合物的特点,从中弄清与无机化合物的主要区别,掌握主要官能团的表达式。
4.理解有机化合物的分类原则样和有机化学中的酸碱理论。
5.掌握有机化合物的分类方法。
6.了解有机化学的发展简史,了解有机化学在生活和生产中的作用,了解有机化学的学习方法。
二. 本章节重点、难点共价键理论、分子轨道理论以及共价键的键参数的概念及应用。
三.教学内容:1.1 有机化学、有机化合物的定义有机化学(Organic Chemistry)是化学学科的一个分支,研究有机化合物的来源、制备、结构、性能以及应用,它的研究对象是有机化合物。
按物质的来源分类,早期化学家把从生物体(植物或动物)中获得的物质定义为有机化合物,无机化合物则被认为是从非生物或矿物中得到的。
当然,我们知道现在绝大多数有机物已不是从天然的有机体内取得,但是由于历史和习惯的关系,仍保留着“有机”这个名词。
现在将有机化合物定义为含碳化合物,所以有机化学就是研究碳化合物的化学。
有机化合物的另一个定义是碳氢化合物及其衍生物体现有有机化合物在结构上的相互联系,所以有机化学也可以称作研究碳氢化合物及其衍生物的化学1.2 有机化合物的特点1 •(1)有机化合物种类繁多、数目庞大(已知有七百多万种、且还在不断增加),组成有(C,H,O, N ,P,S,X等)。
因为1)C原子自身相互结合能力强;2) 结合的方式多种多样(单键、双键、三键、链状、环状)3) 存在同分异构现象(构造异构、构型异构、构象异构)。
(2)物理性质方面特点是1) 挥发性大,熔点、沸点低;2) 水溶性差(大多不容或难溶于水,易溶于有机溶剂)。
(3)化学性质方面的特点是1) 易燃烧;2) 热稳定性差,易受热分解(许多化合物在200~300度就分解);3) 反应速度慢;4) 反应复杂,副反应多1.3共价键有机化合物中的原子都是以共价键结合起来的,从本质上讲,有机化学是研究共价键化合物的化学,因此,要研究有机化学应先了解有机化学中普遍存在的共价键。

第一章有机化合物分子结构基础(Structural Foundations for Organic Molecules)121.1 原子结构与价键理论1.2 有机化合物结构的表示方法1.3 分子轨道理论1.4 杂化轨道理论(sp 3、sp 2、sp )1.5 电负性与键的极性1.6 有机分子的基本骨架和官能团1.7 键的断裂方式与反应活性中间体的基本结构第一章重点讲解内容1.1 原子结构与价键理论原子结构Atom——nucleus和electrons electrons——moving around the nucleus原子轨道(atomic orbitals)根据量子力学原理,原子核外的电子只能在特定的原子轨道上运动,这些原子轨道有特定的能量和形状。
34碳的原子结构碳的原子轨道C 1s 2s 2p x 2p y 2p z碳的原子轨道的能级与电子排布E1s2s2p x 2p y 2p zElectronic configuration for carbon碳原子6个电子可占据5个原子轨道总的原子轨道能级:1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f核外电子排布三原则:¾能量最低原则(aufbau principle):电子优先进入能量较低的原子轨道。
¾泡利不相容原理(Pauli exclusion principle):每个轨道最多可以填充两个电子。
¾洪特规则(Hund’s rule):当电子数目少于能量相同的轨道(即简并轨道)数时,则以电子占据越多的轨道越稳定,以避免电子间的相互排斥。
5表1-1 有机化合物主要组成元素及相关周期或主族元素原子的核外电子排布IA IIA IIIA IVA VA VIA VIIA0H 1s1He 1s2Li 1s2 2s1Be1s22s2B1s22s22p1C1s22s22p2N1s22s22p3O1s22s22p4F1s22s22p5Ne1s22s22p6Na1s22s22p6 3s1Mg1s22s22p63s2Al1s22s22p63s23p1Si1s22s22p63s23p2P1s22s22p63s23p3S1s22s22p63s23p4Cl1s22s22p63s23p5Ar1s22s22p63s23p6八隅体(octet):最外层电子为全充满状态,能量最低,化学性质上表现为惰性。

有机化学一、有机化合物分子结构基础三个价键理论——形式电荷分子轨道理论与原子轨道的关系、键长键强键能、成键轨道反键轨道、键能与成键轨道能量的关系、波函数的概念、σ和σ*键π键π*键以及能级分裂的关系杂化轨道理论的提出和原理、不同杂化碳原子的电负性、亚氨基腈基结构、羰基结构键的极性表示方式以及与从分子轨道理论的分析σ c-f碳负离子的结构二、饱和碳氢化合物最简单的有机化合物、同分异构的分类十个碳以及正异新伯仲叔季的英文命名、中英文命名与次序规则、含有双键三键的次序规则乙烷的构象极限构象种类与两种作用力、乙烷丁烷构象异构体环数判断的两种方法、环状化合物四种分类、单环环烷烃命名的两个注意、多环化合物命名烷烃稳定性三种判断依据、贝尔环张力学说的局限性例子环烷烃的构象与两种作用力、单取代环己烷稳定性与构象、二取代环己烷两种异构问题有机化合物物理性质三方面以及表达含义分子间非共价作用主要三种作用力、影响氢键强度的两种性质、氢键的种类以及与熔沸点间的关系、偶级-偶级作用与沸点的关系、烷烃的熔点沸点三个变化规律以及特例以及它的溶解性能与疏水作用三、不饱和碳氢化合物构型异构两同一异与构象异构的区别、顺反与Z/E的区别、1,6-二甲基环己烯与1,2-二甲基环己烷的两个注意点以及2,3二甲基-1,3-环己二烯的注意点、烯烃中三种碳氢类型乙炔的常用英文名、烯炔的英文命名以及三个注意点烯烃的稳定性两种判断与一种常见判断以及排序、共轭二烯烃比孤立二烯烃稳定的两个原因、丙二烯的结构与它的特点苯的凯库勒式两个缺陷、共振极限结构式与共振杂化体的区别、共轭作用两种分类、a/b不饱和羰基化合物共振结构特征使其具有的反应特征、共轭结构书写的三个原则与符号以及共轭体系式的两个作用具有单双键交替结构单环化合物的命名、Huckel经验规则以及四个必要条件、【10】轮烯的特例分析以及【30】轮烯所反映出来的Huckel经验规则局限性、芳香性反芳香性和非芳香性的英文命名与含义、可能具有芳香性的三种类型、环戊二烯正、负离子引发出的化学反应能否进行以及共轭体系与分子轨道理论的稳定性判据的对比芳香烃的分类与联苯、蒽的命名、苯/苯甲基/苯基的英文命名、甲苯/二甲苯/苯乙烯/苯胺/苯酚/苯甲醛/苯磺酸/苯甲酸的英文命名两三个碳不饱和烃的熔点沸点比相应烷烃高的两个原因、顺反异构体熔沸点与稳定性的比较四、含杂原子官能团化合物和有机酸碱理论各卤素和硝基的英文命名、2-甲基-5-氯己烷的注意、(E)-5-((E)-1-丙烯氧基)-3-戊烯酸的结构以及英文命名、烯/炔+醇醛酮的英文命名、2-乙基-5-氧代己酸/4-氯甲酰基戊酸乙酯的写法以及英文命名、羧酸酯的英文命名两种方法、酸/羧酸的在两种情况下的使用及英文命名环状内酯和内酰胺系统命名/俗名的中英文命名卤代烃沸点从F到I增加的两个原因、卤代烃水中溶解性从F到I降低的两个原因诱导效应以及与消去反应的关系、苯酚/苯胺的结构特点、醇/酚/伯仲胺与叔胺/醚沸点比较乙醚提取有机物时的注意事项和解决办法以及常作为溶剂的原因Schiff碱、酸/碱能催化亲核加成的原因、羧酸及其衍生物与醛酮的不同结构特点及反应酰胺/羧酸/腈醇/醛酮/羧酸酯酰氯/醚的沸点顺序以及此顺序原因、酰胺沸点最高的两个原因近代酸碱三个代表理论及各自的特点与局限性、水的pKa值、有机化合物酸性及其影响因素有机化学中最弱酸及最弱碱、原子半径增大使酸性增强的两个原因、烷烃/胺/醇/水/酚/碳酸/羧酸pKa值、酚酸性比醇强的两个原因、诱导效应的特点、不同类型的醇在气液相中酸性的差异以及原因、超共轭效应与共轭效应的区别、苦味酸的pKa值、烷氧基表现不同电子差异的原因、取代基取代位置对苯酚的酸碱性影响分析、硝基的结构特点/电子效应特点以及连接在邻对位比间位酸性强的两个原因、邻硝基苯酚和对硝基苯酚的酸性比较及原因、常见取代基作用特点所分的五大类及代表、饱和/不饱和二元羧酸pKa1和pKa2比较以及两个特例、生物碱、伯仲叔胺的碱性比较及原因、无机质子酸/有机质子酸在无水体系中的特例、常用无机碱/有机碱及各注意事项、Lewis电子酸碱理论在有机化学中的六个应用含硫化合物与含氧化合物的五个差异、DMSO/DMF/亚砜的结构特点及作用具有杂环结构的三种人体必需氨基酸、吡啶/吡咯结构相同点与不同点及性质、有机金属试剂的比较七、有机化学反应的基本问题化学反应解离能及焓变的四种计算、热力学两个公式及注意事项、动力学两方程及指数因子反应过度太理论与Hammond假说作用及注意事项自由基卤代反应各步骤机理来源分析及与热力学、动力学的关系、烷烃不同类型氢活性与选择性三种类及其相互关系、自由基结构与稳定性关系、烷烃卤代反应两种情况下的立体化学自由基稳定性在取代位置上的联系、碳正离子结构与稳定性、碳负离子稳定性两个影响因素卡宾的四种制备方法及两种结构特征和性质、有机反应机理的研究方法八、sp3杂化碳原子的亲核取代反应有机溶剂两种分类以及各自作用、亲核取代反应能否进行的判断依据。


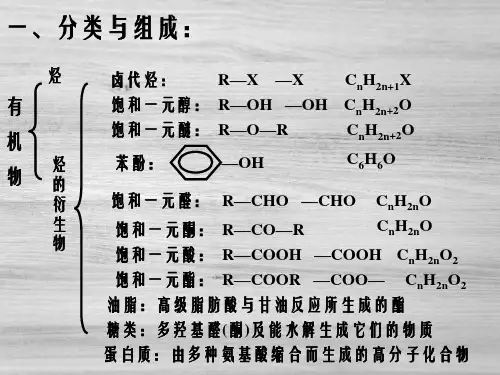
有机化学基础第一章认识有机化合物第一节有机化合物的分类第二节有机化合物的结构特点第三节有机化合物的命名第四节研究有机化合物的一般步骤和方法归纳与整理复习题第二章烃和卤代烃第一节脂肪烃第二节芳香烃第三节卤代烃归纳与整理复习题第三章烃的含氧衍生物第一节醇酚第二节醛第三节羧酸酯第四节有机合成归纳与整理复习题第四章生命中的基础有机化学物质第一节油脂第二节糖类第三节蛋白质和核酸归纳与整理复习题第五章进入合成有机高分子化合物的时代第一节合成高分子化合物的基本方法第二节应用广泛的高分子材料第三节功能高分子材料归纳与整理复习题结束语——有机化学与可持续发展高二化学选修5有机化学基础知识点整理2010-2-26一、重要的物理性质1.有机物的溶解性1难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的指分子中碳原子数目较多的,下同醇、醛、羧酸等;2易溶于水的有:低级的一般指NC≤4醇、醚、醛、酮、羧酸及盐、氨基酸及盐、单糖、二糖;它们都能与水形成氢键;3具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率;例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相同一溶剂的溶液中充分接触,加快反应速率,提高反应限度;② 苯酚:室温下,在水中的溶解度是属可溶,易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液;苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐;③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味;④有的淀粉、蛋白质可溶于水形成胶体..;蛋白质在浓轻金属盐包括铵盐溶液中溶解度减小,会析出即盐析,皂化反应中也有此操作;但在稀轻金属盐包括铵盐溶液中,蛋白质的溶解度反而增大;⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂;⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液;2.有机物的密度1小于水的密度,且与水溶液分层的有:各类烃、一氯代烃、氟代烃、酯包括油脂2大于水的密度,且与水溶液分层的有:多氯代烃、溴代烃溴苯等、碘代烃、硝基苯3.有机物的状态常温常压1个大气压、20℃左右1气态:① 烃类:一般NC≤4的各类烃注意:新戊烷CCH34亦为气态② 衍生物类:一氯甲烷CH3Cl,沸点为℃氟里昂CCl2F2,沸点为℃氯乙烯CH2==CHCl,沸点为℃甲醛HCHO,沸点为-21℃氯乙烷CH3CH2Cl,沸点为℃一溴甲烷CH3Br,沸点为℃四氟乙烯CF2==CF2,沸点为℃甲醚CH3OCH3,沸点为-23℃甲乙醚CH3OC2H5,沸点为℃环氧乙烷 ,沸点为℃2液态:一般NC在5~16的烃及绝大多数低级衍生物;如,己烷CH3CH24CH3环己烷甲醇CH3OH 甲酸HCOOH溴乙烷C2H5Br 乙醛CH3CHO溴苯C6H5Br 硝基苯C6H5NO2★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态3固态:一般NC在17或17以上的链烃及高级衍生物;如,石蜡C16以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态★特殊:苯酚C6H5OH、苯甲酸C6H5COOH、氨基酸等在常温下亦为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示:☆三硝基甲苯俗称梯恩梯TNT为淡黄色晶体;☆部分被空气中氧气所氧化变质的苯酚为粉红色;☆ 2,4,6—三溴苯酚为白色、难溶于水的固体但易溶于苯等有机溶剂;☆苯酚溶液与Fe3+aq作用形成紫色H3FeOC6H56溶液;☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液胶遇碘I2变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色;5.有机物的气味许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:☆甲烷无味☆乙烯稍有甜味植物生长的调节剂☆液态烯烃汽油的气味☆乙炔无味☆苯及其同系物芳香气味,有一定的毒性,尽量少吸入;☆一卤代烷不愉快的气味,有毒,应尽量避免吸入;☆二氟二氯甲烷氟里昂无味气体,不燃烧;☆ C4以下的一元醇有酒味的流动液体☆ C5~C11的一元醇不愉快气味的油状液体☆ C12以上的一元醇无嗅无味的蜡状固体☆乙醇特殊香味☆乙二醇甜味无色黏稠液体☆丙三醇甘油甜味无色黏稠液体☆苯酚特殊气味☆乙醛刺激性气味☆乙酸强烈刺激性气味酸味☆低级酯芳香气味☆丙酮令人愉快的气味二、重要的反应1.能使溴水Br2/H2O褪色的物质1有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀;③ 通过氧化反应使之褪色:含有—CHO醛基的有机物有水参加反应注意:纯净的只含有—CHO醛基的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯2无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1有机物:含有、—C≡C—、—OH较慢、—CHO的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物与苯不反应2无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应取代反应与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体;与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体;4.既能与强酸,又能与强碱反应的物质12Al + 6H+ == 2 Al3+ + 3H2↑2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑2Al2O3 + 6H+ == 2 Al3+ + 3H2OAl2O3 + 2OH- == 2 AlO2- + H2O3AlOH3 + 3H+ == Al3+ + 3H2OAlOH3 + OH- == AlO2- + 2H2O4弱酸的酸式盐,如NaHCO3、NaHS等等NaHCO3 + HCl == NaCl + CO2↑ + H2ONaHCO3 + NaOH == Na2CO3 + H2ONaHS + HCl == NaCl + H2S↑NaHS + NaOH == Na2S + H2O5弱酸弱碱盐,如CH3COONH4、NH42S等等2CH3COONH4 + H2SO4 == NH42SO4 + 2CH3COOHCH3COONH4 + NaOH == CH3COONa + NH3↑+ H2ONH42S + H2SO4 == NH42SO4 + H2S↑NH42S +2NaOH == Na2S + 2NH3↑+ 2H2O6氨基酸,如甘氨酸等H2NCH2COOH + HCl → HOOCCH2NH3ClH2NCH2COOH + NaOH → H2NCH2COONa + H2O7蛋白质蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应;5.银镜反应的有机物1发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖葡萄糖、麦芽糖等2银氨溶液AgNH32OH多伦试剂的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失;3反应条件:碱性、水浴加热.......若在酸性条件下,则有AgNH32+ + OH - + 3H+ == Ag+ + 2NH4+ + H2O而被破坏;4实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出5有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == AgNH32OH + 2H2O银镜反应的一般通式:RCHO + 2AgNH32OH 2 Ag↓+ RCOONH4 + 3NH3 + H2O记忆诀窍:1—水盐、2—银、3—氨甲醛相当于两个醛基:HCHO + 4AgNH32OH4Ag↓+ NH42CO3 + 6NH3 + 2H2O乙二醛:OHC-CHO + 4AgNH32OH4Ag↓+ NH42C2O4 + 6NH3 + 2H2O甲酸:HCOOH + 2 AgNH32OH 2 Ag↓+ NH42CO3 + 2NH3 + H2O过量葡萄糖:CH2OHCHOH4CHO +2AgNH32OH2Ag↓+CH2OHCHOH4COONH4+3NH3 + H2O6定量关系:—CHO~2AgNH2OH~2 AgHCHO~4AgNH2OH~4 Ag6.与新制CuOH2悬浊液斐林试剂的反应1有机物:羧酸中和、甲酸先中和,但NaOH仍过量,后氧化、醛、还原性糖葡萄糖、麦芽糖、甘油等多羟基化合物;2斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液即斐林试剂;3反应条件:碱过量、加热煮沸........4实验现象:①若有机物只有官能团醛基—CHO,则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有砖红色沉淀生成;②若有机物为多羟基醛如葡萄糖,则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有砖红色沉淀生成;5有关反应方程式:2NaOH + CuSO4 == CuOH2↓+ Na2SO4RCHO + 2CuOH2RCOOH + Cu2O↓+ 2H2OHCHO + 4CuOH2CO2 + 2Cu2O↓+ 5H2OOHC-CHO + 4CuOH2HOOC-COOH + 2Cu2O↓+ 4H2OHCOOH + 2CuOH2CO2 + Cu2O↓+ 3H2OCH2OHCHOH4CHO + 2CuOH2CH2OHCHOH4COOH + Cu2O↓+ 2H2O6定量关系:—COOH~ CuOH2~ Cu2+酸使不溶性的碱溶解—CHO~2CuOH2~Cu2O HCHO~4CuOH2~2Cu2O7.能发生水解反应的有机物是:卤代烃、酯、糖类单糖除外、肽类包括蛋白质;HX + NaOH == NaX + H2OHRCOOH + NaOH == HRCOONa + H2O RCOOH + NaOH == RCOONa + H2O 或8.能跟FeCl3溶液发生显色反应的是:酚类化合物;9.能跟I2发生显色反应的是:淀粉;10.能跟浓硝酸发生颜色反应的是:含苯环的天然蛋白质;三、各类烃的代表物的结构、特性:类别烷烃烯烃炔烃苯及同系物通式C n H2n+2n≥1C n H2n n≥2C n H2n-2n≥2C n H2n-6n≥6代表物结构式H—C≡C—H相对分子质量Mr16282678碳碳键长×10-10m键角109°28′约120°180°120°分子形状正四面体6个原子共平面型4个原子同一直线型12个原子共平面正六边形主要化学性质光照下的卤代;裂化;不使酸性KMnO4溶液褪色跟X2、H2、HX、H2O、HCN加成,易被氧化;可加聚跟X2、H2、HX、HCN加成;易被氧化;能加聚得导电塑料跟H2加成;FeX3催化下卤代;硝化、磺化反应四、烃的衍生物的重要类别和各类衍生物的重要化学性质类别通式官能团代表物分子结构结点主要化学性质卤代烃一卤代烃:R—X多元饱和卤代烃:C n H2n+2-m X m卤原子—XC2H5BrMr:109卤素原子直接与烃基结合β-碳上要有氢原子才能发生消去反应1.与NaOH水溶液共热发生取代反应生成醇2.与NaOH醇溶液共热发生消去反应生成烯醇一元醇: R—OH饱和多元醇: C n H2n+2O m 醇羟基—OHCH3OHMr:32C2H5OHMr:46羟基直接与链烃基结合, O—H及C—O均有极性;β-碳上有氢原子才能发生消去反应;α-碳上有氢原子才能被催化氧化,伯醇氧化为醛,仲醇氧化为酮,叔醇不能被催化氧化;1.跟活泼金属反应产生H22.跟卤化氢或浓氢卤酸反应生成卤代烃3.脱水反应:乙醇140℃分子间脱水成醚170℃分子内脱水生成烯4.催化氧化为醛或酮5.一般断O—H键与羧酸及无机含氧酸反应生成酯醚R—O—R′醚键C2H5O C2H5Mr:74C—O键有极性性质稳定,一般不与酸、碱、氧化剂反应酚酚羟基—OH Mr:94—OH直接与苯环上的碳相连,受苯环影响能微弱电离;1.弱酸性2.与浓溴水发生取代反应生成沉淀3.遇FeCl3呈紫色4.易被氧化醛醛基HCHOMr:30Mr:44HCHO相当于两个—CHO有极性、能加成;1.与H2、HCN等加成为醇2.被氧化剂O2、多伦试剂、斐林试剂、酸性高锰酸钾等氧化为羧酸酮羰基Mr:58有极性、能加成与H2、HCN加成为醇不能被氧化剂氧化为羧酸羧酸羧基Mr:60受羰基影响,O—H能电离出H+,受羟基影响不能被加成;1.具有酸的通性2.酯化反应时一般断羧基中的碳氧单键,不能被H2加成3.能与含—NH2物质缩去水生成酰胺肽键酯酯基HCOOCH3Mr:60Mr:88酯基中的碳氧单键易断裂1.发生水解反应生成羧酸和醇2.也可发生醇解反应生成新酯和新醇硝酸酯RONO2硝酸酯基—ONO2不稳定易爆炸硝基化合物R—NO2硝基—NO2一硝基化合物较稳定一般不易被氧化剂氧化,但多硝基化合物易爆炸氨基酸RCHNH2COOH氨基—NH2羧基—COOHH2NCH2COOHMr:75—NH2能以配位键结合H+;—COOH能部分电离出H+两性化合物能形成肽键蛋白质结构复杂不可用通式表示肽键氨基—NH2羧基—COOH酶多肽链间有四级结构1.两性2.水解3.变性4.颜色反应生物催化剂5.灼烧分解糖多数可用下列通式表示:C n H2O m羟基—OH醛基—葡萄糖CH2OHCHOH4CHO淀粉C6H10O5 n多羟基醛或多羟基酮或它们的缩合物1.氧化反应还原性糖2.加氢还原CHO羰基纤维素C6H7O2OH3 n3.酯化反应4.多糖水解5.葡萄糖发酵分解生成乙醇油脂酯基可能有碳碳双键酯基中的碳氧单键易断裂烃基中碳碳双键能加成1.水解反应皂化反应2.硬化反应鉴别有机物,必须熟悉有机物的性质物理性质、化学性质,要抓住某些有机物的特征反应,选用合适的试剂,一一鉴别它们;试剂名称酸性高锰酸钾溶液溴水银氨溶液新制CuOH2FeCl3溶液碘水酸碱指示剂NaHCO3少量过量饱和被鉴别物质种类含碳碳双键、三键的物质、烷基苯;但醇、醛有干扰;含碳碳双键、三键的物质;但醛有干扰;苯酚溶液含醛基化合物及葡萄糖、果糖、麦芽糖含醛基化合物及葡萄糖、果糖、麦芽糖苯酚溶液淀粉羧酸酚不能使酸碱指示剂变色羧酸现象酸性高锰酸钾紫红色褪色溴水褪色且分层出现白色沉淀出现银镜出现红色沉淀呈现紫色呈现蓝色使石蕊或甲基橙变红放出无色无味气体2.卤代烃中卤素的检验取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化.......,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素;3.烯醛中碳碳双键的检验1若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键;2若样品为水溶液,则先向样品中加入足量的新制CuOH2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化.......,再加入溴水,若褪色,则证明含有碳碳双键;★若直接向样品水溶液中滴加溴水,则会有反应:—CHO + Br2 + H2O → —COOH + 2HBr 而使溴水褪色;4.二糖或多糖水解产物的检验若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH 溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,水浴加热,观察现象,作出判断;5.如何检验溶解在苯中的苯酚取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液或过量饱和溴水......,若溶液呈紫色或有白色沉淀生成,则说明有苯酚;★若向样品中直接滴入FeCl3溶液,则由于苯酚仍溶解在苯中,不得进入水溶液中与Fe3+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀;★若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀;6.如何检验实验室制得的乙烯气体中含有CH2=CH2、SO2、CO2、H2O将气体依次通过无水硫酸铜、品红溶液、饱和Fe2SO43溶液、品红溶液、澄清石灰水、检验水检验SO2除去SO2确认SO2已除尽检验CO2溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液检验CH2=CH2;六、混合物的分离或提纯除杂七、有机物的结构牢牢记住:在有机物中H:一价、C:四价、O:二价、N氨基中:三价、X卤素:一价一同系物的判断规律1.一差分子组成差若干个CH22.两同同通式,同结构3.三注意1必为同一类物质;2结构相似即有相似的原子连接方式或相同的官能团种类和数目;3同系物间物性不同化性相似;因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物;此外,要熟悉习惯命名的有机物的组成,如油酸、亚油酸、软脂酸、谷氨酸等,以便于辨认他们的同系物;二、同分异构体的种类1.碳链异构2.位置异构3.官能团异构类别异构详写下表4.顺反异构5.对映异构不作要求常见的类别异构组成通式可能的类别典型实例C n H2n烯烃、环烷烃CH2=CHCH3与C n H2n-2炔烃、二烯烃CH≡C—CH2CH3与CH2=CHCH=CH2C n H2n+2O饱和一元醇、醚C2H5OH与CH3OCH3CH3CH2CHO、CH3COCH3、CH=CHCH2OH与醛、酮、烯醇、环醚、环C n H2n O醇C n H2n O2羧酸、酯、羟基醛CH3COOH、HCOOCH3与HO—CH3—CHOC n H2n-6O酚、芳香醇、芳香醚与C n H2n+1NO2硝基烷、氨基酸CH3CH2—NO2与H2NCH2—COOH葡萄糖与果糖C6H12O6、C n H2O m单糖或二糖蔗糖与麦芽糖C12H22O11三、同分异构体的书写规律书写时,要尽量把主链写直,不要写得扭七歪八的,以免干扰自己的视觉;思维一定要有序,可按下列顺序考虑:1.主链由长到短,支链由整到散,位置由心到边,排列邻、间、对;2.按照碳链异构→位置异构→顺反异构→官能团异构的顺序书写,也可按官能团异构→碳链异构→位置异构→顺反异构的顺序书写,不管按哪种方法书写都必须防止漏写和重写;3.若遇到苯环上有三个取代基时,可先定两个的位置关系是邻或间或对,然后再对第三个取代基依次进行定位,同时要注意哪些是与前面重复的;四、同分异构体数目的判断方法1.记忆法记住已掌握的常见的异构体数;例如:1凡只含一个碳原子的分子均无异构;2丁烷、丁炔、丙基、丙醇有2种;3戊烷、戊炔有3种;4丁基、丁烯包括顺反异构、C8H10芳烃有4种;5己烷、C7H8O含苯环有5种;6C8H8O2的芳香酯有6种;7戊基、C9H12芳烃有8种;2.基元法例如:丁基有4种,丁醇、戊醛、戊酸都有4种3.替代法例如:二氯苯C6H4Cl2有3种,四氯苯也为3种将H替代Cl;又如:CH4的一氯代物只有一种,新戊烷CCH34的一氯代物也只有一种;4.对称法又称等效氢法等效氢法的判断可按下列三点进行:1同一碳原子上的氢原子是等效的;2同一碳原子所连甲基上的氢原子是等效的;3处于镜面对称位置上的氢原子是等效的相当于平面成像时,物与像的关系;五、不饱和度的计算方法1.烃及其含氧衍生物的不饱和度2.卤代烃的不饱和度3.含N有机物的不饱和度1若是氨基—NH2,则2若是硝基—NO2,则3若是铵离子NH4+,则八、具有特定碳、氢比的常见有机物牢牢记住:在烃及其含氧衍生物中,氢原子数目一定为偶数,若有机物中含有奇数个卤原子或氮原子,则氢原子个数亦为奇数;①当nC︰nH= 1︰1时,常见的有机物有:乙炔、苯、苯乙烯、苯酚、乙二醛、乙二酸;②当nC︰nH= 1︰2时,常见的有机物有:单烯烃、环烷烃、饱和一元脂肪醛、酸、酯、葡萄糖;③当nC︰nH= 1︰4时,常见的有机物有:甲烷、甲醇、尿素CONH22;④当有机物中氢原子数超过其对应烷烃氢原子数时,其结构中可能有—NH 2或NH 4+,如甲胺CH 3NH 2、醋酸铵CH 3COONH 4等;⑤烷烃所含碳的质量分数随着分子中所含碳原子数目的增加而增大,介于75%~%之间;在该同系物中,含碳质量分数最低的是CH 4;⑥单烯烃所含碳的质量分数随着分子中所含碳原子数目的增加而不变,均为%; ⑦单炔烃、苯及其同系物所含碳的质量分数随着分子中所含碳原子数目的增加而减小,介于%~%之间,在该系列物质中含碳质量分数最高的是C 2H 2和C 6H 6,均为%; ⑧含氢质量分数最高的有机物是:CH 4⑨一定质量的有机物燃烧,耗氧量最大的是:CH 4⑩完全燃烧时生成等物质的量的CO 2和H 2O 的是:单烯烃、环烷烃、饱和一元醛、羧酸、酯、葡萄糖、果糖通式为C n H 2n O x 的物质,x=0,1,2,……;九、重要的有机反应及类型1.取代反应酯化反应水解反应C 2H 5Cl+H 2O ∆−−→−NaOHC 2H 5OH+HClCH 3COOC 2H 5+H 2O −−−→−无机酸或碱CH 3COOH+C 2H 5OH2.加成反应3.氧化反应2C 2H 2+5O 2−−→−点燃4CO 2+2H 2O2CH 3CH 2OH+O 2℃网550−−→−Ag 2CH 3CHO+2H 2O 2CH 3CHO+O 2℃~锰盐7565−−→− CH 3CHO+2AgNH 32OH −→−∆+2Ag↓+3NH 3+H 2O4.还原反应5.消去反应C 2H 5OH ℃浓17042−−−→−SO H CH 2═CH 2↑+H 2O CH 3—CH 2—CH 2Br+KOH ∆−−→−乙醇CH 3—CH═CH 2+KBr+H 2O 7.水解反应 卤代烃、酯、多肽的水解都属于取代反应8.热裂化反应很复杂C 16H 34∆−→−C 8H 16+C 8H 16 C 16H 34∆−→−C 14H 30+C 2H 4 C 16H 34∆−→−C 12H 26+C 4H 8……9.显色反应含有苯环的蛋白质与浓HNO 3作用而呈黄色 10.聚合反应11.中和反应十、一些典型有机反应的比较1.反应机理的比较1醇去氢:脱去与羟基相连接碳原子上的氢和羟基中的氢,形成;例如:+ O 2−→−羟基所连碳原子上没有氢原子,不能形成 ,所以不发生失氢氧化反应;2消去反应:脱去—X 或—OH 及相邻碳原子上的氢,形成不饱和键;例如:与Br 原子相邻碳原子上没有氢,所以不能发生消去反应;3酯化反应:羧酸分子中的羟基跟醇分子羟基中的氢原子结合成水,其余部分互相结合成酯;例如:2.反应现象的比较 例如:与新制CuOH 2悬浊液反应的现象:沉淀溶解,出现绛蓝色溶液−→−存在多羟基; 沉淀溶解,出现蓝色溶液−→−存在羧基; 加热后,有红色沉淀出现−→−存在醛基; 3.反应条件的比较同一化合物,反应条件不同,产物不同;例如:1CH 3CH 2OH ℃浓17042−−−→−SO H CH 2=CH 2↑+H 2O 分子内脱水 2CH 3CH 2OH ℃浓14042−−−→−SO H CH 3CH 2—O —CH 2CH 3+H 2O 分子间脱水 2CH 3—CH 2—CH 2Cl+NaOH ∆−−→−O H 2CH 3CH 2CH 2OH+NaCl 取代 CH 3—CH 2—CH 2Cl+NaOH ∆−−→−乙醇CH 3—CH=CH 2+NaCl+H 2O 消去 3一些有机物与溴反应的条件不同,产物不同;十一、几个难记的化学式硬脂酸十八酸——C17H35COOH 硬脂酸甘油酯——软脂酸十六酸,棕榈酸——C15H31COOH油酸9-十八碳烯酸——CH3CH27CH=CHCH27COOH亚油酸9,12-十八碳二烯酸——CH3CH24CH=CHCH2CH=CHCH27COOH鱼油的主要成分:EPR二十碳五烯酸——C19H29COOH DHR二十二碳六烯酸——C21H31COOH 银氨溶液——AgNH32OH葡萄糖C6H12O6——CH2OHCHOH4CHO果糖C6H12O6——CH2OHCHOH3COCH2OH蔗糖——C12H22O11非还原性糖麦芽糖——C12H22O11还原性糖淀粉——C6H10O5n非还原性糖纤维素——C6H7O2OH3n非还原性糖。