硅酸盐分析课后答案newest
- 格式:docx
- 大小:60.13 KB
- 文档页数:3
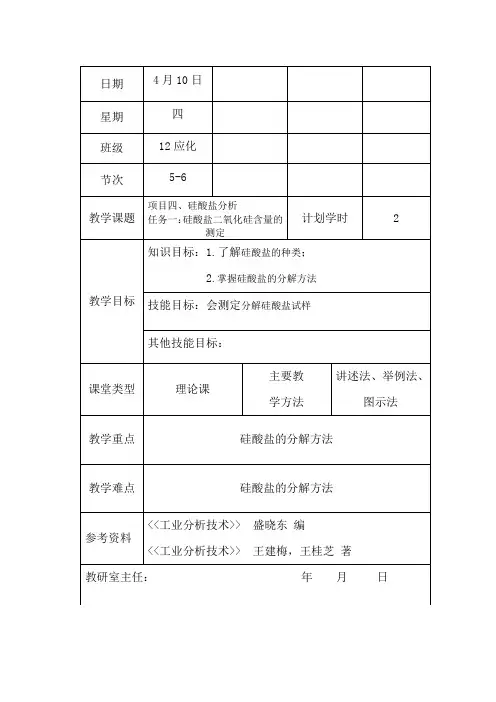
日期4月10日星期四班级12应化节次5-6教学课题项目四、硅酸盐分析任务一:硅酸盐二氧化硅含量的测定计划学时 2教学目标知识目标:1.了解硅酸盐的种类;2.掌握硅酸盐的分解方法技能目标:会测定分解硅酸盐试样其他技能目标:课堂类型理论课主要教学方法讲述法、举例法、图示法教学重点硅酸盐的分解方法教学难点硅酸盐的分解方法参考资料<<工业分析技术>> 盛晓东编<<工业分析技术>> 王建梅,王桂芝著教研室主任:年月日教学内容及过程设计一、水分的测定水分可分为吸附水和化合水。
1、吸附水吸附水在105 ~110℃下烘2h,称重测定。
2、化合水化合水包括结晶水和结构水两部分。
结晶水是以H2O分子状态存在于矿物晶格中,如石膏CaSO4·2H2O。
结晶水通常在300 ℃以下灼烧即可排出。
结构水是以化合状态的氢或氢氧根存在于矿物的晶格中,需加热到300 ~1300℃才能分解而放出。
化合水的测定方法有重量法、气相色谱法、库仑法等。
二、烧失量的测定烧失量又称为灼烧减量,是试样在1000 ℃灼烧后所失去的质量。
烧失量主要包括化合水、二氧化碳、和少量的硫、氟、氯、有机质等。
烧失量是试样中各组分在灼烧时的各种化学反应所引起的质量增加和减少的代数和。
因此,当试样较为复杂时,一般不测烧失量。
三、二氧化硅含量的测定1、氯化铵重量法(1)原理试样用无水Na2CO3烧结,使不溶的硅酸盐转化为可溶性的硅酸钠,用盐酸分解熔融块。
Na2SiO3+2HCl=H2SiO3+2NaCl再加入固体氯化铵,在沸水浴上加热蒸发,使硅酸脱水析出,沉淀用滤纸过滤后,灼烧,得到含有铁、铝等杂质的不纯二氧化硅。
用HF处理沉淀,使其中的SiO2以SiF4形式挥发,失去的质量即为纯SiO2的质量。
SiO2 + 6HF = H2SiF6 + 2H2OH2SiF6 = SiF4 ↑+ 2HF再用分光光度法测定滤液中可溶性的SiO2的量,二者之和即为SiO2的总量(GB/T176-1996中规定的基准法)。


22、硅酸盐工业新型无机非金属材料1.复习重点水泥工业和玻璃工业的基本原理;新型无机非金属材料的特性及主要用途2.难点聚焦1.硅酸(H2SiO3)酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl == H2SiO3+2NaCl硅胶多孔疏松,可作干燥剂,催化剂的载体。
四.硅酸盐硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。
一般不溶于水。
(Na2SiO3、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。
常用硅酸盐产品:玻璃、陶瓷、水泥。
2.硅单质与碳相似,有晶体和无定形两种。
晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),五.氯元素:位于第三周期第ⅦA族,原子结构:容易得到一个电子形成氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
3.例题精讲[例1]熔融氢氧化钠反应选用的器皿是 [ ]A.陶瓷坩埚B.石英坩埚 C.普通玻璃坩埚 D.生铁坩埚分析:陶瓷的成分中含有SiO2,石英的成分就是SiO2,玻璃的主要成分中也含有SiO2,而SiO2在高温下可以跟NaOH发生如下反应:SiO2+2NaOH Na2SiO3 所以A、B、C的器皿都不能选用,只能内生铁坩埚。
[例2]下列溶液中可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是 [ ]。
A.硅酸钠溶液B.氢氟酸C.氢氧化钠溶液 D.氯化钠溶液分析:玻璃的主要成分之一二氧化硅,它能跟氢氟酸迅速反应,所以,氢氟酸不能盛放在玻璃、陶瓷容器中,只能保存在铅皿或塑料瓶中。
氢氧化钠溶液与二氧化硅在常温下反应十分缓慢,所以可以盛放在玻璃瓶中,但瓶的磨口处的二氧化硅跟氢氧化钠缓慢反应后,生成的硅酸钠是一种矿物胶,使瓶塞与瓶口粘在一起,因此不能用磨口玻璃塞。
硅酸钠溶液可以用玻璃瓶盛放,只是不能用磨口玻璃塞(原因同氢氧化钠溶液)。




课时2 硅酸盐和硅单质目标与素养:1.了解硅酸盐的组成和性质及应用;知道硅的性质和用途。
(宏观辨识与变化观念)2.了解无机非金属材料的生产及用途。
(宏观辨识与社会责任)一、硅酸盐1.概念由硅、氧和金属组成的化合物的总称。
2.组成的表示通常用二氧化硅和金属氧化物的组合形式表示其组成。
例如:硅酸钠(Na 2SiO 3):Na 2O·SiO 2。
3.最简单的硅酸盐——Na 2SiO 3二、硅酸盐产品——无机非金属材料产品原料主要设备主要成分水泥石灰石、黏土水泥回转窑硅酸二钙 2CaO·SiO 2硅酸三钙 3CaO·SiO 2铝酸三钙 3CaO·Al 2O 3普通玻璃纯碱、石灰石、石英砂玻璃窑Na 2O·CaO·6SiO 2陶瓷黏土——三、其他含硅物质1.SiC:俗称金刚砂,类似金刚石的结构和性能。
2.含4%硅的硅钢具有导磁性,用作变压器铁芯。
3.硅橡胶:既耐高温又耐低温。
4.人造分子筛:作吸附剂和催化剂。
四、硅单质1.形态和结构2.单质硅的性质(1)物理性质①晶体硅是一种带有金属光泽的灰黑色固体,根据其结构分析可知,晶体硅熔点高、硬度大、有脆性。
②导电性介于导体和绝缘体之间,是良好的半导体材料。
(2)化学性质:常温下化学性质稳定,除氢氟酸和强碱外,不与其他物质发生反应。
Si与氢氟酸、NaOH溶液发生反应的化学方程式分别为Si+4HF===SiF4↑+2H2↑、Si+2NaOH+H2O===Na2SiO3+2H2↑。
3.重要用途(1)半导体材料,如硅芯片等。
(2)新型能源,如光电池等。
1.判断正误(正确的打“√”,错误的打“×”)(1)硅酸钠可以改写为Na2O·SiO2,故硅酸钠是混合物,含有Na2O和SiO2。
( )(2)硅酸钠俗称水玻璃,是一种防火剂。
( )(3)硅酸盐是一大类结构复杂的固态物质。
( )(4)普通玻璃和水泥的生产原料均含石灰石。


第四章硅酸盐分析习题与答案1、什么是硅酸盐工业分析?答:硅酸盐工业分析:综合利用分析化学的方法方法原理,对硅酸盐生产中的原料、燃料、半成品和产品的化学成分进行分析,及时提供准确可靠的测定数据。
2、通过查阅有关资料,对硅酸盐样品中二氧化硅的测定方法进行综述并简述其基本原理?答:(一)称量法(1)氢氟酸挥发称量法:试样在铂坩埚中经灼烧恒重后,加H2F2+H2SO4(或)硝酸处理后,再灼烧至恒重计算SiO2的含量。
(2)硅酸脱水灼烧称量法:强电解质或胶体破坏硅酸的水化外壳,促使硅酸溶胶微粒凝聚为较大的沉淀颗粒析出,灼烧称重。
(二)滴定法:间接法测定氟硅酸钾法-----氟硅酸钾沉淀分离酸碱滴定法。
SiO2在过量的钾氟离子的强酸介质中,能定量形成氟硅酸钾沉淀,经过滤洗涤中和除去残留酸在沸水中溶解再用氢氧化钠标液滴定水解产生的HF。
3、测定水泥及其原料中容量法测定三氧化二铁、三氧化二铝的方法原理如何?答:(1)测定三氧化二铁的方法和原理(一)EDTA直接滴定法在pH为1.8-2.0及60-70℃的溶液中,以磺基水杨酸为指示剂,用EDTA标准溶液直接滴定溶液中三价铁。
(二)原子吸收分光光度法试样经氢氟酸和高氯酸分解后,分取一定量的溶液,以锶盐消除硅、铝、钛等对铁的干扰。
在空气-乙炔火焰中,于波长248.3nm 处测定吸光度。
(2)测定三氧化二铝的方法和原理(一)EDTA直接滴定法于滴定铁后的溶液中,调整pH=3.0 ,在煮沸下用EDTA-铜和PAN 为指示剂,用EDTA标准滴定溶液滴定。
(二)铜盐返滴定法在滴定铁后的溶液中,加入对铝、钛过量的EDTA标准滴定溶液,于pH为3.8-4.0以PAN为指示剂,用硫酸铜标准滴定溶液回滴过量的EDTA,扣除钛的含量后即为氧化铝的含量。
4、什么是“烧失量”?答:烧失量:也称灼烧残渣是试样在950~1000度灼烧后所失去的质量一般主要指化合水和二氧化碳(还有少量的硫氟氯有机质等)。


硅酸盐工业热工基础作业答案2-1解:胸墙属于稳定无内热源的单层无限大平壁单值条件tw1=1300C tw2=300Cδ=450mm F=10 m2胸墙的平均温度Tav=(Tw1+TW2)/2=(1300+300)/2=800C根据平均温度算出导热系数的平均值λav=+x800=1。
48w/Q=λF(Tw1-Tw2)/δ=(1300-300)/=42-2解:窑墙属于稳定无内热源的多层平行无限大平壁由Q=t∆/R或q=t∆/Rt知,若要使通过胸墙的热量相同,要使单位导热面上的热阻相同才行单值条件δ1=40mm δ2=250mm λ1= λ2=m.硅藻土与红砖共存时,单位导热面热阻(三层)Rt1=δ1/λ1+δ2/λ2+ δ3/λ3=++δ3/λ3若仅有红砖(两层)Rt2=δ/λ2+δ3/λ3=δ/+δ3/λ3Rt1=⇒+=δ/得δ=370mm,即仅有红砖时厚度应为370mm。
2—3 解:窑顶属于稳定无内热源的单层圆筒壁单值条件δ=230mm R1= Tw1=700C Tw2=100C粘土砖的平均导热系数λav=3-3-R2=R1+δ=当L=1时,Q=2λ∏( Tw1-Tw2)/4Ln21d d=1.080.85因为R2/R1≤2,可近似把圆筒壁当作平壁处理,厚度δ=R2-R1,导热面积可以根据平均半径Rav=(R1+R2)/2求出。
做法与2-1同。
2-4解:本题属于稳定无内热源的多层圆筒壁单值条件λ1=50W/m。
C λ2=W/m。
C δ1=5mm δ2=95 mmTw1=300C Tw2=50C d1=175mm d2=185mm d3=375mm若考虑二者的热阻,每单位长度传热量Q=( Tw1-Tw2)X2π/(12131122d dLn Lnd dλλ+)=2502222.2711851375501750.1185XWLn Lnπ=+若仅考虑石棉的热阻,则Q’=(12)22502222.31 131375220.1185Tw Tw X XWdLn Lndππλ-==可见Q≈Q’,因而在计算中可略去钢管的热阻。
硅酸盐分析课后习题答案硅酸盐分析课后习题答案在化学分析中,硅酸盐的分析是一个重要的课题。
硅酸盐是一类含有硅元素的化合物,广泛存在于自然界中的岩石、土壤和矿物中。
硅酸盐的分析对于地质学、冶金学以及环境科学等领域具有重要意义。
下面将针对硅酸盐分析的几个习题进行详细解答。
1. 一种含有硅酸盐的土壤样品中,硅的含量为20%(质量分数),试问该土壤中硅酸盐的含量是多少?答:硅的原子量为28,硅酸盐中硅的相对原子质量为60。
根据硅的质量分数,可以得出硅酸盐的质量分数为:20% / 28 * 60 = 42.86%因此,该土壤中硅酸盐的含量为42.86%。
2. 一种含有硅酸盐的岩石样品中,硅的含量为2.5%(质量分数),试问该岩石中硅的摩尔分数是多少?答:硅的原子量为28,硅酸盐中硅的相对原子质量为60。
根据硅的质量分数,可以得出硅酸盐中硅的摩尔分数为:2.5% / 28 * 60 / (2.5% / 28 * 60 + (100% - 2.5%) / 28) ≈ 0.416因此,该岩石中硅的摩尔分数约为0.416。
3. 一种含有硅酸盐的水样中,硅的浓度为0.02 mol/L,试问该水样中硅酸盐的质量浓度是多少?答:硅的原子量为28,硅酸盐中硅的相对原子质量为60。
根据硅的浓度,可以得出硅酸盐的质量浓度为:0.02 mol/L * 60 g/mol = 1.2 g/L因此,该水样中硅酸盐的质量浓度为1.2 g/L。
4. 一种含有硅酸盐的岩石样品中,硅的质量浓度为0.5 g/L,试问该岩石中硅的摩尔浓度是多少?答:硅的原子量为28,硅酸盐中硅的相对原子质量为60。
根据硅的质量浓度,可以得出硅酸盐中硅的摩尔浓度为:0.5 g/L / 60 g/mol ≈ 0.00833 mol/L因此,该岩石中硅的摩尔浓度约为0.00833 mol/L。
5. 一种含有硅酸盐的土壤样品中,硅的质量浓度为0.1 g/L,试问该土壤中硅酸盐的含量是多少?答:硅的原子量为28,硅酸盐中硅的相对原子质量为60。
第2课时硅酸盐和硅单质[学习目标定位] 1.知道硅酸钠的性质和用途。
2.学会用氧化物的形式表示复杂硅酸盐的方法。
3.知道玻璃、水泥和陶瓷是硅酸盐制品以及生产它们的主要原料。
4.知道晶体硅是良好的半导体材料,能说出它的主要用途。
一硅酸盐1.下列含硅物质:①硅酸钙CaSiO3,②长石KAlSi3O8,③石棉CaMg3Si4O12,它们在组成上的相同点是都是由硅、氧和金属元素组成的化合物,共同的物质类别是硅酸盐。
它们种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,如硅酸钙CaSiO3可表示为CaO·SiO2,K2O·Al2O3·6SiO2,CaO·3MgO·4SiO2。
2.硅酸钠是一种白色固体,可溶于水,其水溶液俗称水玻璃。
若取两个小木条(或滤纸条),分别放入蒸馏水和硅酸钠饱和溶液中浸泡,取出稍沥干后,同时分别放置在酒精灯外焰处,观察到的现象是用蒸馏水浸泡的木条燃烧,用硅酸钠溶液浸泡的木条不燃烧,由此可得出的实验结论是硅酸钠耐高温,不能燃烧。
3.硅酸盐产品有着广泛的应用,大家熟悉的玻璃、水泥和陶瓷是常见的硅酸盐产品,也是使用量最大的无机非金属材料。
(1)阅读教材填写下表:(2)硅酸盐产品水泥与陶瓷的共同原料是黏土,水泥与玻璃的共同原料是石灰石。
4.特殊功能的含硅物质(1)金刚砂(SiC)具有类似金刚石的结构,硬度很大,可用作砂纸、砂轮磨料。
(2)硅钢(含硅4%)具有很高的导磁性,主要用作变压器铁芯。
(3)硅橡胶:既耐高温又耐低温,用于制造火箭、导弹、飞机的零件和绝缘材料等。
(4)人工制造的分子筛(具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂。
归纳总结硅酸盐的表示方法及性质(1)硅酸盐的概念是由硅、氧和金属组成的化合物的总称。
硅酸盐的表示方法:①将硅酸盐中所有元素都写成氧化物(二氧化硅和氧化物的组合)。
氧化物的书写顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
第四章硅酸盐分析习题及答案5.什么叫分析系统?硅酸盐岩石的经典分析系统和快速分析系统各有什么特点?答:分析系统:在同一份称样中,通过试样分解、分离和掩蔽等手续,使干扰元素的影响分别消除后,可以系统地、连贯地进行数个组分的依次测定。
经典分析系统的特点:建立在沉淀分离和重量法基础上,辅以滴定法和比色法,具有连续的显著性。
快速分析系统的特点:称样次数少,减免繁杂的分离,测定方法有足够的精密度、准确度和选择性,适用范围广。
6.请举出有代表性的硅酸盐岩石分析方案和分析流程。
答:以氢氧化钠熔融为主的快速分析方案和分析流程:见教材第64页。
18.在不同pH条件下,磺基水杨酸与Fe3+可分别形成几种配位数不同的络合物?通常选择在什么pH条件下进行铁的比色测定?为什么?答:Fe3+在不同的pH值下,可以与磺基水杨酸形成不同组成和颜色的几种络合物。
在pH为1.8~2.5的溶液中,可以形成红紫色的[Fe(SSal)]+;在pH为4~8的溶液中,可以形成褐色的[Fe(SSal)2]-;在pH为8~11.5的氨性溶液中,可以形成黄色的[Fe(SSal)3]3-;若pH>12,则不能形成络合物,而生成氢氧化铁沉淀。
通常选择pH=8~11的氨性溶液,因为此时测定铁具有稳定、简便、准确等特点。
22.H2O2比色法测定钛的机理是什么?为什么不宜在纯盐酸介质中显色?答:在H2SO4溶液中,四价钛与H2O2生成黄色络合物:TiO2++ H2O2==[ TiO(H2O2)]2+,其中最大吸收波长是420nm,在有H3PO4存在时,则为400nm。
在实际工作中,可以在400~450nm波长范围内测定。
在50mL溶液中含有0~500µg TiO2时,其颜色强度与浓度成正比,可用于钛的光度测定。
在HCl溶液中,当Cl-浓度很大时,钛以阴离子TiO62-状态存在,与H2O2作用时也形成黄色络阳离子但颜色较浅,因此不宜在盐酸介质中显色。
硅酸盐全分析一、样品前处理过程准确称取样品0.5g,加入5~6g NaOH①,用银坩埚在500~600℃②熔融20~30分钟③。
冷却后脱埚(放入100ml水中分别用蒸馏水和硝酸(1+20)④反复清洗坩埚3~4次)。
在搅拌下一次⑤加入25ml⑥浓盐酸溶解熔块浸出物。
再加入1~2ml 硝酸(1+1)⑦煮沸,得澄清试液,冷却至室温,最后定容至250ml。
①熔融过程中所需药品为优级纯(GR)或分析纯(AR)。
②铁矿石熔融需在600~700℃下,50~60分钟。
③熔融过程中应注意溶剂“爬埚”。
④可用胶头棒清洗。
硝酸尽量少用,防止银被溶解。
⑤一次加入可防止粘土类样品中硅胶析出。
石灰石样品应分次加入,防止大量喷出将试液带出。
CO2⑥若为铁矿石,用量为30~35ml。
⑦将Fe2+氧化为Fe3+。
⑧转移过程中应特别注意样品损失。
⑨粘土类及砂分析时称量应少于0.5g,铁粉类分析时称量约为0.3g。
二、元素分析1.硅元素分析上述试液定容后马上①吸出50ml于塑料烧杯中,一次加入15ml浓硝酸②后可待用。
在溶液中加入10ml 15%的氟化钾溶液,搅拌,冷却至室温。
再加入固体氯化钾,搅拌并压碎不溶颗粒,直至饱和。
放置10~15分钟,快速滤纸过滤。
塑料杯及沉淀用5%氯化钾溶液各洗涤2~3次③。
将滤纸连同沉淀置于原塑料杯中,沿杯壁加入10ml 10%氟化钾-乙醇溶液④及两滴酚酞指示剂,用氢氧化钠标准溶液中和未洗尽的酸,仔细搅动滤纸并擦洗杯壁,直至酚酞变为浅红(不计读数)。
后加入沸水⑤至300ml(沸水预先用氢氧化钠溶液中和至酚酞呈微红色),用氢氧化钠标准溶液滴定⑥至微红色并记下读数。
二氧化硅的百分含量:①防止长时间放置后硅胶沉积,使的试液中硅胶分布不均匀,造成测量误差。
②加入浓硝酸可防止硅胶沉积。
③KCl溶液总体积控制在20~25ml,尽量减少氟硅酸钾的水解反应,避免检测结果偏小。
④抑制氟硅酸钾的水解反应,避免检测结果偏小。
硅酸盐分析课后答案
n e w e s t
SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
第三章硅酸盐分析
1. 填空题
(1)用氯化铵重量法测定硅酸盐中的二氧化硅时,加入氯化铵的作用
是。
(2)可溶性二氧化硅的测定方法常采用。
(3)可以将硅钼黄还原为硅钼蓝的还原剂有。
(4)氟硅酸钾酸测定硅酸盐中的二氧化硅时,若采用氢氧化钾为熔剂,应在
坩埚中熔融;若以碳酸钾作熔剂,应在坩埚中熔融;若采用氢氧化钠做熔剂时,应在坩埚中熔融。
(5)用EDTA滴定法测定硅酸盐中的三氧化二铁时,使用的指示剂
是。
(6)硅酸盐水泥及熟料可采用法分解试样,也可以采用法溶解试样。
(7)用EDTA发测定水泥熟料中的Al
2O
3
时,使用的滴定剂和指示剂分别为
和。
(1)使得H
2SiO
3
迅速脱水析出
(2)硅钼蓝分光光度法
(3)硫酸亚铁、氯化亚锡、抗坏血酸。
(4)镍铂银
(5)磺基水杨酸或其钠盐
(6)碱熔酸熔
(7)EDTA PAN和等物质的量的EDTA-Cu(直接滴定法)/ PAN(铜盐返滴定法)
2. 称取某岩石样品1.000 g,以氟硅酸钾容量法测定硅的含量,滴定时消耗 mol/L NaOH标准溶液 mL,试求该试样中SiO
2
的质量分数。
由于SiO
2~4F~4NaOH,则W(SiO
2
)=M?V(NaOH)?c(NaOH)÷4×250/50×100%/m
其中M代表二氧化硅的分子量,V代表消耗NaOH的体积,c(NaOH)代表消耗NaOH的浓度,m为样品质量。
故计算得:W=×19×10-3×÷4×5×100%/1=%。
3. 称取含铁、铝的试样0.2015 g,溶解后调节溶液pH = ,以磺基水杨酸作指示剂,用 mol/LEDTA标准溶液滴定至红色消失并呈亮黄色,消耗 mL。
然后加入EDTA 标准溶液 mL,加热煮沸,调pH = ,以PAN作指示剂,趁热用 mol/L硫酸铜标准溶
液返滴,消耗 mL。
试计算试样中Fe
2O
3
和Al
2
O
3
的含量。
由题意可知,用EDTA滴定Fe3+,故:
n(Fe
2O
3
)=
2
1
n(Fe3+)=
2
1
C
EDTA
V
4. 采用配位滴定法分析水泥熟料中铁、铝、钙和镁的含量时,称取0.5000 g试样,碱熔后分离除去SiO
2
,滤液收集并定容于250 mL的容量瓶中,待测。
(1)移取 mL待测溶液,加入磺基水杨酸钠指示剂,快速调整溶液至pH = ,用T (CaO/EDTA) = mg/mL的EDTA标准溶液滴定溶液由紫红色变为亮黄色,消耗mL。
(2)在滴定完铁的溶液中,加入 mLEDTA 标准溶液,加热至70 ~ 80 ℃,加热pH =
的缓冲溶液,加热煮沸1 ~ 2 min ,稍冷后以PAN 为指示剂,用 mol/L 的硫酸铜标准溶液滴定过量的EDTA 至溶液变为亮紫色,消耗 mL 。
(3)移取 mL 待测溶液,掩蔽铁、铝、钛,然后用KOH 溶液调节溶液pH > 13,加入
几滴CMP 混合指示剂,用EDTA 标准溶液滴至黄绿色荧光消失并呈红色,消耗 mL 。
(4)移取 mL 待测溶液,掩蔽铁、铝、钛,加入pH = 的氨性缓冲溶液,以KB 为指
示剂,用EDTA 标准溶液滴定至纯蓝色,消耗 mL 。
若用二安替比林甲烷分光光度计法测定试样中TiO 2的含量为%,试计算水泥熟料
中Fe 2O 3、Al 2O 3、CaO 和MgO 的质量分数。
(1)由题中所知,测定的是铁的含量,则:
%28.5%100250
25)(21%1002502521%10025025)(32323232=⨯⨯=⨯⨯=⨯⨯=m M V CaO M T m M V C m O Fe m O Fe O Fe EDTA O Fe EDTA EDTA )(ω(2)由题中可知,测定的是铝的含量,则:
(3)由题中可知,测定的是钙的含量,则:
(4)由题中可知,测定的是镁的含量,则:。