专题讲解-界面现象-胶体化学
- 格式:doc
- 大小:2.20 MB
- 文档页数:23

表面吉布斯自由能和表面张力1、界面:密切接触的两相之间的过渡区(约几个分子的厚度)称为界面(interface),通常有液-气、液-固、液-液、固-气、固-液等界面,如果其中一相为气体,这种界面称为表面(surface)。
2、界面现象:由于界面两侧的环境不同,因此表面层的分子与液体内的分子受力不同:1.液体内部分子的吸引力是对称的,各个方向的引力彼此抵销,总的受力效果是合力为零;2.处在表面层的分子受周围分子的引力是不均匀的,不对称的。
由于气相分子对表面层分子的引力小于液体内部分子对表面层分子的引力,所以液体表面层分子受到一个指向液体内部的拉力,力图把表面层分子拉入内部,因此液体表面有自动收缩的趋势;同时,由于界面上有不对称力场的存在,使表面层分子有自发与外来分子发生化学或物理结合的趋势,借以补偿力场的不对称性。
由于有上述两种趋势的存在,在表面会发生许多现象,如毛细现象、润湿作用、液体过热、蒸气过饱和、吸附作用等,统界面现象。
3、比表面(Ao)表示多相分散体系的分散程度,定义为:单位体积(也有用单位质量的)的物质所具有的表面积。
用数学表达式,即为:A0=A/V高分散体系具有巨大的表面积。
下表是把一立方厘米的立方体逐渐分割成小立方体时,比表面的增长情况。
高度分散体系具有巨大表面积的物质系统,往往产生明显的界面效应,因此必须充分考虑界面效应对系统性质的影响。
4、表面功在温度、压力和组成恒定时,可逆地使表面积增加dA所需要对体系做的功,称为表面功(ω’)。
-δω’=γdA(γ:表面吉布斯自由能,单位:J.m-²)5、表面张力观察界面现象,特别是气-液界面的一些现象,可以觉察到界面上处处存在着一种张力,称为界面张力(interface tension)或表面张力(surface tension)。
它作用在表面的边界面上,垂直于边界面向着表面的中心并与表面相切,或者是作用在液体表面上任一条线两侧,垂直于该线沿着液面拉向两侧。

胶体界面化学知识点总结胶体界面化学是研究在胶体系统中发生的化学现象和过程的科学,它涉及到界面的性质、结构和变化等方面。
胶体界面化学的研究对理解胶体系统的基本特性和应用具有重要的意义。
下面将对胶体界面化学的相关知识点进行总结。
一、胶体概念胶体是由两种或两种以上的相组成的复合系统,其中一个相是固体,另一个或另一些是液相或气相。
这些相都是微观分散的,且不易被重力沉淀的稳定性。
胶体是一种介于溶液和悬浮液之间的分散系统,在胶体中,含有微粒的相称为分散相,微粒与溶剂形成的相称为连续相。
胶体颗粒的尺寸一般在1-1000nm之间。
根据分散相的性质不同,胶体又可以分为溶胶、凝胶和乳胶等。
二、胶体稳定性胶体的稳定性是指其分散相维持分散状态的能力。
胶体稳定性与表面活性剂的类型和浓度、电解质的存在和浓度、电荷作用、范德华力等因素有关。
当表面活性剂存在时,会在分散相的表面形成一层物理吸附膜来减少表面能,改变表面性质,从而稳定胶体。
电解质的存在可以中和分散相表面的电荷,减少静电斥力,使胶体不稳定。
电荷作用和范德华力也会影响胶体的稳定性。
了解这些因素对胶体稳定性的影响对于胶体的应用和制备具有重要的意义。
三、界面活性剂界面活性剂是一类具有分子结构中同时含有亲水性和疏水性基团的化合物,它们在液体界面上降低表面张力,促进液体的分散和乳化,并有较强的渗透性和复合物形成性。
界面活性剂的主要作用包括降低表面张力、增加分散性、稳定胶体、乳化和分散。
根据亲水性基团的不同,界面活性剂可以分为阴离子、阳离子、非离子和两性离子界面活性剂。
界面活性剂的选择和使用对于控制胶体的稳定性和调控乳液、泡沫等具有重要的作用。
四、胶体的表面性质胶体的表面性质是指胶体颗粒的表面具有的润湿性、黏附性、表面能等物理化学性质。
胶体颗粒的表面性质与界面活性剂的类型和浓度、电解质的存在和浓度、溶剂的性质等有关。
表面性质的研究对于控制胶体的稳定性、界面活性剂的选择和应用有着重要的意义。






第八章界面现象与胶体本章主要介绍气-液、气-固、液-固和液-液界面上的发生的界面现象,讨论附加压力及其引起的现象、吸附和润湿等。
介绍胶体基本性质、胶团结构和胶体的稳定性等。
简略介绍乳状液、泡沫和悬浮液等粗分散系统。
当物质以不同的相态共存时,任意两相之间的分隔面称作相的界面,简称界面。
常见的界面有气-液、气-固、液-液、液-固和固-固等五种界面。
其中气-液、气-固两种界面也称作表面。
发生在界面处的现象称为界面现象。
本章主要讨论发生在气-液、气-固两种界面处的现象,也称其为表面现象。
8.1 气液表面现象8.1.1 表面现象的产生界面并不是几何面,而是指处于两相之间,约为几个分子厚度的一层物质,故又称作界面层或界面相。
界面两侧的相称作体相。
界面层与体相在组成、结构、分子所处的能量状态和受力状况等方面都有明显的差别。
如图8.1所示,图8.1 为液体内部分子及表面层分子受力情况示意图体相内的分子,如分子A,受到周围分子的作用力统计地看是对称的,可相互抵消;界面层处于两体相之间,受到两相分子不同的作用,分子受力是不对称的,故界面层的分子例如分子B、C,有离开界面层进入体相的趋势,其宏观表现是界面将收缩至具有最小面积。
在相界面上的物质因为具有与体相不同的结构和性质,从而产生的物理现象和化学现象称为界面现象。
气-液和气-固界面上发生的界面现象也称为表面现象。
例如:毛细现象、润湿、吸附、多相催化等。
8.1.2 表面张力和比表面吉布斯函数把物质分散成细小微粒的程度称为分散度。
通常采用比表面积来表示分散度的大小,其定义为:单位质量或单位体积物质所具有的表面积,简称比表面,其数学表达式如下所示:(空两秒)A m=A/mA s =A/V式中,A m 和A s 分别为用单位质量和单位体积表示的比表面;A 为物质的总表面积;m 和V 分别为物质的质量和体积。
物质的表面现象与其分散度有关。
物质的颗粒越细,即物质的分散度越大,其比表面越大,物质的表面现象也越突出。

专题讲解-界面现象-胶体化学由于表面张力的作用,在弯曲表面下的液体于平面不同,它受到附加的压力(Ps)。
*. 如果液面是水平的,则表面张力f也是水平的。
当平衡时,沿周界的表。
面张力互相抵消。
此时液体表面内外压相等,而且等于表面上的外压力P*. 如果液面是弯曲的,则沿AB周界面上的表面张力f不是水平的。
当平衡时,表面张力将有一合力。
Δ当液面为凸形时,合力指向液体内部。
表面内部的液体分子所受压力必大于外部压力。
Δ当液面为凹形时,合力指向液体外部。
液体内部的压力将小于外面的压力。
2、亚稳状态与新相生成1). 亚稳状态一定温度下,当蒸气分压超过该温度下的饱和蒸气压,而蒸气仍不凝结的现象叫蒸气的过饱和现象(supersaturated phenomena of vapor),此时的蒸气称为过饱和蒸气(supersaturated vapor)。
在一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下的溶质的溶解度,而溶质仍不析出的现象叫溶液的过饱和现象(supersaturated phenomena of solution),此时的溶液称为过饱和溶液(supersaturated solution)。
在一定压力下,当液体的温度高于该压力下的沸点,而液体仍不沸腾的现象,叫液体的过热现象(superheated phenomena of liquid),此时的液体称为过热液体(superheated liquid)。
在一定压力下,当液体的温度已低于该压力下液体的凝固点,而液体仍不凝固的现象叫液体的过冷现象(supercooled phenomena of liquid),此时的液体称为过冷液体(supercooled liquid)。
上述过饱和蒸气、过饱和溶液、过热液体、过冷液体所处的状态均属亚稳状态(metastable state)。
它们不是热力学平衡态,不能长期稳定存在,但在适当的条件下能稳定存在一段时间,故称为亚稳状态。

第九章界面现象与胶体化学
参考学时:10学时
学习目标:
1 掌握表面热力学性质,表面张力的概念及意义;
2 掌握弯曲表面的特性和Laplace公式,Kelvin公式及应用,合理解释一些表面现象;
3 理解润湿与铺展,润湿作用和接触角;
4掌握吸附作用的类型和吸附等温式
5 了解分散物系的分类;胶团结构,胶体物系的动力性质,光学性质和电学性质,双电层和ζ电位。
章节知识点:
§9.1 界面张力
1.液体的表面张力、表面功及表面吉布斯函数
2.热力学公式
3.界面张力及其影响因素
§9.2 弯曲液面的附加压力及其后果
1.弯曲液面的附加压力—Laplace方程
2.微小液滴的饱和蒸气压—Kelvin公式
3.亚稳态及新相的生成
§9.3 固体表面
1.物理吸附与化学吸附
2.等温吸附
3.Langmuir 单分子层吸附理论及吸附等温式
4.吸附热力学
§9.4 液-固界面
1.接触角与杨氏方程
2.润湿现象
3.固体自溶液中的吸附
§9.5 溶液表面
1.溶液表面的吸附现象
2.表面过剩与吉布斯吸附等温式
3.表面活性物质
§9.6 分散物系的分类及胶体的制备
1.分散物系的分类
2.胶体系统的制备及净化
3.胶团结构
§9.7 胶体系统的性质
1.胶体物系的动力性质
2.胶体物系的光学性质
3.胶体物系的电学性质,双电层和ζ电位
4.溶胶的稳定与聚沉。
专题讲解-界面现象-胶体化学表面吉布斯自由能和表面张力1、界面:密切接触的两相之间的过渡区(约几个分子的厚度)称为界面(interface),通常有液-气、液-固、液-液、固-气、固-液等界面,如果其中一相为气体,这种界面称为表面(surface)。
2、界面现象:由于界面两侧的环境不同,因此表面层的分子与液体内的分子受力不同:1.液体内部分子的吸引力是对称的,各个方向的引力彼此抵销,总的受力效果是合力为零;2.处在表面层的分子受周围分子的引力是不均匀的,不对称的。
由于气相分子对表面层分子的引力小于液体内部分子对表面层分子的引力,所以液体表面层分子受到一个指向液体内部的拉力,力图把表面层分子拉入内部,因此液体表面有自动收缩的趋势;同时,由于界面上有不对称力场的存在,使表面层分子有自发与外来分子发生化学或物理结合的趋势,借以补偿力场的不对称性。
由于有上述两种趋势的存在,在表面会发生许多现象,如毛细现象、润湿作用、液体过热、蒸气过饱和、吸附作用等,统界面现象。
3、比表面(Ao)表示多相分散体系的分散程度,定义为:单位体积(也有用单位质量的)的物质所具有的表面积。
用数学表达式,即为:A=A/V高分散体系具有巨大的表面积。
下表是把一立方厘米的立方体逐渐分割成小立方体时,比表面的增长情况。
高度分散体系具有巨大表面积的物质系统,往往产生明显的界面效应,因此必须充分考虑界面效应对系统性质的影响。
边长 l/cm 立方体数表面积A/cm2比表面A/cm-1线性大小与此相近的体系1 1 6 6 ——10-11036×10 6×10 ——F=2γl (2)这里称为表(界)面张力。
表面自由能的单位为 J·m-²。
由于J=N·m ,所以γ的单位可表示为 N·m-1,N为牛顿,是力的单位,所以表面自由能也可以看作是垂直于单位长度相界面上的力,即表面张力。
下表是一些纯物质及液-液界面的张力。
液体温度T/K γ/N·m-1液体温度T/Kγ/N·m-1水293 0.07288298 0.07214303 0.07140二甲亚砜293 0.04354 四氯化碳298 0.02643 二甲基苯胺293 0.03656 甲醇293 0.02250 硝基甲烷293 0.03266 乙醇293 0.02239 苯293 0.02888 303 0.02155303 0.02756 辛烷293 0.02162甲苯293 0.02852 庚烷293 0.02014 氯仿298 0.02667 乙醚298 0.02014 丙酸293 0.02669 全氟甲基环已烷293 0.01570 丁酸293 0.02651 全氟庚烷293 0.01319 氦He 1 0.000365 氩Ar 90 0.01186 氢H220 0.00201 甲烷110 0.01371 D220 0.00354 氧O277 0.01648 氮N275 0.00941 乙烷180.6弯曲表面下的附加压力和蒸气压1、弯曲表面下的压力由于表面张力的作用,在弯曲表面下的液体于平面不同,它受到附加的压力(Ps)。
*. 如果液面是水平的,则表面张力f也是水平的。
当平衡时,沿周界的表。
面张力互相抵消。
此时液体表面内外压相等,而且等于表面上的外压力P*. 如果液面是弯曲的,则沿AB周界面上的表面张力f不是水平的。
当平衡时,表面张力将有一合力。
Δ当液面为凸形时,合力指向液体内部。
表面内部的液体分子所受压力必大于外部压力。
Δ当液面为凹形时,合力指向液体外部。
液体内部的压力将小于外面的压力。
2、亚稳状态与新相生成1). 亚稳状态一定温度下,当蒸气分压超过该温度下的饱和蒸气压,而蒸气仍不凝结的现象叫蒸气的过饱和现象(supersaturated phenomena of vapor),此时的蒸气称为过饱和蒸气(supersaturated vapor)。
在一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下的溶质的溶解度,而溶质仍不析出的现象叫溶液的过饱和现象(supersaturated phenomena of solution),此时的溶液称为过饱和溶液(supersaturated solution)。
在一定压力下,当液体的温度高于该压力下的沸点,而液体仍不沸腾的现象,叫液体的过热现象(superheated phenomena of liquid),此时的液体称为过热液体(superheated liquid)。
在一定压力下,当液体的温度已低于该压力下液体的凝固点,而液体仍不凝固的现象叫液体的过冷现象(supercooled phenomena of liquid),此时的液体称为过冷液体(supercooled liquid)。
上述过饱和蒸气、过饱和溶液、过热液体、过冷液体所处的状态均属亚稳状态(metastable state)。
它们不是热力学平衡态,不能长期稳定存在,但在适当的条件下能稳定存在一段时间,故称为亚稳状态。
2). 新相生成的热力学与动力学原理亚稳态之所以能够出现,有热力学和动力学两方面的原因。
从热力学上看,上述所有过程都涉及从原有的旧相中产生新相的过程,使原有的一般热力学系统变成一个瞬间存在的高度分散系统。
用dG = —SdT+Vdp+γdA s(纯液体为单组分系统)分析,定温、定压下上述过程dG T,p = γdA s>0,是一个非自发过程。
从动力学上看,上述过程新相核心的形成速率与新相核心的的半径有如下关系:新相生成速率∝r2exp(-Br2)B为经验常数该式表明,新相形成速率会随r的增加而经过一个极大值,最大速率对应的 r称为临界半径(critical radius),只有能克服由临界半径所决定的能垒的那些分子才能聚到核上,而长大成新相。
人工降雨、防止暴沸、防止过饱和溶液生成细小晶粒影响过滤,从开尔文公式我们可以理解上述现象的实质——亚稳状态。
液体界面的性质1、液体的铺展:某液体1是否能在另一互不相溶的液体2上铺展开来,取决于各液体本身的表面张力和(3为气相)以及两液体之间的界面张力的大小。
下图是液滴1在另一液体2上的情况。
图中3为气相。
设考虑三个相接界A点处的和的作用是力图维持液滴成球型(由于地心引力可能成透镜形状),而的作用则是力图使液体铺展开来。
因此如果则液体1可以在液体2上铺展开来。
若液体2是水,则一般很大,在这种界面上,大多数有机液体1都可铺成薄膜。
2.表面张力与溶质的关系表面张力与溶质的关系:水的表面张力因加入溶质形成溶液而改变。
有些溶质加入水中后使溶液表面张力升高。
例如无机盐、不挥发性的酸碱(如H2SO4、NaOH)等,由于这些物质的离子,对于水分子的吸引而趋向于把水分子拖入溶液内部,此时在增加单位表面积所作的功中,还必须包括克服静电引力所消耗的功,因此溶液的表面张力升高。
这些物质被称为非表面活性剂。
有些溶质加入水中后使溶液表面张力下降,能使水的表面张力降低的溶质都是有机物。
我们习惯上把那些明显降低水的表面张力的具有两亲性质的有机化合物叫做表面活性剂。
3.两亲性质所谓两亲分子,以脂肪酸为例,亲水的-COOH基使脂肪酸分子有进入水中的趋势,而憎水的碳氢链则竭力阻止其在水中溶解。
这种分子就有很大的趋势存在于两相界面上,不同基团各选择所亲的相而定向,因此称为两亲分子。
进入或“逃出”水面趋势的大小,决定于分子中极性基与非极性基的强弱对比。
对于表面活性物质来说,非极性成分大,则表面活性也大。
由于憎水部分企图离开水而移向表面,所以增加单位表面所需的较之纯水当然要小些,因此溶液的表面张力明显降低。
4.特劳贝(Traube)规则特劳贝(Traube)规则:特劳贝在研究脂肪酸同系物的表面活性物质时发现:同一种溶质在底浓度时表面张力的降低效应和浓度成正比。
不同的酸在相同的浓度时,对于水的表面张力降低效应(表面活性)随碳氢链的增长而增加。
每增加一个-CH2-,其表面张力效应平均可降低约3.2倍。
如下图所示:其他脂肪醇、胺、酯等也有类似的情况。
5.γ-c曲线稀溶液曲线的分类:特劳贝(Traube)规则有一定的限制,不能包括所有的表面张力变化的情况。
根据实验,稀溶液的曲线大致分为以下三类,如下图所示:1. 此类曲线的特征是溶质浓度增加时,溶液的表面张力随之下降。
大多数非离子型的有机化合物如短链脂肪酸、醇、醛类的水溶液都有此行为。
2. 当溶质的浓度增加时,溶液的表面张力随之上升。
3. 这类曲线的特征是,它与曲线1不同。
当溶液很稀时,溶液表面张力随浓度的增加而急骤下降随后大致不随浓度而变。
1、3类溶液的溶质都具有表面活性,能使水的表面张力下降,但3类物质(即表面活性剂)的表面活性较高,很少量就使溶液表面张力下降至最低值。
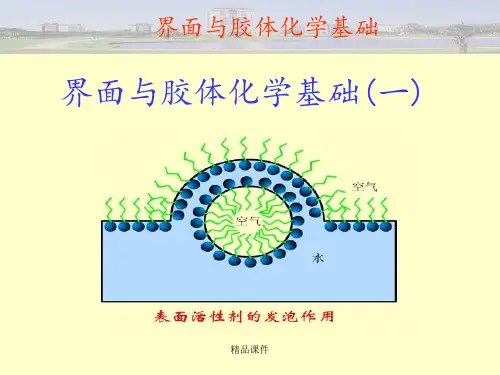
不溶性表面膜1.单分子层表面膜单分子层表面膜:1765年,富兰克林(Franklin)观察到油滴铺展在水面上时,成为很薄的油层,其厚度约为2.5nm,其后,波克尔斯(Pockel)和瑞利(Rayleigh)又发现某些难溶物质铺展在液体的表面上所形成的膜,确实是只有一个分子的厚度,所以这种膜就被称为单分子层表面膜(monolayer)。
2.单分子层表面膜的利用单分子层表面膜的利用:在油滴铺展过程中,如果在水面上有长度为l的非常薄的浮片,由于不溶物分子在水面上的自由运动,对单位浮片会有一种推动力,使浮片移动距离为,因此对浮片所做的功为。
当浮片移动了以后,不溶物的膜增加的面积为,所以体系的吉布斯自由能减少了,这就是体系所做的功。
其中是纯水的表面张力,是加入不溶物后的表面张力。
所以称为表面压。
因为>,所以浮片被推向纯水一边。
1917年兰缪尔根据以上原理设计了直接测定表面压的仪器——兰缪尔膜天平。
兰缪尔膜天平的灵敏度比一般测表面张力的灵敏度大10倍左右,例如测表面张力最好的准确度能达到0.1%,对于水可以测准到1×10-4 N·m-1,而用兰缪尔膜天平测表面压,则可以测准到1×10-5 N·m-1。
液-固界面现象1.粘附功、浸湿功、铺展系数1).粘附功:在恒温恒压可逆条件下,将气-液与气-固界面转变成液-固界面,如图所示:设当各个界面都是单位面积时,从热力学得角度,该过程的吉布斯自由能的变化值为:式中、和分别为气-固、气-液和液-固的表面吉布斯自由能。
Wa称为粘附功(Work of adhension),它是液、固粘附时,体系对外所做的最大功。
Wa值越大,液体愈容易润湿固体,液、固界面结合得愈牢固。
对于两个同样的液面转变成一个液柱的过程,吉布斯自由能变化为:Wc称为内聚功(Work of cohesion),是液体本身结合牢固程度的一种量度。