江苏省启东市初中化学 4.4 化学式与化合价教案(1)
- 格式:doc
- 大小:286.01 KB
- 文档页数:5
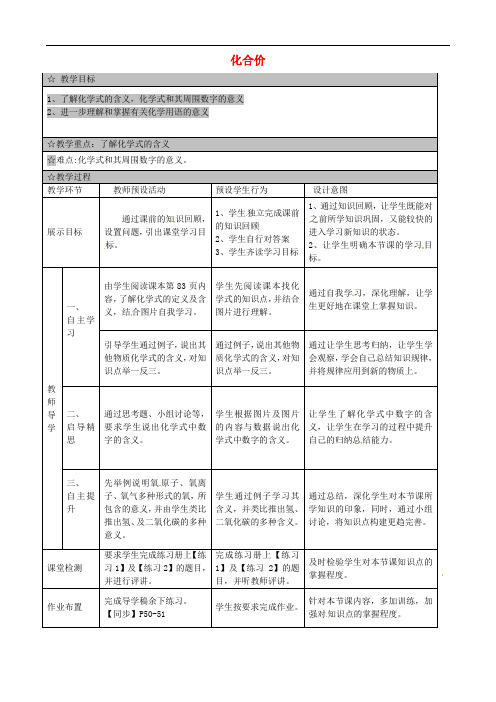

人教版化学九年级上册 4.4 化学式与化合价第一课时教学设计一、教学目标1.了解元素符号及其特点;2.理解化学式并能正确书写化学式;3.掌握化合价的概念,并能根据化合价推测元素化合方式;4.能够分析元素的官能团,并将其应用于实际问题。
二、教学重难点1.化学式的书写与化合价的推测;2.元素官能团的分析与应用。
三、教学准备1.教材:人教版化学九年级上册;2.多媒体设备:投影仪、电脑等。
四、教学步骤第一步:导入通过引入实际例子,引起学生对化学式的兴趣,并提问: - 你们平时在哪些地方见过化学式? - 你们对化学式有什么了解?第二步:引入新知通过投影仪展示元素周期表,解释元素符号的含义和特点: - 元素符号是由元素英文名称或拉丁名称的首字母组成; - 元素符号一般由一个大写字母和一个或两个小写字母组成; - 元素符号与元素名称是一一对应的关系; - 元素符号一般以拉丁名称或英文名称的缩写为准。
第三步:化学式的书写解释化学式的概念:由元素符号和表示元素原子数目的下标组成。
示例化学式H₂O的含义为:一个氧原子和两个氢原子组成的分子。
- 通过示例化学式的分析,引导学生掌握化学式的书写规则: - 元素符号的顺序按照化合物中元素的先后顺序写出; - 元素符号后面的下标表示元素原子的个数; - 下标为1时可以省略不写。
第四步:化合价的推测引导学生思考化合价的概念,并提问: - 什么是化合价? - 如何根据化合价推测元素的化合方式?通过示例化合物的化学式,如NaCl、H₂O,解释化合价的特点: - 具有正价和负价两种; - 绝大多数元素的化合价是固定的。
总结元素化合价的规律: - 主族元素的化合价一般等于它们的电子层(价层)上的电子数目; - 过渡元素的化合价可以根据最稳定的化合物来推断。
第五步:应用案例分析通过实际问题,引导学生分析元素的官能团,并将其应用于实际问题。
比如:分析硫酸(H₂SO₄)的分子结构: - 化合价为+2的氢原子与化合价为+6的硫原子组成硫酸根; - 化合价为-2的氧原子与化合价为+6的硫原子组成硫酸。

第四单元自然界中的水
课题4化学式与化合价(第一课时教学设计)
板书设计:
4-4化学式与化合价 1、 定义
用元素符号和数字组合的式子
宏观
2、化学式的意义
微观
化学式
拓展:元素符号周围数字的意义
a :表示有a 个R 粒子(原子、分子或离子等)
b :表示一个粒子中含有b 个某原子
c :表示一个R 离子带c 个正(或负)电荷
d :表示(某化合物中)R 元素的化合价为±d 价
3、化学式的读写规律
①表示一种物质 ②表示一种物质的元素组成
①表示该物质的一个分子 ②表示该物质的一个分子的原子构成
单质化学式的读写规律:
①固体非金属单质、金属单质、稀有气体的化学式常用元素符号表示,读法:直接读元素名称 ②气态非金属单质的化学式用元素符号和数字“2”的组合表示,读法:在元素名称后加“气”
(1)氧化物的化学式的读写规律: ①写法:它左氧右,先读后写; ②读法:从右向左读“氧化某”,有时读出原子个数
(2)一种金属元素和一种非金属元素组成的化合物化学式的读写规律:
①写法:金左非右,先读后写
②读法:一般从右向左读“某化某”。
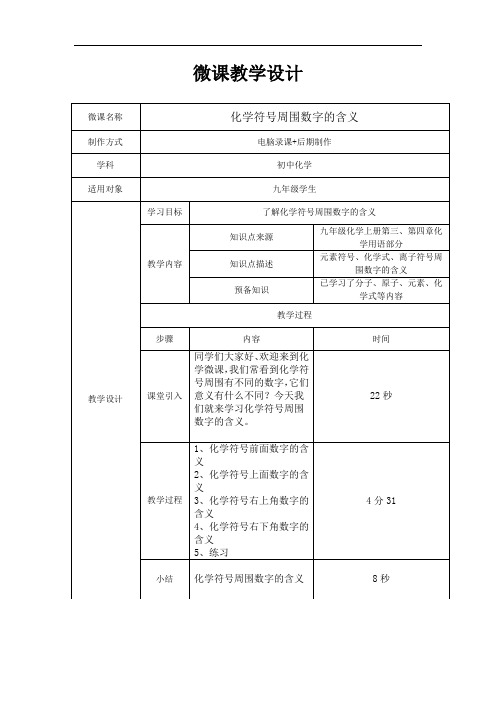

第四单元课题4《化学式与化合价》教学设计(第1课时)一、教学目标(一)知识与技能1. 了解化学式的意义。
2. 知道一些常见元素和根的化合价。
3. 能用化学式表示某些物质的组成,并能利用化合价推算化学式。
(二)过程与方法1. 通过学生利用卡片对由两种元素组成化合物化学式的书写和命名规律的探究,使其初步学会运用分类的方法解决问题。
2.通过展示铜、水、氯化钠三种物质的宏观实物和微观构成的图片,以及列举“一些物质的组成与化学式”表格的呈现,使学生初步体验用图表来表述信息的方法。
(三)情感·态度·价值观1. 通过展示带有化学式的各种商品和公益广告的照片,使学生在熟悉的生活情景中感受化学的重要性,了解化学与日常生活的密切关系。
2.通过指出“化学式只能表示实际存在物质的组成。
只有在该化合物实际存在时才有意义。
不能根据化合价凭空臆造、随意书写化学式”,树立学生崇尚科学的意识。
二、教学重点及难点重点:1. 知道简单化合物化学式书写和命名规律。
2. 学会根据化合价推算物质的化学式。
难点:化学式是用元素符号和数字来表示物质组成的式子。
三、教学过程素符号和数字表示的式子——化学式。
它合物的组成固定。
告知学生我们这节课重【聆听、思考】从物质的微观构成,初步感知化学式与物质、与物质的微观结构之间的关系。
【思考、回答】列举大量的事实,根据事实写出物质的化学式,使学生再次感知化学式与物质、与物质的微观结构之间的关系。
【聆听、思考】从物质分类角度,分别理解单质和化合物组成固定,与化学式之间的联系。
【学生活动】【提问】请同学找出由两种元素组成化合物的化学式,按照组成物质中的元素分类,将卡片进行排列,找出两种元素组成化合物化学式的书写规律。
教师活动学生活动【讲述】大家从两种元素组成化合物中含氧、含氯、含氢和含金属元素几个角度对化合物的化学式进行了分类。
其中前三种是从物质中含有一种共同的元素进行分类的,而最后一种是从物质中含有共同的一类元素进行分类的。

4.4 化学式与化合价设计项目评价内容教材分析1、本课是第四单元课题4的第一课时,本课题包括化学式、化合价和有关相对分子质量的计算三部分内容,它们是学习化学的重要工具。
分两个课时,第一课时先认识化学式。
2、本课是在学生对身边的化学物质有一定认识和认识元素符号的基础上,学习用化学式表示常见的化学物质。
3、本节的内容是先讲化学式及写法,再讲化合价的。
调整为先讲化学式,引出化学式中的原子个数比,了解化合价及记住常见元素和原子团的化合价,再讲怎样写化学式,使系统性更好些。
4、通过本节的学习后,学生要能用化学式表示常见的物质及初步知道可以通过化学式分析物质的组成。
5、本节了解化学式意义及化合价含义,重点是会用化合价写化学式。
教学目标1、了解化学式及意义。
2、了解化合价,记住常见元素的化合价及化合价的一般规则。
3、学会用化学式来表示常见的华学物质。
4、初步形成通过化学式分析物质的组成5、教学重点是记常见元素和原子团的化合价,写化学式的方法。
6、教学难点写化学式。
教学策略1、本课时的内容较为抽象,可通过前面教学中记住的化学式,结合学生阅读教材,讨论、尝试书写化学式,再由老师纠错,引导归纳出规律的一种教学方法。
2、学生尝试书写过程中,引导相互学习。
教学过程教学要点教师活动学生活动意图与反馈复习元素用什么来表示?元素符号有哪些意义?思考回答引入元素可以用元素符号来表示,那么由元素组成的各种单质和化合物怎样来表示呢?思考引出化学式的定义1、化学式(板书)1、化学式--用元素符号和数字表示物质组成的式子化学式有哪些意义呢?注意:纯净物有固定的组成才有化学式,混合物没有固定的组成也就没有化学式。
一种物质组成只有一个化学式。
思考:课本81页的讨论内容:H2H H 2 2H2 各具有什么意义?学生阅读课本81页图4—11,思考、讨论。
⑴定义:用元素符号和数字表示物质组成的式子叫做化学式。
⑵说说化学式可表示的意义(以H2O为例)①表示一种物质:水②表示该物质的元素组成:水是由氢、氧两种元素学生代表发言。
课题4 化学式与化合价(一)【学习目标】1.了解化学式的涵义,初步学会用化学式表示某些常见物质;2.初步了解常见元素和根的化合价;3.初步学会根据元素的化合价推求化合物的化学式;4.初步学会根据化合物的化学式推求元素的化合价。
【活动方案】 引言:请同学们观看屏幕,(你能找出哪一个试剂瓶中盛放的是水吗?你是怎么知道的?)另两瓶中的试剂你们知道吗?若用中文表示你们会知道,而现在标签上均用化学式表示的,化学式是重要的化学语言,今天我们一起学习化学式。
请完成活动一的第一个子活动。
(水、硫酸、氢氧化钙)活动一、了解化学式的涵义1.阅读下图,了解化学式的意义。
(活动结果口头汇报)五氧化二磷的化学式为P 2O 5,请模仿上图,说出 “P 2O 5”的意义并在组内交流。
2.辨别不同符号及数字的意义 (请将答案展示在黑板上)(1)现有①H 、②2H 、③H 2、④2H 2等四种符号,其中能表示氢元素的是______;能表示氢气的是______;能表示1个氢原子的是______;能表示1个氢分子的是______;能表示2个氢原子的是______;能表示2个氢分子的是______。
(2)2H 2中两个“2”的意义相同吗?(屏幕上显示2H 2中2的意义,公布答案) 过渡:要正确书写物质的化学式,必须知道物质的组成,物质的组成与元素的化合价关系密切,接下来我们通过活动二一起来认识化合价。
活动二、认识元素的化合价1.阅读材料,标注化合价。
化学家对大量化合物进行了实验测定,发现化合物均有固定的组成,即形成化合物的元素有固定的原子个数比。
在此基础上,总结出了体现这种关系的数值—元素的化合价(valence )。
如H 2O 中氢元素显正一价,氧元素显负二价;正一价的氢元素表示为“ ”,负二价的氧元素表示为“ ”。
课本P83表4-6列出了一些常见元素的化合价。
查找下列元素在化合物中的化合价,并标注在元素符号的正上方。
K Mg Al Si F-2 O +1 H 表示水由氢元素和氧元素组成 表示1个水分子由2个氢原子和1个氧原子构成表示水 表示1个水分子 宏观意义 微观意义2.认识化合价规律现有下列化学式(元素化合价均已标明),认真分析后回答下列问题:(1)化合物中既有正价元素又有负价元素。
课题 4 化学式与化合价第 2 课时总第个教案★教学目标1、知识与技能1知道一些常见的元素和根的化合价2能用化学式表示某些物质的组成,并能利用化合价推求化学式。
2、过程与方法:学习运用活动探究的方法,主动参与到学习中去获取知识。
3、情感态度与价值观通过化学式的引入,对学生进行实事求是的科学态度的教育,充分培养学生的思维能力和计算能力。
重点:一些元素和根的化合价,用化学式表示物质的组成,并利用化合价推求化学式难点:化学价的理解,化学式的书写,利用化合价写化学式教法:讲练结合[预习交流]上节课结束时我曾布置作业,让大家把一些常见元素和原子团的化合价编成顺口溜、快板或歌谣的形式来进行记忆,现在我们来个比赛。
[比一比]以小组为单位进行化合价记忆比赛,看谁记得多,记得准。
[赛一赛]请说出你们编写的顺口溜、快板或歌谣。
[学生活动,教师观看,并为他们的精彩表现喝彩、鼓掌、加油][编写参考]一、氢钾钠银一价寻二价氧钙钡镁锌三价元素有金铝二四六硫三五磷一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五价磷谈变价,也不难二三铁,二四碳二四六硫都齐全铜汞二价最常见[教师还可提供一些其他的记忆方法,供学生参考][投影]展示下列记忆歌诀一、单质元素全为零,化合物中记分明。
一价钾钠氢银铵,钡镁锌钙二价占。
一二铜汞、一三金,二四锡铅锰与碳。
三价铝,四价硅,二四六价硫占满。
氯负一,氧负二,铁有正二和正三。
氢氧根显负一,负三正五是磷氮。
酸根所有皆为负,一硝三磷二硫碳。
二、正一氢钠钾和银,氟氯溴碘负一寻;二价氧镁钙钡锌,三铝四硅五价磷,四二是碳三二铁,一二铜汞一三金,硫逢双价二四六,锰为二四六和七,单质规定为零价。
[过渡]前面我们说,可以应用元素的化合价来推求物质的化学式,如何推求呢?我们来看例题。
[阅读]请同学们阅读P81例题,总结出应用化合价求化学式的步骤。
[教师板书]4.根据化合价求化学式的一般步骤。
[学生回答,教师总结](1)写出元素符号,正价在左,负价在右。
《化学式与化合价》教学设计纯净物有固定的组成混合物没有固定的组成也就没有化学式。
—27,思考、讨论。
说说化学式可表示的意义(以H2O为例)①表示一种物质:水②表示该物质的元素组成:水是由氢、氧两种元素组成。
③表示物质的一个分子:一个水分子④表示物质的分子构成:每个水分子是由两个氢原子和一个氧原子构成表发言,激发学生学习兴趣。
归纳:(1)单质①金属(铁Fe、铜Cu等)、固态非金属(如碳C、磷P等)、稀有气体(氦He、氖Ne等)直接用元素符号表示②非金属气体:双原子构成的分子,如氢气H2、氧气O2等。
用元素符号再加小数字(2)化合物(先研究两种元素组成的化合物)a. 氧化物:一般把氧的元素符号写在右方,另一种元素的符号写在左方,如Fe3O4、CO2、P 2O5。
b.金属与非金属元素组成的化合物:如N aCl、ZnS “金前,非后”注意:1.化学式中原子个数为1时,“1”不标出。
2.化学式中右下方的小数字一般为最简整数比。
⑶三种以上元素形成的化合物:一般都带有原子团,将原子团当一个原子看待。
1内容2式3上的写法的名称一般读作某化某例如:读作氯、有时还要读出化学式中各种元素的原子个数,练习读化学式:Fe3O4、CO2、P2O5、BaCl2、AlCl3、NaOH学生代表发言。
课题 4 根据化学式的计算
第 3 课时总第个教案
教学目标:
1、知识与技能
(1)了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。
(2)能看懂某些商品标签或说明书上标示的物质成分和含量
2、过程与方法:
学习运用活动探究的方法,主动参与到学习中去获取知识。
3、情感态度与价值观
通过化学式的引入,对学生进行实事求是的科学态度的教育,充分培养学生的思维能力和计算能力。
重点、难点:
利用相对原子质量和相对分子质量计算物质的组成。
教法:讲练结合
教学过程:
预习交流:
1、一个水分子是由和构成。
2、硫的相对原子质量是32,表示的意义是()
A .表示硫原子的相对原子质量是32g。
B.表示一个硫原子的质量为32g。
C.表示一个硫原子核内有32个质子。
D.表示一个硫原子质量是一个碳原子质量的1/12的32倍。
想一想:
H的相对原子质量=1;O的相对原子质量=16,那么你们认为氢气(H2)分子、氧气(O2)分子、水(H2O)分子的相对分子质量是多少?
H2的相对分子质量=2
O2的相对分子质量=32
你是怎样知道的?
H2O的相对分子质量=?
18
是如何计算出来的?
相对分子质量(M r):
(relative molecular mass)化学式中各原子的相对原子质量的总和。
(于书本P82画出关键词)
(练习1)
下列关于相对分子质量的说法正确的是( )
A、物质的实际质量。
B、化学式中各原子的相对质量总和,是相对质量。
C、物质一个分子的实际质量。
D、化学式中各原子的数量的总和。
相对分子质量的单位是K g,这说法对吗?
三、有关相对分子质量的计算
1、计算相对分子质量
例1:
水(H2O)的相对分子质量
=1×2+16=18
(练习2)
下列物质的相对分子质量是多少呢?
(1)氧气O2的相对分子质量=
(2)二氧化碳CO2的相对分子质量=
(3)氢氧化钙Ca(OH)2的相对分子质量=
计算相对分子质量的方法是怎样的?应注意些什么问题?
注意:
1)正确书写化学式.
2)元素符号之间用“+”号,元素符号与数字之间用“×”号。
3)化学式中的原子团作为一个整体,
如C a(OH)2 中的(OH),若含多个同种原子团时则把
(原子团的相对原子质量总和)×原子团个数。
讨论:
1个O2分子的相对分子质量大家都会算了,那么3个O2分子的总相对分子质量又如何计算?
2、计算多个分子的总相对分子质量
请算一算下列分子的总相对分子质量是多少?
1)3O2的总相对分子质量
=3×(16×2)=96
例2
1)3CO2的总相对分子质量
=3×(12+16×2)=3×44=132
2Ca(OH)2总的相对分子质量
=2×[40+(16+1)×2]=2×74=148
2)2H2O 的总相对分子质量
=2×(1×2+16)=2×18=32
3)3Mg(OH)2的总相对分子质
=3×[24+(16+1)×2]= 174
注意:
4)计算多个分子的总相对分子质量时,化学式前的数字是表示分子的个数,计算时应把
个数×(一个分子的相对分子质量)
思考:
1、水是__________________由组成.
2、H2O 的相对分子质量为18,则水中氢元素的质量占多少?氧元素的质量又占多少?那么水中氢元素质量与氧元素的质量比为多少?
例3:计算水中氢元素质量与氧元素的质量比
分析:
1、水由大量水分子构成。
2、水中氢元素质量是指所有水分子中H 原子的质量总和。
水中氧元素质量是指所有水分子中O 原子的质量总和。
2.计算物质组成元素的质量比(最简比)
分析:
水(H2O )中
8
11621=⨯=氧元素的质量氢元素的质量 解:
水中 氢元素 和 氧元素 的质量比
1×2 ︰ 16 =1︰ 8
例4:硝酸铵(NH4NO3)中元素的质量比N :H :O=_____:_____:_____
解:硝酸铵(NH4NO3)中元素的质量比N : H :O =14×2:1×4:16×8
=7:1:12
练习3:
1)氧化铝(Al2O3)中铝元素和氧元素的质量比为多少?
2)常用有机化肥尿素CO(NH2)2中各元素质量比为多少?
解:
1)氧化铝(Al2O3)中铝元素与氧元素的质量比=
2)尿素CO(NH2)2中各元素质量比
C:O:N:H=
小结
化学式既有宏观意义,又有微观意义,还有量的意义.
通过化学式可以计算物质的相对分子质量、物质中各元素的质量比等。
当堂反馈:
碘元素(符号为I )具有预防和治疗甲状腺肿大的作用,人体缺碘时易患粗脖子病。
为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐。
所谓碘盐就是在食盐中加入一定量的碘酸钾。
所以食盐中常含有一种补充碘元素的盐。
如图4-5所示为湖北省盐业公司专营的“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题。
⑴已知碘在碘酸钾中的化合价为+5,由此可猜想碘酸钾的化学式为
相对分子质量为 ,碘酸钾中碘元素的质量分数 。
⑵假设某1000g 碘盐中含20mg 碘。
①这里标明的碘的含量是指( )
A 、碘单质
B 、碘元素
C 、碘原子
D 、碘分子
② g 碘酸钾中含有20mg 碘。
③已知成人每天约需0.15g 碘,假设这些碘主要是从碘盐中摄取的,则成人每天需要食用碘盐 g 。
作业:
1、双氧水(H2O2)的相对分子质量计算方法( )
A、1 ×2 × 16 × 2
B、1 ×2 + 16 × 2
C、1 +2 + 16 + 2
D、(1 +2 )×(16 + 2 )
2、2KMnO4的总相对分子质量=_________________________
3、对于硫酸铵[(NH4)2SO4]中各元素质量比的计算方法正确的是()
A、元素质量比N:H:S:O=14×2 :1×4×2 :32 ×4:16×4
B、元素质量比N:H:S:O=14×2 :1×4 :32 :16×4
C、元素质量比N:H:S:O=14 :1×4×2 :32 :16×4
D、元素质量比N:H:S:O=14×2 :1×4×2 :32 :16×4
4、碳酸钠(Na2CO3)中各元素质量比为多少?
5、求多少克硫酸中含有的氧元素质量与34克过氧化氢中含有的氧元素质量相等?
6、120Kg尿素[CO(NH2)2]的含氮量相当于多少克碳酸氢铵NH4HCO3的含氮量?
7、已知元素R的氧化物的相对分子质量为64,R的相对原子质量为32,则此氧化物的化学式为
A、RO
B、RO2
C、RO3
D、R2O
8、某氮的氧化物中,氮元素和氧元素的质量比为7:4,则氮的氧化物的化学式为()
A、N2O
B、NO
C、N2O5
D、NO2
教后反思:。