仪器分析实验教材
- 格式:doc
- 大小:131.00 KB
- 文档页数:9

实验一原子吸收光谱法测定植物中锌含量一实验目的:1巩固原子吸收光谱法的理论知识。
2学会使用Z-8000型原子吸收分光光度计。
3练习标准曲线法。
4熟悉锌的测定条件和方法。
二实验原理:原子吸收分光光度法是基于蒸气相中被测元素的基态原子对其原子共振辐射的吸收,来测定试样中该元素含量的一种方法。
详细地说:物质所产生的原子蒸气对特定谱线(通常是待测元素的特征谱线)的吸收作用来进行定量分析的一种方法,例如:要测定溶液中M+离子的浓度,先将试液喷射成雾状进入燃烧火焰中,含M+的雾滴在火焰温度下,挥发并离解成M+离子蒸气,再用M+离子空心阴极灯作光源,它辐射出具有一定波长特征谱线的光,当通过一定厚度的M+原子蒸气时,部分光被蒸气中基态M原子吸收而减弱,通过单色器和检测器测得M元素特征谱线光被减弱的程度。
三仪器试剂和实验用品:仪器:Z—8000原子吸收分光光度计。
试剂和实验用品:4:1硝酸—高氯酸混和酸。
三角瓶,曲颈漏斗, 容量瓶,移液管。
二次蒸馏水。
四实验步骤:1样品制备:1.1 前处理:称取1.000g左右的植物样品(过60目筛)放入三角瓶中,上盖小曲颈漏斗,加入1:4的HCIO4:HNO3溶液15.00ml,振荡均匀,将此三角瓶放于电炉的石棉网上,微微加热,使其渐渐沸腾,并有黄烟冒出,再略加大火煮沸,待黄烟变为白烟时,将电炉变为小火,当酸溶液转为淡绿色溶液约1~2ml时,此样为消煮完毕。
如一次加酸消煮不完全,可再加入混酸消煮。
将消煮液转移定器至50.00ml 容量瓶中,少量多次冲洗,洗液并入容量瓶中定容,此液即为样品上机测定溶液。
1.2 锌标准溶液的配制:准确称取0.500g 金属锌(99.99%),溶于10ml 浓硝酸中,然后在水浴上蒸发至近干,用少量水溶解后移入1000ml 容量瓶中,以水稀释至刻度,贮于聚乙烯瓶中,此溶液每毫升相当于含0.50mg 锌。
1.3 锌标准使用液:吸取10.0ml 锌标准溶液,置于50ml 容量瓶中,以 0.1mol/l 硝酸稀释至刻度,此溶液每毫升相当于1000.0μg 锌。

《仪器分析》电子教案第一章:绪论1.1 课程介绍理解仪器分析在现代科学领域的重要性了解仪器分析的基本概念和发展历程1.2 仪器分析的分类与特点掌握仪器分析的主要类型(如光谱、色谱、电化学等)理解各种分析方法的优缺点及适用范围1.3 仪器分析的基本原理学习基本的物理和化学原理,如光的散射、吸收、发射等掌握仪器分析的基本计算方法和数据处理第二章:光谱分析2.1 紫外-可见光谱分析学习紫外-可见光谱的产生原理掌握紫外-可见光谱仪的操作和应用实例2.2 红外光谱分析了解红外光谱的产生原理和仪器结构学习红外光谱图的解析及应用2.3 原子光谱分析掌握原子光谱的基本原理,包括原子发射光谱和原子吸收光谱了解原子光谱在元素分析中的应用第三章:色谱分析3.1 气相色谱分析学习气相色谱的原理、仪器结构及操作方法掌握气相色谱的定性和定量分析技术3.2 液相色谱分析了解液相色谱的原理和类型,如HPLC、UPLC等掌握液相色谱的仪器操作和应用实例3.3 色谱-质谱联用技术学习色谱-质谱联用的基本原理和仪器结构了解其在复杂样品分析中的应用和优势第四章:电化学分析4.1 电化学分析基本原理学习电化学分析的电位、电流、电量等基本概念掌握电化学分析法的种类及其适用性4.2 常见电化学分析方法学习伏安法、极谱法、电位滴定法等分析方法了解电化学分析在实际样品分析中的应用4.3 电化学探针技术掌握电化学探针的工作原理和应用领域学习如何选择合适的电化学探针进行特定分析第五章:现代仪器分析技术5.1 质谱分析理解质谱分析的基本原理和仪器结构学习质谱图的解析和质谱技术在分析中的应用5.2 核磁共振谱分析学习核磁共振谱的产生原理和仪器操作掌握核磁共振谱在有机化合物结构分析中的应用5.3 扫描隧道显微镜分析了解扫描隧道显微镜的工作原理和特点学习扫描隧道显微镜在表面分析和纳米技术中的应用第六章:光学分析技术6.1 激光光谱分析学习激光光谱的原理和特点掌握激光光谱技术在分析中的应用案例6.2 光纤光谱分析了解光纤光谱技术的原理和设备学习光纤光谱在远程分析和生物医学中的应用6.3 光学显微镜分析掌握光学显微镜的原理和操作学习光学显微镜在材料和生物样品分析中的应用第七章:电泳分析7.1 凝胶电泳分析学习凝胶电泳的原理和分类掌握凝胶电泳在生物大分子分析中的应用7.2 毛细管电泳分析了解毛细管电泳的原理和设备学习毛细管电泳在药物分析和生物分子分离中的应用7.3 电泳-质谱联用技术学习电泳-质谱联用的原理和流程掌握其在蛋白质分析和蛋白质组学中的应用第八章:电化学传感器分析8.1 电化学传感器的基本原理理解电化学传感器的工作原理和分类学习电化学传感器的设计和应用8.2 生物电化学传感器学习生物电化学传感器的工作原理和特点掌握生物电化学传感器在生物医学和环境监测中的应用8.3 纳米电化学传感器了解纳米电化学传感器的发展和优势学习纳米电化学传感器在灵敏度和选择性提高中的应用第九章:数据处理与质量控制9.1 数据处理基本方法学习仪器分析数据的基本处理方法,如校准、滤波、平滑等掌握数据曲线拟合和参数估计的技术9.2 质量控制和质保理解质量控制的原则和程序学习如何进行实验室质量管理和确保分析结果的准确性和可靠性9.3 统计分析在仪器分析中的应用学习统计学在数据分析中的应用掌握使用统计方法评估分析结果的可信度和精确度第十章:实验操作与案例分析10.1 实验操作技巧学习实验操作的基本规范和技巧掌握安全操作和实验室事故的处理方法10.2 实验案例分析分析实际案例,理解仪器分析在解决实际问题中的应用学习如何设计实验方案和解读实验结果重点解析本文档详细编写了一个关于《仪器分析》的电子教案,共分为十个章节。

《仪器分析》实验指导书中国计量学院质量与安全工程学院二○一○年三月学生实验守则1 学生必须在规定时间内参加实验,不得迟到、早退。
2 学生进入实验室后,不准随地吐痰、抽烟和乱抛杂物,保持室内清洁和安静。
3 实验前应认真阅读实验指导书,复习有关理论并接受教师提问检查,一切准备工作就绪后,须经指导教师同意后方可动用仪器设备进行实验。
4 实验中,认真执行操作规程,注意人身和设备安全。
学生要以科学的态度进行实验,细心观察实验现象、认真记录各种实验数据,不得马虎从事,不得抄袭他人实验数据。
5 如仪器发生故障,应立即报告教师进行处理,不得自行拆修。
不得动用和触摸与本次实验无关的仪器与设备。
6 凡损坏仪器设备、器皿、工具者,应主动说明原因,书写损坏情况报告,根据具体情节进行处理。
7 实验完毕后,将实验仪器和设备整理好,认真书写实验报告(包括数据记录、分析与处理,以及绘制必要的图形)。
前言本实验指导书是《仪器分析》课程的配套实验教材。
《仪器分析》是化学、化工、安全工程、环境工程等有关专业的一门重要的专业基础课程。
本课程涉及的分析方法是根据物质的物理和物理化学特性对物质的组成、状态、结构、信息进行表征和测量,是学习《化学分析》之后,必须掌握的进行科学研究与质量监控的现代分析技术。
仪器分析实验是《仪器分析》课程教学的必须实验环节。
其目的是加深学生对本课程所涉及的重要基本原理、基本器件和常用仪器设备的结构及工作原理的理解,并且锻炼学生的动手实践能力,使学生在后面的学习和工作中能够综合运用所学知识解决实际问题。
本课程要求学生提前阅读实验指导书,在教师指导下自己动手,亲自实践,边做边想,认真记录,并写出实验报告。
本实验指导书由于时间仓促,水平所限,难免有疏漏廖误之处,热切期望实验指导老师与学生能提出宝贵的意见,谢谢。
目录实验一紫外分光光度法测定水溶液中苯酚的含量 (1)实验二原子光谱法测定水中金属离子 (3)实验三气相色谱法测定苯系化合物 (5)实验四酚类化合物的高效液相色谱分析测定 (8)实验一紫外分光光度法测定水溶液中苯酚的含量一、实验目的1.巩固紫外-可见分光光度计的基本原理,掌握用紫外-可见分光光度法进行定量测定的方法。

国家级精品课程配套教材:仪器分析实验
国家级精品课程配套教材《仪器分析实验》是一本从理论讲解、实验操作及仪器使用方面出发,集实验操作、仪器使用及数据处理为一体的仪器分析实验教材。
全书共分13章,介绍了原子吸收光谱法(AAS)、X射线衍射分析法(XRD)、X 射线荧光光谱法(XRF)、气相色谱法(GC)、液相色谱法(HPLC)、质谱法(MS)、近红外光谱法(NIR)、热重分析法(TGA)、核磁共振法(NMR)、电化学分析法(EA)等十种常用仪器分析法,内容涉及仪器分析实验原理、实验室环境、实验设计、实验操作、仪器维护、数据处理及结果分析等内容,旨在提供给大学生仪器分析实验的实践指导。


实验二生理盐水中氯离子含量的测定(电位分析法)一、实验目的(1)了解电位滴定法的原理和方法。
(2)熟悉自动电位滴定计的使用方法。
二、实验原理氯离子的测定方法有很多,电位滴定法(利用电位表示滴定过程中溶液电位的变化并指示滴定终点的测定方法)是其中之一。
向含Cl-的溶液中滴加Ag+将生成AgCl沉淀Ag+ + Cl- = AgCl↓在整个滴定过程中,随着银离子的逐步加入,溶液的电位E会随之发生变化,(Ag+/Ag)在终点附近溶液电位会有一突变,根据这一电位的突变即可利用作图(图4.3)或计算的方法确定滴定的终点。
φAg+/Ag =φ0Ag+/Ag– 0.0591gc Cl-本实验用银电极作为指示电极,用双盐桥甘汞电极作参比电极。
三、仪器和试剂1.仪器电位计、双盐桥甘汞电极、银电极、移液管(25mL,10mL)、烧杯(100mL)。
2.试剂标准AgNO3溶液(0.01mo l·L-1),含氯试液。
四、实验步骤1.手动滴定准确移取含氯试液10.00mL到小烧杯中,准确加入蒸馏水25.00mL,放入磁转子,将烧杯放到滴定台上,打开搅拌器,并调好速度(不宜太快,否则旋涡大了使电极脱离溶液)。
记录滴定管的初读数和电位初读数,然后开始手控滴定。
开始时滴加Ag+ 溶液的体积在 1.0mL左右测定一次电位。
当接近终点时(此时电位变化逐步加大)每滴加0.01mL测定一次电位。
直至过量5mL左右。
重复滴定1次。
2.滴定终点的电位确定根据所得到的数据,绘制E-V曲线,利用平行线方法确定滴定终点的电位和体积。
3.自动滴定本实验也可用自动电位滴定仪进行自动滴定。
需要在滴定前预先设置终点电位,然后测定。
五、数据及处理根据电位数值变化,用一阶微分法和二阶微分法作图确定滴定终点体积。
表4.8加入AgNO 3 的体积/mL VEVΔVΔE22ΔVE Δ试液中氯离子含量可以用下式计算试液V 33AgNOAgNOclV CC⨯=-思考题1.电位滴定法的原理是什么?2.在进行沉淀反应的电位滴定时指示电极应根据沉淀反应类型来选择,本实验选用的指示电极是什么?参比电极是什么?能选用其他的电极吗? 3.电位滴定法中,常用滴定终点的确定方法是什么?实验四 紫外分光光度法同时测定食品中的维生素C 和维生素E一、 目的要求1.学习在紫外光谱区同时测定双组分体系——维生素C 和维生素E 的方法。


《仪器分析》电子教案第一章:绪论1.1 课程介绍了解《仪器分析》课程的基本概念、内容、目标和意义。
强调仪器分析在科学研究和实际应用中的重要性。
1.2 仪器分析方法的分类介绍光学分析法、电化学分析法、色谱分析法等常见仪器分析方法。
解释各种方法的原理和特点。
1.3 实验操作规范强调实验室安全、实验操作规范和数据处理的要求。
第二章:光谱分析2.1 紫外-可见光谱分析解释紫外-可见光谱的原理和应用。
介绍紫外-可见光谱仪的使用方法和操作步骤。
2.2 红外光谱分析解释红外光谱的原理和应用。
介绍红外光谱仪的使用方法和操作步骤。
2.3 拉曼光谱分析解释拉曼光谱的原理和应用。
介绍拉曼光谱仪的使用方法和操作步骤。
第三章:色谱分析3.1 气相色谱分析解释气相色谱的原理和应用。
介绍气相色谱仪的使用方法和操作步骤。
3.2 高效液相色谱分析解释高效液相色谱的原理和应用。
介绍高效液相色谱仪的使用方法和操作步骤。
3.3 色谱数据处理解释色谱数据的处理方法,如峰面积计算、峰高度计算等。
介绍色谱数据处理软件的使用方法和操作步骤。
第四章:电化学分析4.1 电位分析解释电位分析的原理和应用。
介绍电位分析仪的使用方法和操作步骤。
4.2 电化学发光分析解释电化学发光分析的原理和应用。
介绍电化学发光分析仪的使用方法和操作步骤。
4.3 电化学探针技术解释电化学探针技术的原理和应用。
介绍电化学探针技术的使用方法和操作步骤。
第五章:质谱分析5.1 质谱原理和仪器解释质谱分析的原理和应用。
介绍质谱仪的使用方法和操作步骤。
5.2 质谱数据解析解释质谱数据的解析方法和技巧。
介绍质谱数据解析软件的使用方法和操作步骤。
5.3 质谱应用案例分析分析质谱在蛋白质分析、代谢组学等领域的应用案例。
强调质谱在科学研究和实际应用中的重要性。
第六章:原子吸收光谱分析6.1 原子吸收光谱原理解释原子吸收光谱的原理,包括光源、样品原子化、检测器等。
介绍原子吸收光谱仪的使用方法和操作步骤。

原子吸收光谱分析基本要点:1. 了解影响原子吸收谱线轮廓的因素;2. 理解火焰原子化和高温石墨炉原子化法的基本过程;3. 了解原子吸收分光光度计主要部件及类型;4. 了解原子吸收分光光度法干扰及其抑制方法;5. 掌握原子吸收分光光度法的定量分析方法及实验条件选择原则。
第一节原子吸收光谱分析概述一、原子吸收光谱分析定义:根据物质产生的原子蒸气中待测元素的基态原子对光源特征辐射谱线吸收程度进行定量的分析方法。
二、原子吸收光谱分析的特点:( 1 )灵敏度高:其检出限可达 10 -9 g /ml ( 某些元素可更高 ) ;( 2 )选择性好:分析不同元素时,选用不同元素灯,提高分析的选择性;( 3 )具有较高的精密度和准确度:试样处理简单。
第二节原子吸收光谱分析基本原理一、原子吸收光谱的产生及共振线在一般情况下,原子处于能量最低状态(最稳定态),称为基态(E 0 = 0)。
当原子吸收外界能量被激发时,其最外层电子可能跃迁到较高的不同能级上,原子的这种运动状态称为激发态。
处于激发电磁波的形式放出能量:共振发射线:电子从基态跃迁到能量最低的激发态时要吸收一定频率的光,它再跃迁回基态时,则发射出同样频率的光(谱线),这种谱线称为共振发射线。
共振吸收线:电子从基态跃迁至第一激发态所产生的吸收谱线称为共振吸收线。
共振线:共振发射线和共振吸收线都简称为共振线。
各种元素的原子结构和外层电子排布不同,不同元素的原子从基态激发至第一激发态(或由第一激发态跃迁返回基态)时,吸收(或发射)的能量不同,因而各种元素的共振线不同而各有其特征性,所以这种共振线是元素的特征谱线。
二、谱线轮廓与谱线变宽式中:Kn ——基态原子对频率为的光的吸收系数,它是光源辐射频率的n函数由于外界条件及本身的影响,造成对原子吸收的微扰,使其吸收不可能仅仅对应于一条细线,即原子吸收线并不是一条严格的几何线(单色l ),而是具有一定的宽度、轮廓,即透射光的强度表现为一个相似于图8-3的频率分布, 若用原子吸收系数Kn随n变化的关系作图得到吸收系数轮廓图:(二)谱线变宽引起谱线变宽的主要因素有:1. 自然宽度:在无外界影响下,谱线仍有一定宽度,这种宽度称为自然宽度,以ΔvN 表示。
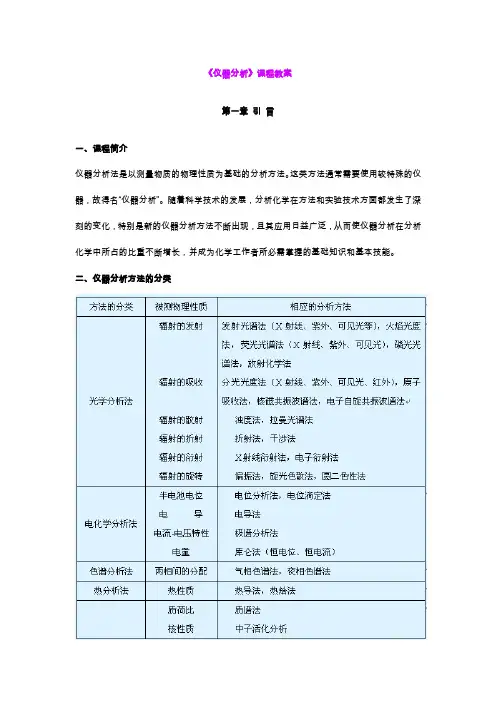
《仪器分析》课程教案第一章引言一、课程简介仪器分析法是以测量物质的物理性质为基础的分析方法。
这类方法通常需要使用较特殊的仪器,故得名“仪器分析”。
随着科学技术的发展,分析化学在方法和实验技术方面都发生了深刻的变化,特别是新的仪器分析方法不断出现,且其应用日益广泛,从而使仪器分析在分析化学中所占的比重不断增长,并成为化学工作者所必需掌握的基础知识和基本技能。
二、仪器分析方法的分类三、仪器分析的特点及发展趋势优点是:1. 操作简便而快速,对于含量很低(如质量分数为10 -8 或10 -9 数量级)的组分,则更具独特之处。
2. 被测组分的浓度变化或物理性质变化能转变成某种电学参数(如电阻﹑电导﹑电位﹑电容﹑电流等),故易于实现自动化和连接电子计算机。
因此,仪器分析具有简便﹑快速﹑灵敏﹑易于实现自动化等特点。
对于结构分析,仪器分析法也是极为重要和必不可少的工具。
生产的发展和科学的进步,不仅对分析化学在提高准确度﹑灵敏度和分析速度等方面提出更高的要求,而且还不断提出更多的新课题。
一个重要的方面是要求分析化学能提供更多﹑更复杂的信息。
现代科学技术发展的特点是学科之间的相互交叉﹑渗透,各种新技术的引人﹑应用等,促进了学科的发展,使之不断开拓新领域﹑新方法。
如电感耦合等离子体发射光谱﹑傅立叶变换红外光谱﹑傅立叶变换核磁共振波谱﹑激光拉曼光谱﹑激光光声光谱等。
另外试样的复杂性﹑测量难度﹑要求信息量及响应速度在不断提高,这就需要将几种方法结合起来,组成连用分析技术,可以取长补短,起到方法间的协同作用,从而提高方法的灵敏度﹑准确度及对复杂混合物的分辨能力,同时还可获得两种手段各自单独使用时所不具备的某些功能,因而连用分析技术以成为当前仪器分析方法的主要方向之一。
计算机技术对仪器分析的发展影响极大。
在分析工作者的指令控制下,仪器自动处于优化的操作条件完成整个分析过程,进行数据采集﹑处理﹑计算等,直至动态CRT 显示和最终曲线报表。

实验一气相色谱的保留值法定性及归一化法定量一、实验目的了解气相色谱仪的结构、性能及使用方法,掌握气相色谱保留值定性分析和归一化法定量分析的方法。
熟悉GC-112A型气相色谱仪的使用,掌握用微量注射器进样的技术。
二、实验原理本实验用氢气作载气,邻苯二甲酸二壬脂作固定液,用热导池检测器,检查未知试样中的指定组分。
并对苯、甲苯、二甲苯混合式样中各种组分进行定量测定。
在一定色谱条件(固定相和操作条件)下,各物质均有其确定不变的保留值,因此,可利用保留值的大小进行定性分析。
对于较简单的多组分混合物,若其色谱峰均能分开,则可将各个峰的保留值,与各相应的标准样品在同一条件所测的保留值一一进行对照,确定各色谱峰所代表的物质。
这一方法是最常用、最可靠的定性分析方法,应用简便.但有些物质在相同的色谱条件下往往具有近似甚至完全相同的保留值,因此,其应用常限制于当未知物已被确定可能为某几个化合物或属于某种类型时作最后的确证。
倘若得不到标准物质,就无法与位置物的保留值进行对照,这时,可利用文献保留值及经验规律进行定性分析。
对于组分复杂的混合物,则要与化学反应及其它仪器分析法结合起来进行定性分析。
在气相色谱法中,定量测定是建立在检测信号(色谱峰的面积)的大小与进入检测器组分的量(可以是重量、体积、物质量等)成正比的基础上。
实际应用时,由于各组分在检测器上的响应值(灵敏度)不同,即等含量的各组分得到的峰面积不同,故引入了校正因子,可选用一标准组分s(一般以苯为标准物质)的校正因子f s'为相对标准,为此,引入相对校正因子f i(即一般所说的校正因子),则被测物i的相对校正因子表达为f i= f i'/f s'=m i A s/m s A i= v i A s/v s A i·ρi/ρs式中,m=v·ρ,v为溶液的体积,ρ为物质的密度。
本实验中要测定的苯、甲苯、二甲苯系同系物,可近似认为其密度ρ相等。
目录第一章 仪器分析实验的基本知识 (1)第一节 仪器分析实验的基本要求 (1)第二节 实验报告和实验数据处理 (3)第三节 玻璃仪器的洗涤和分析实验室的安全规则 (4)第二章 仪器分析实验 (8)实验一 两组分混合物的同时测定 (8)实验二 红外光谱的测绘及结构分析 (11)实验三 荧光分析法测定邻-羟基苯甲酸和间-羟基苯甲酸 (15)实验四 火焰原子吸收法测定自来水中的钙,镁硬度 (17)实验五 ICP原子发射光谱法测定水中常见的金属离子 (23)实验六 气相色谱定性定量分析 (26)实验七 高效液相色谱测定感冒药中的扑热息痛 (30)实验八 离子色谱法测定常见阴离子的含量 (32)实验九 色质联用仪基本操作及谱库检索 (34)实验十 X射线衍射与晶体物相分析 (39)实验十一 X射线荧光光谱分析实验 (43)实验十二 离子选择性电极测定饮用水中的氟 (45)实验十三 循环伏安法测定铁氰化钾的电极过程 (48)第三章 操作规程 (51)一 UV-VIS 分光光度计操作规程 (51)二 Necolet Avatar 360 FT-IR操作规程 (55)三 RF-5301PC荧光分光光度计操作规程 (59)五 ICP-9000等离子发射光谱仪操作规程 (65)六 GC2014 操作规程 (68)七 LC-2010液相色谱仪操作规程 (69)八 离子色谱仪操作步骤 (71)九 GCMS-QP2010操作规程 (74)十 EDX-GP操作規範 (76)十一 X-射线衍射仪操作规程 (77)第一章仪器分析实验的基本知识第一节仪器分析实验的基本要求一、仪器分析实验的教学目的仪器分析实验是仪器分析课的重要内容。
它是学生在教师指导下,以分析仪器为工具,亲自动手获得所需物质化学组成和结构等信息的教学实践活动。
通过仪器分析实验,使学生加深对有关仪器分析方法基本原理的理解,掌握仪器分析实验的基本知识和技能;学生会正确的使用分析仪器;合理地选择实验条件。
实验一气相色谱的保留值法定性及归一化法定量一、实验目的了解气相色谱仪的结构、性能及使用方法,掌握气相色谱保留值定性分析和归一化法定量分析的方法。
熟悉GC-112A型气相色谱仪的使用,掌握用微量注射器进样的技术。
二、实验原理本实验用氢气作载气,邻苯二甲酸二壬脂作固定液,用热导池检测器,检查未知试样中的指定组分。
并对苯、甲苯、二甲苯混合式样中各种组分进行定量测定。
在一定色谱条件(固定相和操作条件)下,各物质均有其确定不变的保留值,因此,可利用保留值的大小进行定性分析。
对于较简单的多组分混合物,若其色谱峰均能分开,则可将各个峰的保留值,与各相应的标准样品在同一条件所测的保留值一一进行对照,确定各色谱峰所代表的物质。
这一方法是最常用、最可靠的定性分析方法,应用简便.但有些物质在相同的色谱条件下往往具有近似甚至完全相同的保留值,因此,其应用常限制于当未知物已被确定可能为某几个化合物或属于某种类型时作最后的确证。
倘若得不到标准物质,就无法与位置物的保留值进行对照,这时,可利用文献保留值及经验规律进行定性分析。
对于组分复杂的混合物,则要与化学反应及其它仪器分析法结合起来进行定性分析。
在气相色谱法中,定量测定是建立在检测信号(色谱峰的面积)的大小与进入检测器组分的量(可以是重量、体积、物质量等)成正比的基础上。
实际应用时,由于各组分在检测器上的响应值(灵敏度)不同,即等含量的各组分得到的峰面积不同,故引入了校正因子,可选用一标准组分s(一般以苯为标准物质)的校正因子f s'为相对标准,为此,引入相对校正因子f i(即一般所说的校正因子),则被测物i的相对校正因子表达为f i= f i'/f s'=m i A s/m s A i= v i A s/v s A i·ρi/ρs式中,m=v·ρ,v为溶液的体积,ρ为物质的密度。
本实验中要测定的苯、甲苯、二甲苯系同系物,可近似认为其密度ρ相等。
故有f i=v i A s/v s A i得到各组分的f I后,即可由测量的峰面积,用归一化法计算出混合物中各组分的百分含量。
其计算公式为C i%=A i f i /( A苯+A甲苯f甲苯+A二甲苯f二甲苯)使用归一化法进行定量,优点是简便,定量结果与进样量无关,操作条件变化对结果影响较小。
但样品的全部组分必须流出,并可测出其信号,对某些不需要测定的组分,也必须测出其信号及校正因子,这是本方法的缺点。
三、仪器与试剂1. 仪器GC-112A型气相色谱仪(使用热导池检测器,内径3毫米、长2米的螺旋状色谱柱,上试102白色担体60-80目,涂渍临苯二甲酸壬酯为固定液,液担比为15:100,H2为载气。
)微量注射器1毫升1支100毫升1支滴管及磨口塞试管若干氢气钢瓶或高纯氢气发生器2. 试剂苯、甲苯、对二甲苯四、实验步骤1. 色谱仪的调节调节方法见仪器分析实验教材(复旦大学编)之10-2-1节。
使氢气流速为20-30毫升/分,柱温为90o C,汽化室温度为150o C左右,热导池温度为120o C左右,热导电流为120毫安。
2. 色谱图的测绘①用微量注射器取苯0.5微升、甲苯0.5微升、对二甲苯1.0微升分别进样,作色谱图。
②用微量注射器取苯、甲苯、对二甲苯的等量混合液1.0微升进样,重复三次,作色谱图。
③用微量注射器取苯、甲苯、对二甲苯未知混合液1.0微升进样,重复三次,作色谱图。
五、数据及处理1.记录色谱操作条件,包括:检测器类型、桥电流、衰减、固定液、色谱柱长及内径,恒温室温度、气化室温度、载气、流速、柱前压、进样量、记录纸速等。
2.测量各标准样品的保留时间,由未知试样中各组分的保留时间确定各色谱峰所代表的组分。
3.求出各组分的定量校正因子。
4.用归一化法求出苯、甲苯、对二甲苯混合液未知式样中各组分的体积百分含量。
六、思考题1. 如果实验中各组分不是等体积混合,其响应值如何计算?2. 如果实验要求测定未知式样各组分的重量百分数,应如何来设计实验?其各组分的响应值是否与本实验求得的值相同?为什么?实验二高效液相法测定健胃消食片中陈皮苷一、实验目的了解液相色谱仪的结构、性能及使用方法,掌握液相色谱分离分析的方法。
熟悉液相色谱仪的使用,掌握用微量注射器进样的技术。
二、实验原理健胃消食片是以陈皮、山楂、山药、太子参、麦芽(炒)此五味药为处方而制成的,具有健胃消食的作用,用于脾胃虚弱所致的食积症。
检测波长的选择,并对陈皮苷的甲醇液在200~400nm波长范围内进行扫描,陈皮苷在283nm处有最大吸收,故选定测定波长为283nm。
三、仪器与试剂1. 仪器日本岛津高效液相色谱仪,LC-10AD泵,SPD-10A 型检测器,电子分析天平(北京多利斯天平有限公司)。
2. 试药D101型大孔树脂(南开大学树脂厂),硅胶G板,甲醇(AR),乙醇(AR),乙酸乙酯(AR),环己烷(AR),甲酸(AR),甲苯(AR),甲醇(HPLC),稀盐酸,1%香草醛硫酸溶液,2%三氯化铁乙醇液,纯蒸馏水,陈皮苷(中国药品生物制品鉴定所,供含量测定用),陈皮干。
四、实验步骤1. 含量测定1.1色谱条件色谱柱Kromasil100-5C18,4.6mm×250mm,5μm;流动相:甲醇∶水(40∶60);流速:1ml/min;检测波长:283nm柱温;350℃;理论塔板数按陈皮苷峰计算应不低于3000。
1.2 溶液的配制1.2.1 检测波长的选择取陈皮苷对照品溶液,用紫外分光光度仪进行光谱检测。
结果表明,陈皮苷在283nm处有最大吸收,见图1。
1.2.2 对照品溶液的制备取陈皮苷对照品15.0mg,精密称定,置100ml 量瓶中,加甲醇稀释至刻度,摇匀;精密量取2ml,置10ml量瓶中,加50%甲醇稀释至刻度,摇匀,即得(每1ml中含陈皮苷30μg)。
1.2.3 供试品溶液的制备取本品20片,研细,取约4g,精密称定,精密加入甲醇25ml,称定重量,置水浴上加热回流1h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液5ml,置10ml量瓶中,加水稀释至刻度,摇匀,滤过,取续滤液,即得。
1.2.4 阴性对照品溶液的制备取不含陈皮的阴性制剂,在同供试品溶液的制备项下操作制得阴性供试品溶液。
1.2.5 对照品、供试品、阴性供试品色谱图见图2~图4。
1.3样品的含量测定取本品4批,制成样品,分别取10μl注入液相色谱仪进行测定含量。
实验三紫外吸收光谱鉴定物质的纯度一、实验目的1. 学习利用紫外吸收光谱鉴定物质纯度的原理和方法;2. 熟练紫外-可见分光光度计的操作。
二、实验原理许多有机物在紫外区有特征吸收光谱,从而可用来进行有机物的鉴定及结构分析(主要用于鉴定有机物的官能团)。
此外,还可对同分异构体进行鉴别,对具有π键电子及共扼双键的化合物特别灵敏,在紫外光区有极强烈的吸收谱。
该法在有机物分析中主要可进行如下分析:①纯度检查。
②未知样的鉴定。
③互变异构体的判别。
④分子结构的推测。
⑤定量测定。
例如,与饱和烃化合物明显不同的是,具有p键电子的共轭双键化合物、芳香烃化合物等,在紫外光谱区都有很强烈吸收,具有摩尔吸光系数ε可达104~105数量级。
利用这一特性,可以很方便地检验纯饱和烃化合物中是否含有共轭双键化合物、芳香烃等杂质。
从图10-5乙醇的紫外吸收光谱图可以看出,由于乙醇中含有微量苯,故在波长230~270nm处出现B吸收带(曲线2),而纯乙醇在该波长范围内不出现苯的B吸收带(曲线1)。
因此,可利用物质的紫外吸收光谱的不同,检验物质的纯度。
图10-6是蒽醌和邻苯二甲酸酐的紫外吸收光谱,由于在蒽醌分子结构中的双键共轭体系大于邻苯二甲酸酐,因此,蒽醌的吸收带红移比邻苯二甲酸酐大,且吸收带形状及其最大吸收波长各不相同,由此得到鉴定。
三、仪器仪器:TU-1901紫外可见分光光度计,1cm石英皿试剂:萘-乙醇溶液,10μg/mL、1μg/mL,苯酚,环己烷四、主要试剂(1)苯、蒽醌、邻苯二甲酸酐、甲醇、乙醇、正庚烷,均为分析纯。
(2)苯的正庚烷溶液和乙醇溶液。
在两个100mL容量瓶各注入10μL苯,然后分别用正庚烷和乙醇稀释至刻度,摇匀。
(3)蒽醌的甲醇溶液(0.1g·L-1)。
(4)邻苯二甲酸酐的甲醇溶液(0.1g·L-1)。
五、实验步骤(1)按照仪器使用说明调节仪器至正常状态,设定好相关参数,备用。
(2)用待测试液洗涤石英比色皿3次,装入待测试液至比色皿容积的2/3~4/5,将比色皿放入比色皿架,盖好盖板。
(3)仪器调零。
(4)扫基线(对参比溶液调零)。
(5)记录待测物紫外吸收光谱。
六、实验数据及处理(1)记录实验条件,保存实验资料。
(2)通过紫外吸收光谱的对比,说明检验物质纯度的可行性。
(3)与萨特勒(Sadtler)紫外标准图谱对照,检查测得的苯、蒽醌、邻苯二甲酸酐的峰值吸收波长λmax是否与标准图谱一致。
七、思考题1. 如何利用紫外吸收光谱进行物质纯度检查?2. 在紫外光谱区饱和烷烃为什么没有吸收峰?3. 为什么紫外吸收光谱可用于物质纯度检查?实验四水样的pH值测定一、实验目的1.学习pHS-2C型酸度计的使用方法。
2.了解电位法测定水的pH值的原理和方法。
二、实验原理在日常生活和工农业生产中,所用水的质量都有一定标准。
在进行水质检验中,水的pH 值是重要检验项目之一,如生活饮用水pH 要求为6.5~8.5。
低压锅炉水要求pH 为10~12。
电子工业、实验试剂配制则需要中性的高纯水。
现在测量水的pH 值比较精确的方法是电位法,该法是将玻璃电极(指示电极)、饱和甘汞电极(参比电极)与待测试液组成原电池,用酸度计(一种精密电位差计)测量其电势。
原电池用下式表示:Ag|AgCl(s)|HCl(0.1mol·L -1)|玻璃膜|试液溶液(xmol·L -1)║KCl(饱合)|Hg 2Cl 2(s)|Hg玻璃电极 被测溶液 甘汞电极玻璃电极为负极,饱和甘汞电极为正极。
在一定条件下,电池的电动势E 与pH 为直线函数关系(推导过程从略)。
试电池pH FRT 303.2'K E += 由上式看出,求出E 电池和K ,即可知道试液的pH 值。
E 电池可通过测量求得,而K ’是由内外参比电极及难于计算的不对称电位和液接电位所决定的常数,很难求得。
在实际测量时,选用和待测试液pH 值相似的、已知pH 值的标准缓冲溶液在pH 计上进行校正(这个过程叫定位)。
通过以上步骤,可在酸度计上直接读出试液的pH 值。
一支电极应使用两种不同pH 值的标准pH 缓冲溶液进行校正,两种缓冲溶液定位的pH 值误差应在0.05之内。
三、仪器及试剂1. 仪器pHS-2C 酸度计一台,E-201-C9型复合pH 电极一支,(或231型玻璃电极和232型饱和甘汞电极各一支),50mL 烧杯7只。