物理化学_傅献彩_课后复习题答案_第十二章_化学动力学基础(二)
- 格式:doc
- 大小:4.45 MB
- 文档页数:6



目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。


物理化学傅献彩版复习题物理化学是化学学科中的一个重要分支,它研究物质的物理性质和化学性质之间的关系,以及这些性质如何随物质状态的变化而变化。
傅献彩教授的《物理化学》教材是许多高校化学专业学生必修的课程之一。
为了帮助学生更好地复习和掌握物理化学的知识点,以下是一些复习题的示例,覆盖了基础概念和重要原理。
1. 热力学第一定律- 描述热力学第一定律的数学表达式。
- 解释内能、热量和功的概念,并给出它们在热力学第一定律中的关系。
- 举例说明在等压、等容和绝热过程中,系统内能的变化。
2. 热力学第二定律- 简述热力学第二定律,并解释熵的概念。
- 描述熵增原理,并讨论它对自然过程方向性的影响。
- 举例说明在不可逆过程中熵的变化。
3. 化学平衡- 写出化学平衡常数的表达式,并解释其物理意义。
- 讨论勒夏特列原理,并用实例说明其在化学平衡中的应用。
- 计算给定条件下的化学平衡常数,并预测平衡位置的变化。
4. 相变和相图- 描述相变的条件,并解释相变过程中的潜热。
- 解释相图的基本概念,如单组分系统和双组分系统的相图。
- 根据相图分析物质在不同温度和压力下的相态。
5. 电化学- 描述法拉第定律,并解释电化学电池的工作原理。
- 讨论电极反应的类型,并给出相应的电极反应方程式。
- 计算电化学电池的电动势,并解释电池效率。
6. 表面化学- 描述表面张力的概念,并解释它对液体表面形状的影响。
- 讨论吸附现象,并解释物理吸附与化学吸附的区别。
- 计算给定条件下的吸附等温线,并分析吸附等温线的形状。
7. 统计热力学- 描述玻尔兹曼分布,并解释它在统计热力学中的应用。
- 讨论最可几分布,并解释它与能量均分原理的关系。
- 计算给定系统中分子的配分函数,并用它来计算系统的热力学性质。
8. 溶液的物理化学性质- 描述溶液的浓度表示方法,并解释摩尔浓度与质量分数的关系。
- 讨论溶液的渗透压,并解释它与溶质粒子数的关系。
- 计算给定溶液的渗透压,并分析溶质浓度对渗透压的影响。



物理化学思考题目录第一章热力学第一定律 (2)第二章热力学第二定律 (6)第三章统计热力学初步 (10)第四章溶液 (13)第五章相平衡 (16)第六章化学平衡 (20)第七章电解质溶液 (22)第八章可逆电池的电动势及其应用 (25)第九章电解与极化作用 (29)第十章化学动力学基础 (32)第十一章界面现象 (36)第十二章胶体分散体系与大分子溶液 (38)第一章 热力学第一定律1、为什么第一定律数学表示式dU=δQ-δW 中内能前面用微分号d ,而热量和功的前面用δ符号?答:因为内能是状态函数,具有全微分性质。
而热量和功不是状态函数,其微小改变值用δ表示。
2、公式H=U+PV 中H > U,发生一状态变化后有ΔH =ΔU +Δ(PV ),此时ΔH >ΔU 吗?为什么?答:不一定。
因为Δ(PV )可以为零、正数和负数。
3、ΔH = Qp , ΔU = Qv 两式的适用条件是什么?答:ΔH = Qp 此式适用条件是:封闭系等压非体积功为零的体系。
ΔU = Qv 此式适用条件是:封闭系等容非体积功为零的体系。
(1)状态确定后,状态函数的值即被确定。
答:对。
(2)状态改变后,状态函数值一定要改变。
答:不对。
如:理想气体等温膨胀过程,U 和H 的值就不变化。
(3)有一个状态函数值发生了变化,状态一定要发生变化。
答:对。
4、 想气体绝热向真空膨胀,ΔU=0,ΔH=0对吗?答:对。
因理想气体绝热向真空膨胀过程是一等温过程。
5、恒压、无相变的单组分封闭体系的焓值当温度升高时是增加、减少还是不变? 答:增加。
6、当体系将热量传递给环境后,体系的焓值是增加、不变还是不一定改变? 答:不一定改变。
7、等温等压进行的某化学反应,实验测得T 1和T2时的热效应分别为ΔrH 1和ΔrH 2,用基尔霍夫公式验证时,发现数据不相等。
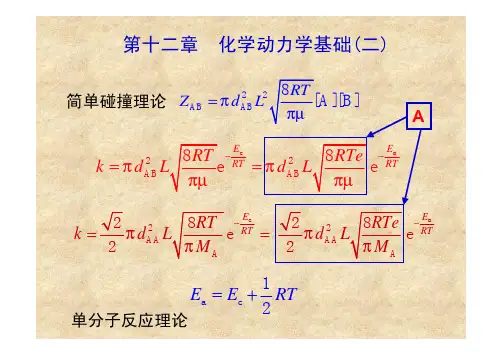

物理化学傅献彩复习题答案【篇一:物理化学傅献彩课后复习题(非习题)答案】【篇二:南京大学物理化学下册(第五版傅献彩)复习题及解答】>第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:2+2+-(1)金属气体电极如zn(s)|zn (m) zn(m) +2e= zn(s)-- -(2)金属难溶盐和金属难溶氧化物电极如 ag(s)|agcl(s)|cl(m),agcl(s)+ e= ag(s)+cl(m)3+2+3+- 2+(3)氧化还原电极如: pt|fe(m1),fe(m2)fe(m1) +e= fe(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么weslon标准电池的负极采用含有cd的质量分数约为0.04~0.12的cd一hg齐时,标准电池都有稳定的电动势值?试用cd一hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在cd一hg的二元相图上,cd的质量分数约为0.04~0.12的cd一hg齐落在与cd一hg固溶体的两相平衡区,在一定温度下cd 一hg齐的活度有定值。
因为标准电池的电动势在定温下只与cd一hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。