第十一章氧化还原反应
- 格式:doc
- 大小:75.50 KB
- 文档页数:4


第十一章氧化还原平衡与氧化还原滴定法一、选择题1.在一个氧化还原反应中,如果两个电对的电极电势值相差越大,则下列描述该氧化还原反应中正确的是()A.反应速度越大 B.反应速度越小 C.反应能自发进行 D.反应不能自发进行2.在电极反应S2O32-+2e SO42-中,下列叙述正确的是()A.S2O32-是正极,SO42-是负极 B.S2O32-被氧化,SO42-被还原C.S2O32-是氧化剂,SO42-是还原剂 D.S2O32-是氧化型,SO42-是还原型3.将反应:Fe2++ Ag+ = Fe3+ + Ag组成原电池,下列表示符号正确的是()A.Pt|Fe2+,Fe3+||Ag+|Ag B.Cu|Fe2+,Fe3+||Ag+|FeC.Ag|Fe2+,Fe3+||Ag+|Ag D.Pt|Fe2+,Fe3+||Ag+|Cu4.有一原电池:Pt|Fe2+,Fe3+||Ce4+,Ce3+|Pt,则该电池的反应是()A.Ce3++ Fe3+ Fe2++Ce4+ B.Ce4+ + e Ce3+C.Fe2+ +Ce4+ Ce3++ Fe3+ D.Ce3++ Fe2+ Fe +Ce4+5.在2KMnO4 + 16HCl 5Cl2 + 2MnCl2 + 2KCl +8H2O的反应中,还原产物是下面的哪一种()。
A.Cl2 B.H2O C.KCl D.MnCl26.Na2S2O3与I2的反应,应在下列哪一种溶液中进行()A.强酸性 B.强碱性 C.中性或弱酸性 D.12mol·L-1 HCl中7.在S4O62-离子中S的氧化数是( )A.2 B.2.5 C.+2.5 D.+48.间接碘量法中,应选择的指示剂和加入时间是()A.I2液(滴定开始前) B.I2液(近终点时)C.淀粉溶液(滴定开始前) D.淀粉溶液(近终点时)9.用Na2C2O4标定KMnO4溶液浓度时,指示剂是()A.Na2C2O4溶液 B.KMnO4溶液 C. I2液 D.淀粉溶液10.用K2Cr2O7标定Na2S2O3溶液的浓度,滴定方式采用()A.直接滴定法 B.间接滴定法 C.返滴定法 D.永停滴定法二、判断题1.氧化还原反应中氧化剂得电子,氧化数降低;还原剂失电子,氧化数升高。

氧化还原反应教案精选案例大全第一章:氧化还原反应基本概念1.1 氧化还原反应的定义氧化还原反应的定义及特点氧化还原反应与化学反应的关系1.2 氧化还原反应的基本术语氧化剂、还原剂氧化数、氧化态电子转移1.3 氧化还原反应的表示方法半反应式离子方程式电子转移数第二章:氧化还原反应的类型2.1 单质之间的氧化还原反应同种元素之间的氧化还原反应不同元素之间的氧化还原反应2.2 化合物之间的氧化还原反应置换反应合成反应分解反应2.3 离子化合物与自由原子之间的氧化还原反应酸碱反应氧化剂与还原剂的反应第三章:氧化还原反应的判断与平衡3.1 氧化还原反应的判断氧化还原反应的实验判断氧化还原反应的理论判断3.2 氧化还原反应的平衡氧化还原反应的平衡常数氧化还原反应的平衡移动3.3 氧化还原反应的平衡计算标准电极电势的计算氧化还原反应的平衡常数计算第四章:氧化还原反应的应用4.1 电化学中的应用原电池电解质电镀4.2 分析化学中的应用滴定极谱分析原子吸收光谱分析4.3 合成化学中的应用有机合成催化剂材料合成第五章:氧化还原反应的实例解析5.1 实例一:铁的腐蚀与防护铁的腐蚀原理铁的防护方法5.2 实例二:漂白粉的制备与作用漂白粉的制备方法漂白粉的氧化还原反应原理5.3 实例三:合成氨的工业生产合成氨的反应原理合成氨的氧化还原反应过程5.4 实例四:药物的合成与分析药物合成中的氧化还原反应药物分析中的氧化还原反应5.5 实例五:环境污染与治理氧化还原反应在环境污染治理中的应用典型环境污染治理案例分析第六章:氧化还原反应在无机化学中的应用6.1 无机化学中的氧化还原反应类型酸碱反应中的氧化还原反应置换反应中的氧化还原反应合成反应中的氧化还原反应6.2 无机化学中的重要氧化还原反应水的电解硫酸的制备金属的提取与精炼6.3 氧化还原反应在无机合成中的应用制备无机化合物制备无机材料制备无机催化剂第七章:氧化还原反应在有机化学中的应用7.1 有机化学中的氧化还原反应类型加成反应中的氧化还原反应消除反应中的氧化还原反应还原反应中的氧化还原反应7.2 有机化学中的重要氧化还原反应醇的氧化酮的氧化醛的氧化7.3 氧化还原反应在有机合成中的应用合成有机化合物合成有机材料合成有机药物第八章:氧化还原反应在生物化学中的应用8.1 生物化学中的氧化还原反应类型呼吸作用中的氧化还原反应光合作用中的氧化还原反应代谢反应中的氧化还原反应8.2 生物化学中的重要氧化还原反应酶催化下的氧化还原反应血红蛋白的氧化还原反应谷胱甘肽的氧化还原反应8.3 氧化还原反应在生物检测与治疗中的应用氧化还原指示剂氧化还原探针氧化还原反应在生物治疗中的应用第九章:氧化还原反应在工业中的应用9.1 氧化还原反应在金属冶炼中的应用火法冶炼湿法冶炼9.2 氧化还原反应在化工生产中的应用合成纤维合成塑料合成橡胶9.3 氧化还原反应在能源转换中的应用电池燃料电池太阳能电池第十章:氧化还原反应在环境科学中的应用10.1 氧化还原反应在环境监测中的应用水质监测空气质量监测土壤污染监测10.2 氧化还原反应在环境治理中的应用废水处理废气处理固体废物处理10.3 氧化还原反应在环境友好型材料中的应用生物降解材料光催化材料空气净化材料第十一章:氧化还原反应在现代科技中的应用11.1 氧化还原反应在纳米技术中的应用纳米材料的合成纳米电子学11.2 氧化还原反应在光电子学中的应用太阳能电池激光技术11.3 氧化还原反应在生物医学中的应用生物传感器药物输送系统第十二章:氧化还原反应与生活常识12.1 氧化还原反应在日常生活中的应用食物的腐败与保存燃料的燃烧12.2 氧化还原反应在健康饮食中的应用营养素的氧化还原性质抗氧化剂的作用12.3 氧化还原反应在安全知识中的应用爆炸原理化学中毒的防护第十三章:氧化还原反应在药物化学中的应用13.1 氧化还原反应在药物合成中的应用药物合成中的氧化步骤药物合成中的还原步骤13.2 氧化还原反应在药物分析中的应用药物含量测定药物纯度分析13.3 氧化还原反应在药物治疗中的应用抗凝血药物抗氧化药物第十四章:氧化还原反应在材料科学中的应用14.1 氧化还原反应在金属材料中的应用金属的腐蚀与防护金属的合金化14.2 氧化还原反应在半导体材料中的应用晶体管的制造集成电路的制造14.3 氧化还原反应在新材料研发中的应用纳米材料的制备功能化材料的设计第十五章:氧化还原反应的未来发展趋势15.1 氧化还原反应在绿色化学中的应用可持续发展的化学环境友好型合成方法15.2 氧化还原反应在能源领域的挑战与发展清洁能源的制备与存储电池技术的创新15.3 氧化还原反应在生命科学中的探索生物体内的氧化还原平衡疾病与氧化应激的关系重点和难点解析本文主要介绍了氧化还原反应的基本概念、类型、判断与平衡、应用以及在不同领域中的具体实例和未来发展趋势。

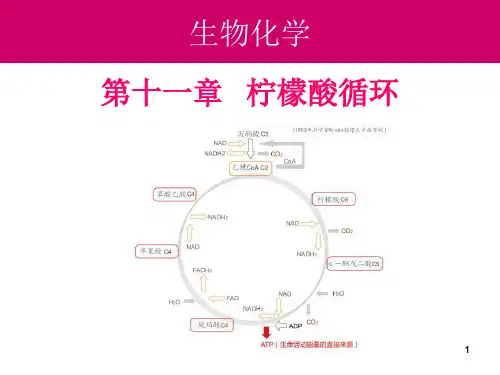

第⼗⼀章氧化还原滴定法第⼗⼀章氧化还原滴定法第⼀节氧化还原反应⼀、氧化还原反应氧化还原滴定法是以氧化还原反应为基础的滴定分析⽅法,⽤于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进⾏间接测定。
上述的三个化学反应⽅程式中1和3中有元素的化合价发⽣了变化,我们把有这种现象的化学⽅程式的反应称为氧化还原反应。
1. 标志:元素化合价发⽣变化。
2. 定义:发⽣电⼦的转移(电⼦的得失或电⼦对的偏转)的反应,称为氧化还原反应。
3. 规律:升失电⼦总数相等。
练习:判断下列化学反应是否是氧化还原反应1. 2H2O === H2↑+ O2↑2. 2Na+ Cl2 === 2NaCl3. Zn + H2SO4 === ZnSO4 + H2↑⼆、常见的氧化剂和还原剂1.过氧化氢纯净的过氧化氢是⽆⾊粘稠液体,可与⽔以任意⽐例混合,汽⽔溶液称双氧⽔,过氧化氢受热、遇光,接触灰尘易分解⽣成⽔和氧⽓。
2H2O2 === 2H2O+ O2↑因此过氧化氢具消毒杀菌的作⽤。
医学上常⽤质量分数为0.03的过氧化氢⽔容易作为外⽤消毒剂,清晰创⼝。
市售过氧化氢的质量分数为0.3,有较强的氧化性,对⽪肤有很强的刺激作⽤,使⽤时要进⾏稀释。
2.⾼锰酸钾医学上成为P.P,为深紫⾊有光泽的晶体。
易溶于⽔,⽔溶液的颜⾊根据⾼锰酸钾的含量的多少可有暗紫红⾊到鲜红⾊。
⾼锰酸钾是强氧化剂,医学⽣常⽤其稀释液作为外⽤消毒剂。
3.硫代硫酸钠常⽤的是硫代硫酸钠晶体(带有5个结晶⽔)俗称海波。
它是⽆⾊晶体,易溶于⽔,具有还原性。
苏打:Na2CO3⼩苏打:NaHCO3⼤苏打:Na2S2O3·5H2O硫代硫酸钠在照相术中常⽤作定影剂,医学上可⽤于治疗慢性荨⿇疹或作解毒剂。
第⼆节⾼锰酸钾法⼀、原理(⼀)⾼猛酸钾法的原理在强酸性溶液中,以⾼锰酸钾为滴定液,直接或间接测定还原性或氧化性物质含量的氧化还原滴定法。
终点前:过氧化氢郭亮,随着滴定的进⾏,过氧化氢越来越少。



人教版高中化学教材的完整清单第一册:物质的结构与性质1. 第一章:物质的组成与结构2. 第二章:物质的性质与变化3. 第三章:元素与化合物4. 第四章:离子反应与电解质5. 第五章:化学反应与能量6. 第六章:化学反应速率7. 第七章:化学平衡8. 第八章:酸碱中和反应9. 第九章:盐类的常见性质10. 第十章:金属与非金属第二册:化学反应原理1. 第十一章:氧化还原反应2. 第十二章:金属的氧化与还原3. 第十三章:金属与非金属的反应4. 第十四章:酸与碱的反应5. 第十五章:酸碱中和滴定6. 第十六章:氧化还原滴定7. 第十七章:氧化还原反应的应用8. 第十八章:电化学电池第三册:化学量与化学反应1. 第十九章:化学量与化学计量2. 第二十章:化学反应的速率和平衡3. 第二十一章:化学反应的平衡常数4. 第二十二章:离子在溶液中的平衡5. 第二十三章:溶液的浓度6. 第二十四章:溶液的物理性质7. 第二十五章:酸碱溶液的离子反应8. 第二十六章:酸碱溶液的中和反应第四册:化学能与化学反应1. 第二十七章:化学能与化学反应2. 第二十八章:化学热力学3. 第二十九章:能量守恒定律4. 第三十章:气体的性质和组成5. 第三十一章:气体的压强和体积6. 第三十二章:气体的温度和摩尔数7. 第三十三章:气体的混合和解吸8. 第三十四章:气体的溶解和溶液第五册:物质结构与性质1. 第三十五章:元素周期表的结构和性质2. 第三十六章:元素周期表的应用3. 第三十七章:元素与化合物的定性分析4. 第三十八章:有机化合物的结构和性质5. 第三十九章:烃类化合物的性质和应用6. 第四十章:含氧化合物的性质和应用7. 第四十一章:含氮化合物的性质和应用8. 第四十二章:含卤素化合物的性质和应用以上为人教版高中化学教材的完整清单,共包含五册内容,涵盖了化学的各个方面。
希望对您有所帮助!。


第十一章 氧化还原反应1. 用离子电子法配平下列反应式:(1)PbO 2 + Cl - → Pb 2+ + Cl 2 (酸性介质) (2)Br 2 → BrO 3- + Br - (酸性介质) (3)HgS + NO 3- + Cl - → HgCl 42- + NO 2 + S (酸性介质) (4)CrO 42- + HSnO 2- → HSnO 3- + CrO 2- (碱性介质) (5)CuS + CN - + OH - → Cu(CN)43- + NCO- + S (碱性介质) 解:用离子电子法配平:(1)PbO 2 + Cl - → Pb 2+ + Cl 2 (酸性介质)PbO 2 + 4H + + 2e - = Pb 2+ + 2H 2O (还原) +)2Cl - = Cl 2 + 2e - (氧化)PbO 2 + 2Cl + 4H = Pb + Cl 2 +2H 2O (2)Br 2 → BrO 3- + Br - (酸性介质)×5)21Br 2 + e - = Br - (还原)+)×1)2Br 2 + 3 H 2O = BrO 3- + 5Br - + 6H + (氧化)3Br 2 + 3H 2O = BrO 3- + 5Br - + 6H +(3)HgS + NO 3- + Cl - → HgCl 42- + NO 2↑+ S (酸性介质) ×2)NO 3- + 2H + + e - = NO 2 + H 2O (还原) +) HgS + 4Cl - = HgCl 42- + S + 2e - (氧化)HgS + 2NO 3 + 4Cl + 4H = HgCl 4 + 2NO 2↑+ S +2H 2O(4)CrO 42- + HSnO 2- → HSnO 3- + CrO 2- (碱性介质) ×2)CrO 42- + 2H 2O + 3e - = CrO 2- + 4OH - (还原) +)×3)HSnO 2- + 2OH - = HSnO 3- + H 2O + 2e - (氧化)2CrO 4 + 3HSnO 2 + 4H 2O + 6OH = 3HSnO 3- + 2CrO 2- + 8OH - + 3H 2O 整理:2CrO 42- + 3HSnO 2- + H 2O = 3HSnO 3- + 2CrO 2- + 2OH -(5)CuS + CN - + OH - → Cu(CN)43- + NCO - + S (碱性介质) ×2)CuS + 4CN - + e - = Cu(CN)43- + S 2- (氧化) +) CN - + 2OH - = NCO - + H 2O + 2e - (还原)2CuS + 9CN - + 2OH - = 2Cu(CN)43- + NCO - + H 2O +2S 2-2. 用离子电子法配平下列电极反应: (1)MnO 4- → MnO 2 (碱性介质) (2)CrO 42- →Cr(OH)3 (碱性介质) (3)H 2O 2 → H 2O (碱性介质) (4)H 3AsO 4 → H 3AsO 3 (酸性介质) (5)O 2 → H 2O 2(aq) (酸性介质) 答:配平过程略。
必修三高中化学所有教材(全)本文档包括了必修三高中化学的全部教材内容。
以下是各章节的简要介绍:第一章:化学与生活该章节主要介绍化学在日常生活中的应用。
包括各种物质的分类、观察现象的解释以及化学方程式的编写和平衡等内容。
第二章:离子反应与化学方程式本章重点讲解了离子反应的原理和特点,包括离子方程式的写法、溶液中离子的特性等。
第三章:氧化还原与电化学该章主要介绍了氧化还原反应的基本概念和规律。
包括电子的转移、氧化剂和还原剂的定义与性质等内容。
同时也引入了电化学的内容,讲解了电池、电解池等基本概念。
第四章:化学反应速率和化学平衡本章介绍了化学反应速率和化学平衡的相关概念。
包括反应速率的计算方法、平衡常数的定义与计算等内容。
第五章:溶液的动力学与化学平衡该章节主要讲解了溶液的动力学和溶解平衡的相关知识。
包括溶液的浓度计算、动力学平衡的表达式等内容。
第六章:化学能量与热力学本章介绍了化学能量的基本概念和热力学原理。
包括热化学方程式的计算、热力学定律的应用等内容。
第七章:化学元素与化合物该章节主要讲解了化学元素和化合物的性质和结构。
包括原子结构、元素周期表、功能性基团等内容。
第八章:化学反应中的能量变化本章主要介绍了化学反应中的能量变化及其计算方法。
包括能量守恒定律、焓变化的计算与应用等内容。
第九章:空气与氧的制备与应用该章节主要讲解了空气和氧的制备方法和应用。
包括空气中气体的分离、氧气的制备与应用等内容。
第十章:金属与非金属本章介绍了金属和非金属的性质和特点。
包括金属的化学性质、金属与非金属的反应等内容。
第十一章:氧化还原反应与电化学该章节主要讲解了氧化还原反应和电化学的相关知识。
包括氧化还原反应的类型、电化学电池的原理和应用等内容。
以上是必修三高中化学所有教材的内容概述。
详细内容请参考相应章节的教材。
第十一章 电化学基础11-1 用氧化值法配平下列方程式 (1)KCl KClO 3KClO 443+=(2)CO 30P 3CaF 2CaSiO 18SiO 18C 30F )PO (Ca 44232345+++=++ (3)O 2H NaCl N Cl NH NaNO 2242++=+(4)O H 7SO K )SO (Fe 3)SO (Cr SO H 7FeSO 6O Cr K 242342342424722+++=++ (5)Cs 2CaCl Ca CsCl 22+=+↑11-2 将下列水溶液化学反应的方程式先改写为离子方程式,然后分解为两个半反应式 (1)2222O O H 2O H 2+=O H e H O H 222222=++-+ -+++=e H O O H 22222(2)HClO HCl O H Cl 22+=+ -+++=+Cl H HClO O H Cl 22--=+Cl e Cl 221-+++=+e H HClO O H Cl 2221(3)O H 3KCl 5KClO KOH 6Cl 3232++=+O H 3Cl 5ClO OH 6Cl 3232++=+-----=+Cl 5e 5Cl 225---++=+e 5O H 3ClO OH 6Cl 23221(4)O H MnSO SO Fe SO K SO H FeSO KMnO 2434242424444)(528104+++=++O H 4Mn 2Fe 5H 8Fe 5MnO 222324++=++++++-O H 4Mn e 5H 8MnO 224+=+++-+--+++=e Fe Fe 3222(5)O H 7O 3)SO (Cr SO K SO H 7O H 3O Cr K 22342424222722+++=++O H O Cr H O H O Cr 22322272732143++=++++-O H 7Cr 2e 6H 14O Cr 23272+=+++-+--+++=e O H O H 2222211-3 用半反应法(离子-电子法)配平下列方程式:(1)K 2Cr 2O 7 + H 2S + H 2SO 4 → K 2SO 4 + Cr 2(SO 4)3 + S + H 2OCr 2O 72- + 14H + + 6e - === 2Cr 3+ + 7H 2O ① H 2S === S + 2H + + 2e - ② ①+3×②得:Cr 2O 72- + 3H 2S + 8H + === 2Cr 3+ + 3S + 7H 2OO H 7S 3)SO (Cr SO K SO H 4S H 3O Cr K 234242422722+++=++(2) -24MnO + H 2O 2 → O 2 + Mn 2+(酸性溶液)MnO 42- + 8H + + 4e- === Mn 2+ + 4H 2O ①H 2O 2 === O 2 + 2H =+ 2e - ② ①+2×②得:MnO 42- + 2H 2O 2 + 4H + - === Mn 2+ + 2O 2 + 4H 2O(3) Zn + NO 3– + OH – → NH 3 + Zn(OH)42–---+=++OH NH e O H NO 986323 ①---+=+e 2)OH (Zn OH 4Zn 24②①+4×②得: ---+=+++24323)(4674OH Zn NH O H OH NO Zn(4) Cr(OH)4-+ H 2O 2 → CrO 42---=+OH e O H 2222 ①Cr(OH)4-+ 4OH -=== CrO 42-+ 4H 2O + 3e -②①×3+2×②得: 2Cr(OH)4- + 3H 2O 2 +2OH -=== 2CrO 42-+ 8H 2O(5) Hg + NO 3–+ H + → Hg 22+ + NOO H 2NO e 3H 4NO 23+=++-+-①-++=e 2Hg Hg 222②①×2+3×②得: O H 4NO 2Hg 3H 8NO 2Hg 62223++=++++-11-4 将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号。
第十一章氧化还原反应一、选择题11.1 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:()(A) K2Cr2O7 ;(B) PbO2;(C) O2;(D) FeCl311.2 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:()(A) 加入Sn 粒;(B) 加Fe 屑;(C)通入H2;( D) 均可11.3下列各组物质能够在标准状态下能够共存的是()(A),Cu (B),(C),(D),(已知:,,,,)答案:D、A、B11.4 某氧化剂YO(OH)2+中元素Y的价态为+5,如果还原7.16×10-4molYO(OH)2+溶液使Y 至较低价态,则需用0.066mol.dm-3的NaSO3溶液26.98ml。
还原产物中Y元素的氧化态为(A)-2 (B)-1 (C) 0 (D) +111.5已知电极反应ClO3-+6H++6e-=Cl-+3H2O的△r Gmθ=-839.6KJ.mol-1,则Eθ(ClO3-/Cl-)值为(A)1.45 V (B)0.73V (C) 2.90V (D) -1.45V11.6 使下列电极反应中有关离子浓度减小一半,而E值增加的是(A)Cu++2e-=Cu (B)I2+2e-=2I-(C) 2H++2e-=H2(D) Fe3++e-=Fe2+11.7 将有关离子浓度增大5倍,E值保持不变的电极反应是(A)Zn2++2e-=2HCl (B)2Fe3++Cu=2Fe2++Cu2+(C) Ag++Cl-=AgCl (D) 2Hg2++Sn2+=Hg22++Sn4+11.8 将下列反应设计成原池时,不用惰性电极的是(A)H2+Cl2=2HCl (B)2Fe3++Cu=2Fe2++Cu2+(C) Ag++Cl-=AgCl (D) 2Hg2++Sn2+=Hg22++Sn4+11.9 下列氧化还原电对在Eθ值最大的是(A)Ag+/Ag (B)AgCl/Ag (C) AgBr/Ag (D) AgI/Ag11.10已知Eθ(Zn2+/Zn)=-0.76V,下列原电池反应的电动势为0.46V,则氢电极溶液中的PH为Zn+2H+(a mol.dm-3)=Zn2+(1 mol.dm-3)+H2(1.013×105)(A)10.2 (B) 2.5 (C) 3.0 (D) 5.111.11 以惰性电极电解一段时间后,PH增大的溶液是(A)HCl (B) H2SO4(C) Na2SO4(D) NaHSO411.12将标准氢电极与另一氢电极组成原电池,若使电池的电动势最大,另一氢电极所采用的酸性溶液应是(A)0.1 mol.dm-3HCl (B)0.1 mol.dm-³ HAc+0.1 mol.dm-³ NaAc(C) 0.1 mol.dm-3 HAc (D) 0.1 mol.dm-3 H2SO411.13 现有原电池(-)Pt∣Fe3+,‖Ce4+,Ce3+∣Pt(+),该原电池放电时所发生的反应是(A)Ce3++Fe3+=Ce4++Fe2+(B)3Ce4++Ce=4Ce3+(C) Ce4++Fe2+=Ce3++Fe3+(D) 2Ce4++Fe=2Ce3++Fe2+11.14 以惰性电极电解一段时间后,PH减小的溶液是(A)HCl (B)NaHSO4(C) Na2SO4(D) NaCl11.15 某氧化还原反应的标准吉布斯自由能变为△rθmG,平衡常数为Kθ,标准电动势为Eθ,则下列对△rθmG,Kθ的值判断合理的一组是(A)△rθmG> 0 Eθ< 0 Kθ< 1(B) △rθmG>0 Eθ< 0 Kθ> 1(C) △rθmG<0 Eθ<0 Kθ> 1(D) △rθmG<0 Eθ>0 Kθ< 111.16 已知Eθ(M3+/M2+) > Eθ[M(OH)3/M(OH)2],则溶度积Kθsp[M(OH)3]与Kθsp[M(OH)2]的关系是(A)Kθsp[M(OH)3] > Kθsp[M(OH)2](B)Kθsp[M(OH)3] < Kθs p[M(OH)2](C) Kθsp[M(OH)3] = Kθsp[M(OH)2](D) 无法判断11.17 某电池的电动势E为0.27V,则该电池的标准电动势Eθ为(A)0.24V (B) 0.27V (C) 0.30V (D) 0.33V11.18 已知钒的元素电势图EθA/V (V)1.0 V(Ⅳ)0.36 V(Ⅲ)-0.26 V(Ⅱ)欲将V(V)还原为V(Ⅳ),应选用的还原剂为(A)SnCl2(B) Zn粉(C) KBr (D) FeSO411.19 已知配合物的稳定常数K稳[Fe(CN)63-]>K稳[Fe(CN)64-],则下面对Eθ[Fe(CN)63-/ Fe(CN)64-]与Eθ(Fe3+/Fe2+)判断正确的是(A) Eθ[Fe(CN)63-/ Fe(CN)64-] > Eθ(Fe3+/Fe2+)(B) Eθ[Fe(CN)63-/ Fe(CN)64-] < Eθ(Fe3+/Fe2+)(C) Eθ[Fe(CN)63-/ Fe(CN)64-] = Eθ(Fe3+/Fe2+)(D)无法判断。
11.20 电极电势与PH无关的电对是(A)H 2O 2/H 2O (B) IO 3-/I - (C)MnO 2/Mn 2+ (D)MnO 4-/MnO 42-二、填空题11.21 电池(-)Pt|H 2(1.013×10-3mol.dm -3) ‖ H +(1mol.dm-³)|H 2(1.013×105Pa)|Pt(+)属于 电池,该电池的电动势为 V ,电池反应为 。
11.22 将Ag-AgCl 电极[E θ(AgCl/Ag)=0.2222V]与饱和甘汞电极[E θ=0.2415V]组成电池,该原电池的电池符号为 ;正极反应 ;负极反应 ;电池反应 ; 电池反应的平衡常数为 。
11.23 现有下列4种物质:KI ,NH 3·H 2O ,Na 2S 2O 3 和 Na 2S ,并已知K θsp (AgI )=9.3×10-17,K θsp(Ag 2S)=2×10-49;K θ稳[Ag(NH 3)2+]=1.6×107,K θ稳[Ag(S 2O 3)23-]=2.9×1013。
(1)当 存在时,Ag +的氧化能力最强;(2)当 存在时,Ag 的还原能力最强。
11.24 电池(-)Cu|Cu + ‖Cu +,Cu 2+|Pt(+) 和 (-)Cu|Cu 2+,‖Cu +,Cu 2+|Pt(+)的反应均可写成Cu+Cu 2+=2Cu +,则此二电池的△rG θm ,E θ , K θ (填“相同”或“不同”)。
11.25 已知下列元素的电势图:E θA/V MnO 4- 1.70 MnO 2 1.23 Mn 2+IO 3- 1.20 I 0.54 I -当溶液的PH=0时,分别给出下列条件下高锰酸钾与碘化钾反应的化学方程式;(1) 碘化钾过量(2) 高锰酸钾过量11.26 已知E θ(Cu 2+/Cu)=0.337V ,K θsp[Cu(OH)2]=2.2×10-20,则Eθ[Cu(OH)2/Cu]=11.27 常用的两种甘汞电极分别是 (1) 、 (2) 。
其电极反应为 常温下两种甘汞电极的电极电势大小次序为 。
11.28 在Fe3++e -=Fe 2+电极反应中,加入Fe 3+的络合剂F -,则使电极电势的数值 、在Cu 2++ e -=Cu +电极反应中,加入Cu + 的沉淀剂I -可使其电极的数值 。
11.29 向红色的Fe(SCN)2+溶液中加入Sn 2+后溶液变为无色,其原因是 。
11.30 已知,E θ(Fe 3+/Fe 2+)=0.77V ,Fe(CN)63-的稳定常数为1×1042,Fe(CN)64-的稳定常数为1×1035。
则E θ[Fe(CN)63-/Fe(CN)64-]值为 V三、计算题1 (1)写出以下电池的电极反应、电池反应方程式,并计算电池电动势。
5-3222Pt,H (110Pa)|HAc(0.1mol dm )||KCl(Hg Cl |Hg ⨯⋅饱和), (2)写出下列化学反应的原电池表达式,并计算原电池电动势。
2+2-+3+3+2726Fe Cr O 14H 2Cr 6Fe 7H O ++==++ 解:(1)负极反应:-2H + 2Ac == 2HAc 2e + 正极反应:-22Hg Cl + 2e == 2Hg + 2Cl电池放电总反应:--222H + 2Ac + Hg Cl == 2HAc + 2Hg + 2Cl+-5HAc == H + Ac 1.810Ka -=⨯平衡时 0.1 x x+3[H ] 1.3410x -==⨯ ++22220.059[H ]ε = (Hg Cl /Hg) (H /H ) = 0.2415 - (0+lg ) = 0.411V 2pH ϕϕ- (2)2+3+2-3++27(-)(Pt) | Fe , Fe || Cr O , Cr ,H | (Pt)(+)2-3+2+27ε(Cr O )(Fe /Fe ) 1.330.770.56V φφφϕϕ=-=-= 2 已知+-1[H ]=1.0mol L ⋅时,锰的元素电位图(/V ϑϕ): 0.564 2.260.95 1.51-1.18--23+2+442MnO MnO MnO Mn Mn Mn −−−→−−−→−−→−−→−−−→ (1)指出哪些物质在酸性溶液中会发生歧化反应;(2)求-2+4MnO /Mn ϑϕ;(3)写出用电对2+Mn /Mn 与标准氢电极组成原电池的电池符号及该电池的自发反应的方程式。
解:能发生歧化反应的条件是0ϑϑϕϕ->右左。
(1)2+4MnO 与3+Mn ; (2)-2+4MnO /Mn (0.564 2.2620.951 1.511)/5 1.51(V)ϑϕ=+⨯+⨯+⨯=(3)2++-12Mn | Mn || H (1mol L ) | H (100kPa)Pt ⋅, + 2+ 2Mn + 2H Mn + H ==↑。