质粒克隆的菌株
- 格式:doc
- 大小:13.50 KB
- 文档页数:2

JM109,DH5a,BL21这些感受态有何区别1:DH5a菌株DH5a是一种常用于质粒克隆的菌株。
E.coli DH5a在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F-,φ80dlacZΔM15,Δ(lacZYA-argF)U169,deoR,recA1,endA1,hsdR17(rk-,mk+),phoA,supE44,λ-,thi-1,gyrA96,relA12:BL21(DE3) 菌株该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
T7噬菌体RNA聚合酶位于λ 噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F-,ompT,hsdS(rBB-mB-),gal,dcm(DE3)3:BL21(DE3) pLysS菌株该菌株含有质粒pLysS,因此具有氯霉素抗性。
PLysS含有表达T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F-,ompT hsdS(rBB-mB-),gal,dcm(DE3,pLysS ,Camr4:JM109菌株该菌株在使用pUC系列质粒载体进行DNA转化或用M13 phage载体进行转染时,由于载体DNA产生的LacZa多肽和JM09编码的LacZΔM15进行α-互补,从而显示β-半乳糖苷酶活性,由此很容易鉴别重组体菌株基因型:recA1,endA1,gyrA96,thi-1,hsdR17,supE44,relA1,Δ(lac-proAB)/F’5:TOP10菌株该菌株适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
基因型:F- ,mcr AΔ(mrr-hsd RMS-mcrBC),φ80 ,lacZΔM15,△lacⅩ74,recA1 ,araΔ139Δ(ara-leu)7697,galU ,galK ,rps,(Strr) endA1,nupG6:HB101菌株该菌株遗传性能稳定,使用方便,适用于各种基因重组实验基因型:supE44,hsdS20(rB-mB-),recA13,ara-14,proA2,lacY1,galK2,rpsL20,xyl-5,mtl-1,leuB6,thi-1M110或SCS110大多数大肠杆菌菌株中含有Dam甲基化酶和Dcm甲基化酶,前者可以在GA TC序列中腺嘌呤N-6位上引入甲基,后者在CCA/TGC序列的第一个胞嘧啶C-5位置上引入甲基。

在科研实验中,为了获得纯的重组质粒DNA,需要允许外源DNA分子进入的细胞。
经过一些特殊方法(电击法、CaCl2法)等处理后,细胞膜的通透性发生了暂时性的改变,成为能允许外源DNA分子进入的细胞,即感受态细胞。
基本制备步骤1.从37℃培养16-20 h的平板中挑取一个单菌落(直径2-3 mm),转到一个含有100 ml LB或SOB培养基的1L烧瓶中。
于37℃剧烈振摇培养3 h。
一般经验,1 OD600约含有大肠杆菌DH5α 109 个/mL。
2.将细菌转移到一个无菌、一次性使用的、用冰预冷的50 ml聚丙烯管中,在冰上放置10 min,使培养物冷却至0℃。
3.于4℃用Sorvall GS3特头(或与之相当的转头)以4 100 r/min离心10 min,以回收细胞。
4.倒出培养液,将管倒置1 min以使最后的痕量培养液流尽。
5.每50 ml初始培养液用30 ml预冷的0.1 mol/LCaCl2-MgCl2溶液(80 mmol/L MgCl2,20 mmol/L CaCl2)重悬每份细胞沉淀。
6.于4℃用Sorvall GS3转头(或与之相当的转头)以41 00 r/min离心10 min,以回收细胞。
7.倒出培养液,将管倒置1 min以使最后的痕量培养液流尽。
8.每50 ml初始培养物用2 ml用冰预冷的0.1 mol/L CaCl2(或TFB)重悬每份细胞沉淀。
9.此时,可以用新鲜制备的感受态细胞直接做转化实验,也可以将细胞冻存于- 70℃。
洁净是最重要的~无菌都无所谓,在操作台上可正常操作。
离心力要注意不要超过2500g,建议1500-2000g 5min。
涂板要注意,不要觉得不匀而多次反复。
轻轻在平板上带一下感觉板上大部分地方走过即可,特别在冰箱中保存过或在温箱中温浴2小时以上的板。
涂完后建议空气晾干(20-30分钟)这样会减少卫星菌落出现。
预冷是必要的。
整个过程的低温也并非特别重要,只要注意就行了,我在去残液时经常在室温倒置1min,对感受态效率提高有帮助,第一次多加一点缓冲液,我经常加至20ml,效果不错。

1:DH5a菌株(DH5a 做转化首选,因为它有蓝白斑筛选;top10 克隆首选,因为他的质粒拷贝高且稳定)DH5a是一种常用于质粒克隆的菌株。
E.coli DH5a在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F-,φ80dlacZΔM15,Δ(lacZYA-argF)U169,deoR,recA1,endA1,hsdR17(rk-,mk+),phoA,supE44,λ-,thi-1,gyrA96,relA12:BL21(DE3) 菌株该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
T7噬菌体RNA聚合酶位于λ 噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F-,ompT,hsdS(rBB-mB-),gal,dcm(DE3)3:BL21(DE3) pLysS菌株该菌株含有质粒pLysS,因此具有氯霉素抗性。
PLysS含有表达T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F-,ompT hsdS(rBB-mB-),gal,dcm(DE3,pLysS ,Camr4:JM109菌株该菌株在使用pUC系列质粒载体进行DNA转化或用M13 phage载体进行转染时,由于载体DNA产生的LacZa多肽和JM09编码的LacZΔM15进行α-互补,从而显示β-半乳糖苷酶活性,由此很容易鉴别重组体菌株基因型:recA1,endA1,gyrA96,thi-1,hsdR17,supE44,relA1,Δ(lac-proAB)/F’[traD36,proAB+,lacIq,lacZΔM15]5:TOP10菌株该菌株适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
基因型:F-,mcrAΔ(mrr-hsd RMS-mcrBC),φ80 ,lacZΔM15,△lac Ⅹ74,recA1 ,araΔ139Δ(ara-leu)7697,galU ,galK ,rps,(Strr) endA1,nupG6:HB101菌株该菌株遗传性能稳定,使用方便,适用于各种基因重组实验基因型:supE44,hsdS20(rB-mB-),recA13,ara-14,proA2,lacY1,galK2,rpsL20,xyl-5,mtl-1,leuB6,thi-17:M110或SCS110大多数大肠杆菌菌株中含有Dam甲基化酶和Dcm甲基化酶,前者可以在GATC序列中腺嘌呤N-6位上引入甲基,后者在CCA/TGC序列的第一个胞嘧啶C-5位置上引入甲基。

全国免费电话:400-818-1148TOP10 感受态细胞Cat. No. JH0102-3保存:-80℃组分说明产品简介本产品是大肠杆菌 TOP10 菌株经特殊工艺处理得到的感受态细胞,可用于 DNA 的热击转化。
TOP10 是一种常用于质粒克隆的菌株,其 φ80lacZΔM15 基因产物可与载体编码的β-半乳糖苷酶氨基端实现α互补,可用于蓝白斑筛选。
使用 pUC19质粒检测,转化效率可达 108,适用于高效的质粒 DNA 克隆并能保证高拷贝质粒的稳定复制。
注意事项1.转化所有步骤均在无菌条件下操作。
2.感受态细胞应在-80℃下保存,不可多次冻融和放置时间过长,以免降低感受态细胞的转化效率。
3.包装中有0.1 ng/μl 的pUC19DNA ,供对照试验使用。
操作步骤1.取感受态细胞置于冰浴中。
一次转化感受态细胞的建议用量为50-100 μl ,可以根据实际情况分装使用。
以下实验以100 μl 感受态细胞为例。
2.待感受态细胞融化后,向感受态细胞悬液中加入目的DNA (根据实际情况加入适量的DNA ,通常100 μl 感受态细胞能够被1 ng 超螺旋质粒DNA 所饱和),用移液器轻轻吹打混匀,冰浴30分钟。
3.42℃热击90秒,迅速将离心管转移到冰浴中,冰上静置2-3分钟。
4.向每个离心管中加入900 μl 无菌的SOC 或LB 培养基(不含抗生素),混匀后置于37℃摇床,150 rpm 振荡培养45分钟使菌体复苏。
5.取100 μl 已转化的感受态细胞,加到含相应抗生素的SOC 或LB 固体琼脂培养基上,用无菌的涂布棒将细胞均匀涂开,直至干燥,倒置平板,37℃培养12-16小时。
注意:1) 涂布用量可根据具体实验调整。
若转化的DNA 总量较多,可取少量转化产物涂布平板;若转化的DNA 总量较少,可取200-300 μl 转化产物涂布平板。
若预计的克隆数较少,可通过离心(4,000 rpm ,2分钟)后吸除部分培养液,悬浮菌体后将其涂布于平板中。

大肠杆菌DH5α感受态细胞转化率的改进桓明辉摘要:针对实验材料E.coli DH5α,对该茵株在不同生长时期的转化效率进行测定,确立了一个能制备高转化率感受态细胞的实验方案。
结果表明:在细茵的生长繁殖过程中,其转化率有很大变化;结果:得到了E.coil DH5α茵株制备感受态细胞的最佳条件。
关键词:大肠杆茵;感受态;转化率DH5a是一种常用于质粒克隆的菌株。
E.coli DH5a在使用pUC 系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补,可用于蓝白斑筛选鉴别重组菌株。
感受态细胞的制备和转化是分子生物学实验室频繁使用的一项重要的常规操作。
对细菌而言,为达到高效转化,活细胞数务必少于l08细胞/m1。
对于大多数E.coli来说,相当与OD600为0.4左右,但由于转化是一个很复杂的过程,具体的作用机理仍在探究中。
有文献指出[1],细菌的最佳感受态细胞制备期对于不同菌株是不同的,并不一定都是在活细胞浓度为l08细胞/ml的时候最适宜,有必要针对所使用的菌株确定其最佳转化条件。
1 材料与方法1.1 材料与试剂菌株与质粒:E.coli DH5α,pUC18质粒由本实验室保存。
X-gal,IPTG,LB培养基,氨苄青霉素溶液,0.1 mol/L CaCl2溶液,均按《分子克隆实验指南》的要求配制。
1.2 方法1.2.1大肠杆菌生长情况的测定:从平板上挑取单个菌落(直径2~3 mm)到含有30ml LB培养基的锥形瓶中,37℃下250 r/min培养过夜。
取出0.3 ml培养物到含有l5 ml LB培养基的摇菌试管中,继续振荡培养,每隔20 min 取出一支摇菌试管,放于冰箱.统一测定菌液的OD600,绘制生长曲线。
选取几个不同时相的菌液倍比稀释从lO-1~lO-6,各取0.1 ml 稀释液涂布LB平板培养基,37℃正向培养1 h后,倒置培养l2~16 h。
每个稀释度铺3个平板,计数,作OD600一活菌细胞浓度图。

大肠杆菌生产质粒过程1.引言1.1 概述概述大肠杆菌(Escherichia coli)是一种常见的革兰氏阴性杆菌,广泛存在于自然界中,尤其是在人和动物的消化系统中。
由于其较高的生长速度和容易培养的特性,大肠杆菌成为了许多生物学研究和工业生产中的重要模式生物。
质粒是一种小型的环状双链DNA分子,在细菌中经常出现并进行自复制。
质粒可以通过转化或转染等方式在细菌中进行稳定复制,从而传递和保守一些重要的基因信息。
在大肠杆菌中,质粒的产生是其中一个重要的生物过程。
本文旨在探讨大肠杆菌生产质粒的过程,从大肠杆菌的生物特性和质粒的定义与功能入手,详细分析大肠杆菌生产质粒的重要性以及影响其生产过程的关键因素。
通过对大肠杆菌生产质粒过程的研究,我们可以更好地理解质粒的作用机制,为进一步优化和应用质粒在工业生产和基因工程中提供理论指导和实践经验。
在本文的后续章节中,我们将逐步展开对大肠杆菌和质粒的相关讨论,并且重点分析大肠杆菌生产质粒的重要性和影响质粒生产过程的关键因素。
最后,我们将总结得出结论,并对未来可能的研究方向进行展望。
通过本文的研究,我们希望能够更深入地了解大肠杆菌生产质粒的机制,为质粒的开发和应用提供更多的理论和实践支持,进一步推动生物科学和生物工程的发展。
1.2文章结构1.2 文章结构本文将按照以下顺序进行介绍大肠杆菌生产质粒的过程及其相关内容:1. 引言部分将提供对整篇文章的概述,介绍大肠杆菌生产质粒的背景和意义,以及本文的目的和结构。
2. 正文部分将包括两个主要部分:2.1 大肠杆菌的生物特性:这一部分将详细介绍大肠杆菌的特性,包括其生长环境、生理特征以及在科学研究和实际应用中的重要性。
通过对大肠杆菌的深入了解,读者将更好地理解其在质粒生产过程中的应用。
2.2 质粒的定义与功能:质粒是一种在细胞内自主复制的小型环状DNA分子,具有重要的研究和应用价值。
本部分将介绍质粒的定义、结构和功能,重点讨论其在基因工程和生物制药中的应用,以及大肠杆菌在质粒生产中所起的关键作用。

大肠杆菌克隆菌株TOP10和DH5α的比较大肠杆菌克隆菌株是一种经过基因工程改造的细菌,可以用于转化和扩增外源DNA,如质粒、文库或表达载体。
不同的克隆菌株具有不同的特性,如转化效率、抗性、突变、表达水平等。
本文将比较两种常见的大肠杆菌克隆菌株:TOP10和DH5α,分析它们的优缺点和价格。
TOP10的优缺点TOP10是一种来源于大肠杆菌K12的菌株,具有mcr/mrr突变,可以克隆甲基化的DNA,如真核基因组DNA。
它的基因型如下:•Top10:F- mcrA Δ(mrr-hsdRMS-mcrBC) φ80lacZΔM15 ΔlacX74 recA1 araD139 Δ(ara-leu)7697 galU galK rpsL (StrR) endA1 nupGTOP10的优点主要有以下几个方面:•高转化效率:TOP10具有高达10^9 cfu/µg DNA的转化效率,这意味着它可以获得更多的重组菌株,提高克隆的成功率。
•低突变率:TOP10具有recA1突变,可以抑制同源重组,保持质粒的序列完整性。
•高稳定性:TOP10具有endA1突变,可以阻断内切核酸酶的表达,减少质粒DNA的降解。
它还可以在不含抗生素的培养基中维持质粒的复制。
•广泛的耐药性:TOP10具有多种抗性基因,如rpsL (StrR)、nupG等,可以使用多种抗生素进行筛选。
•高数据一致性:TOP10具有高度的基因组稳定性和质粒保留性,可以保证实验的可重复性和可靠性。
TOP10的缺点主要有以下几个方面:•高成本:TOP10的价格相对较高,可能超出一些实验室的预算。
•低表达水平:TOP10不适合用于蛋白表达,因为它缺乏一些必要的表达因子,如DE3溶原菌、T7 RNA聚合酶等。
•低兼容性:TOP10不适合用于一些特殊的载体,如含有重复序列的慢病毒载体和其它逆转录病毒载体,因为它可能会发生质粒的重组或缺失。
DH5α的优缺点DH5α是一种由Messing在1975年从大肠杆菌K12菌株中构建而成的菌株,具有mcr/mrr突变,可以克隆甲基化的DNA,如真核基因组DNA。

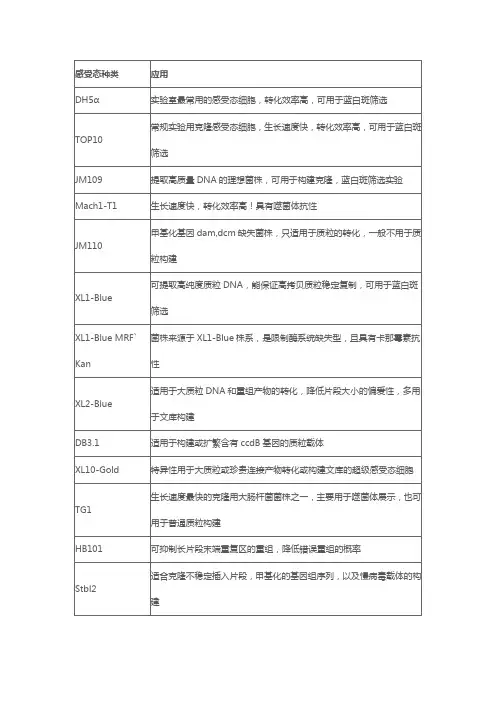
菌株名称说明JM109甘油菌,常规质粒制备的宿主菌,可进行蓝白斑筛选DH5a甘油菌,常规质粒制备的宿主菌,可进行蓝白斑筛选XL1-Blue甘油菌,常规质粒制备的宿主菌,可进行蓝白斑筛选,生长速度稍慢,容易制备感受态细胞XL10-gold甘油菌,常规质粒制备的宿主菌,可进行蓝白斑筛选,更适合大载体的高效转化,生长速度快Stbl3甘油菌,常规质粒制备的宿主菌,可进行蓝白斑筛选,对于不稳定的片段克隆效果好一些常见大肠杆菌菌株的基因型1:DH5a 菌株常用于质粒克隆的菌株。
使用pUC 系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可基因型:F-,φ80dlacZΔM15,Δ(lacZYA-argF)U169,deoR ,recA1,endA1,hsdR17(rk-,mk+),phoA ,sup 2:BL21(DE3) 菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET 系列)的基因。
T7噬菌体RNA 聚合酶位于λ 噬菌体基因型:F-,ompT , hsdS (rBB-mB -),gal , dcm (DE3)3:BL21(DE3) pLysS 菌株该菌株含有质粒pLysS ,因此具有氯霉素抗性。
PLysS 含有表达T7溶菌酶的基因,能够降低目的基因的背景表达基因型:F-,ompT hsdS (rBB-mB -),gal , dcm (DE3,pLysS ,Camr4:JM109菌株该菌株在使用pUC 系列质粒载体进行DNA 转化或用M13 phage 载体进行转染时,由于载体DNA 产生的LacZa 多肽基因型:recA1,endA1,gyrA96,thi -1,hsdR17,supE44,relA1,Δ(lac -proAB )/F’[traD36,proAB+,5:TOP10菌株该菌株适用于高效的DNA 克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
基因型:F- ,mcrAΔ(mrr-hsd RMS-mcrBC), φ80 ,lacZΔM15,△lac Ⅹ74, recA1 ,araΔ139Δ(ara-leu)76976:HB101菌株该菌株遗传性能稳定,使用方便,适用于各种基因重组实验基因型:supE44,hsdS20(rB-mB -),recA13,ara -14,proA2,lacY1,galK2,rpsL20,xyl-5,mtl-1,l7:Top10F'菌株带lacIq ,需加IPTG 诱导表达克隆于lac 启动子后的外源基因,用于蓝白斑筛选时,需加入IPTG 和 X-Gal 。
DH5α:DH5α菌株是实验室最常用的感受态细胞。
缺失核酸内切酶 (endA),提高了质粒DNA的产量和质量;重组酶缺陷型 (recA)减少插入片段的同源重组概率,保证了插入DNA 的稳定性;lacZΔM15的存在使DH5α可用于蓝、白斑筛选。
DH5α感受态细胞经特殊工艺制作,pUC19质粒检测转化效率>5×108 cfu/μg DNA。
TOP10:TOP10菌株来源于MC1061菌株,是目前实验室最常用的感受态细胞之一,基因型与DH10B高度类似(DH10B为gal E15型,而TOP10为gal U型)。
TOP10生长速度快(比DH5α快,但比Mach1-T1生长速度慢),10小时可见克隆,rec A1和end A1的突变有利于插入DNA的稳定和高纯度质粒DNA的提取。
可用于构建克隆,蓝白斑筛选等实验。
TOP10感受态细胞经特殊工艺制作,pUC19质粒检测转化效率>5×108cfu/μg DNA。
JM109:JM109菌株来源于E.coli K strain,是提取高质量DNA的理想菌株,rec A1和end A1的突变有利于克隆DNA的稳定和高纯度质粒DNA的提取。
携带hsd R17基因型背景,使得异源DNA不被内源核酸酶系统降解。
laqI q ZΔM15的存在使JM109可用于构建克隆,蓝白斑筛选实验;JM109感受态细胞经特殊工艺制作,pUC19质粒检测转化效率可达109cfu/μg DNA。
Mach1-T1:Mach1-T1菌株由野生型non-K-12 E. Coli W菌株改造而来,是目前生长速度较快的感受态细胞之一,在平板上8h可见克隆,缺失核酸内切酶(end A),提高了质粒DNA的产量和质量;重组酶缺陷型(rec A1398)减少插入片段的同源重组概率,保证了插入DNA的稳定性;lacZΔM15的存在使Mach1-T1可用于蓝、白斑筛选;tonA突变赋予Mach1-T1菌株对噬菌体T1和T5的抗性。

几种常用的感受态细胞
DH5α
具有α-互补性,便于鉴别重组体菌株。
该菌株可用于制作基因库、进行亚克隆等,由于该菌株同时具有deoR 变异,可以作为较大质粒的宿主菌使用。
Stbl3
常规质粒制备的宿主菌,可进行蓝白斑筛选。
该菌株是复制慢病毒载体系统推荐使用的菌株,对慢病毒载体等较大的质粒转化的效果好,有效减低错误重组的可能性。
Top10
一种用于培养质粒平板和粘粒平板的大肠杆菌菌株,可用于蓝白斑筛选。
该菌株适用于DNA 克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
2T1
具有四环素抗性基因(TetR);自身的ton A基因型能够阻止噬菌体T1和T5的感染;形成菌落时间较其他菌株快(约12小时),适合构建高质量的基因组文库。
BL21(DE3)
经过特殊改造的专门用来表达T7启动子启动基因的表达用大肠杆菌菌株。

常用大肠杆菌感受态JM109,DH5a,BL21的区别1:DH5a菌株DH5a是一种常用于质粒克隆的菌株。
E.coli DH5a在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F-,φ80dlacZΔM15,Δ(lacZYA-argF)U169,deoR,recA1,endA1,hsdR17(rk-,mk+),phoA,supE44,λ-,thi-1,gyrA96,relA12:BL21(DE3) 菌株该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
T7噬菌体RNA聚合酶位于λ 噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F-,ompT, hsdS(rBB-mB-),gal, dcm(DE3)3:BL21(DE3) pLysS菌株该菌株含有质粒pLysS,因此具有氯霉素抗性。
PLysS含有表达T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F-,ompT hsdS(rBB-mB-),gal, dcm(DE3,pLysS ,Camr4:JM109菌株该菌株在使用pUC系列质粒载体进行DNA转化或用M13 phage载体进行转染时,由于载体DNA产生的LacZa多肽和JM09编码的LacZΔM15进行α-互补,从而显示β-半乳糖苷酶活性,由此很容易鉴别重组体菌株基因型:recA1,endA1,gyrA96,thi-1,hsdR17,supE44,relA1,Δ(lac-proAB)/F’[traD36,proAB+,lacIq,lacZΔM15]5:TOP10菌株该菌株适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
基因型:F- ,mcrAΔ(mrr-hsd RMS-mcrBC),φ80 ,lacZΔM15,△lacⅩ74,recA1 ,araΔ139Δ(ara-leu)7697, galU ,galK ,rps, (Strr) endA1, nupG6:HB101菌株该菌株遗传性能稳定,使用方便,适用于各种基因重组实验基因型:supE44,hsdS20(rB-mB-),recA13,ara-14,proA2,lacY1,galK2,rpsL20,xyl-5,mtl-1,leuB6,thi-17:M110或 SCS110大多数大肠杆菌菌株中含有Dam甲基化酶和Dcm甲基化酶,前者可以在GATC序列中腺嘌呤N-6位上引入甲基,后者在CCA/TGC序列的第一个胞嘧啶 C-5位置上引入甲基。
1:DH5a 菌株DH5a 是一种常用于质粒克隆的菌株。
E.coli DH5a在使用 pUC 系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F-, φ80dlacZΔM15, Δ(lacZYA-argFU169, deoR , recA1, endA1,hsdR17(rk-, mk+, phoA , supE44, λ-, thi-1, gyrA96, relA12:BL21(DE3 菌株该菌株用于高效表达克隆于含有噬菌体 T7启动子的表达载体(如 pET 系列的基因。
T7噬菌体 RNA 聚合酶位于λ 噬菌体 DE3区,该区整合于 BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F-, ompT , hsdS (rBB-mB -, gal , dcm (DE33:BL21(DE3 pLysS菌株该菌株含有质粒 pLysS ,因此具有氯霉素抗性。
PLysS 含有表达 T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F-, ompThsdS (rBB-mB -, gal , dcm (DE3, pLysS , Camr4:JM109菌株该菌株在使用 pUC 系列质粒载体进行 DNA 转化或用 M13 phage载体进行转染时,由于载体 DNA 产生的 LacZa 多肽和 JM09编码的LacZΔM15进行α-互补 ,从而显示β-半乳糖苷酶活性,由此很容易鉴别重组体菌株基因型 :recA1, endA1, gyrA96, thi -1, hsdR17, supE44, relA1, Δ(lac -proAB/F’[traD36, proAB+, lacIq , lacZΔM15]5:TOP10菌株该菌株适用于高效的 DNA 克隆和质粒扩增 ,能保证高拷贝质粒的稳定遗传。
重组质粒的转化实验报告
一、实验目的
本实验旨在构建重组质粒,以提高转录和表达的效率。
二、实验原理
重组质粒技术是一种细胞分子遗传学技术,它可以将一种特定的DNA片段插入另一种特定的质粒中,以改变质粒的表达模式。
它的基本原理是利用酶切,将特定的DNA片段插入质粒中,然后将其复制到另一个质粒中,从而改变质粒的表达模式。
三、实验步骤
1. 提取质粒:首先,使用适当的抗性菌株(如E.coli)提取质
粒DNA,使用特定的质粒提取试剂提取质粒DNA;
2. 克隆DNA片段:使用PCR技术,将要插入质粒中的DNA
片段克隆到另一个质粒中;
3. 制备重组质粒:将克隆的DNA片段插入质粒中,使用特定
的酶切试剂,完成重组质粒的制备;
4. 测序:使用测序仪,测试重组质粒的序列,以确保重组质粒的正确性。
四、实验结果
1. 质粒提取:成功提取质粒,提取的质粒DNA纯度达到99%以上;
2. 克隆DNA片段:成功克隆目标DNA片段,PCR扩增结果与理想结果一致;
3. 重组质粒制备:重组质粒制备成功,酶切结果与理想结果一致;
4. 测序:重组质粒的序列与理想序列一致,证明重组质粒制备成功。
五、结论
本次实验成功地构建了重组质粒,从。
大肠杆菌BL2和DH5α
的区别
DH5a是一种常用于质粒克隆的菌株.E.coli DH5a在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F—,φ80dlacZΔM15,Δ(lacZYA-argF)U169,deoR,recA1,endA1,hsdR17(rk-,mk+),phoA,supE44,λ-,thi-1,gyrA96,relA1
BL21(DE3) 菌株
该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
T7噬菌体RNA 聚合酶位于λ噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
...谢阅...
基因型:F-,ompT,hsdS(rBB-mB-),gal,dcm(DE3)
BL21(DE3) pLysS菌株
该菌株含有质粒pLysS,因此具有氯霉素抗性。
PLysS含有表达T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F—,ompT hsdS(rBB-mB—),gal, dcm(DE3,pLysS ,Camr
最直接的区分就是克隆菌株和表达菌株的区别
大肠杆菌DH5α做克隆或保存质粒用,BL21用来做原核表达用。
当然也有人用DH5α做表达也能表达出来。
也有人用BL21保存质粒的,但时间久了,质粒容易丢失。
你要是做原核表达的话,应该会现用前者克隆得到重组质粒,转化入后者进行表达
...谢阅...
2 / 2...谢阅...。
克隆质粒的复制子以及在宿主菌的拷贝数质粒,其复制子以及在E. coli宿主内的拷贝数质粒类型复制子拷贝数pUC18 pMB1* 500-700pKS(-) ColE1 300-500pBBR1系列载体 pBBR1 30-40pBAD322,pET等系列载体 pMB1-rop 15-20pACYC系列载体 p15A 10-15pSC101衍生载体 pSC101 5-10~15 (pir宿主菌如BW25141) pKD4, pR6KMCS R6K ~250 (pir-116宿主菌如BUN20) pJB866 RK2-trfA (oriV) mediumopBADTcTypeG pMB1 120 copies at 37C pECBAC1 oriS 1~2Genome One copy拷贝数是指每个细胞中有多少个质粒DNA的分子,质粒的拷贝数直接决定了:1. 从菌液中获得质粒DNA的量。
拷贝数和量成正比关系2. 以之为载体时转化子的数目。
拷贝数的高低和转化子的多少成正相关,是否线性不确切3. 筛选用抗生素的浓度。
拷贝数的高低和抗生素的使用浓度成正相关,如100,g/ml的氨苄青霉素筛选DH10B/pKS(-),也可以用50,g/ml;50,g/ml筛选DH10B/pBAD322;15,g/ml筛选整合至基因组上的抗性基因。
当菌株的筛选和培养出现非预期的情形,适当地调整抗生素的浓度就非常重要。
TaKaRa MiniBEST Plasmid Purification Kit Ver.2.0 (Code:DV801A)提到4 ml的过夜培养的菌液中可纯化得到20 ,g质粒,以此推断,1.5ml 过夜培养含高拷贝质粒如pKS(-)的菌液中可得到多于5 ,g质粒,如溶于50 ,l TE/ddHO,则浓度约100ng/,l。
可参照此标准,来根据2不同拷贝数的质粒来推算本实验需要多少菌体、所提取质粒的量,再通过电泳后与分子量标准的比较来进一步估算出的DNA浓度。
用您的学识和经验帮助他人答疑解惑
黄瓜基因组已经测序完成,到哪可以找到啊..
畸胎瘤细胞培养方法
细胞免疫荧光固定后荧光淬灭
分子生物学几道问题求详解
如何分析测序结果,载体如何去除?
测序结果载体去除
ELISA阳性阴性值偏低
目的基因克隆后,白色菌落能够保存吗?如..
Takara和天根的载体那个比较好?
提RNA进行RT-PCR,RACE
1:DH5a菌株
DH5a是一种常用于质粒克隆的菌株。
E.coli DH5a在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F-,φ80dlacZΔM15,Δ(lacZY A-argF)U169,deoR,recA1,endA1,hsdR17(rk-,mk+),phoA,supE44,λ-,thi-1,gyrA96,relA1
2:BL21(DE3) 菌株
该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
T7噬菌体RNA聚合酶位于λ 噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F-,ompT,hsdS(rBB-mB-),gal,dcm(DE3)
3:BL21(DE3) pLysS菌株
该菌株含有质粒pLysS,因此具有氯霉素抗性。
PLysS含有表达T7溶菌酶的基因,能够降低目的基因的背景表达水平,但不干扰目的蛋白的表达。
该菌适合表达毒性蛋白和非毒性蛋白。
基因型:F-,ompT hsdS(rBB-mB-),gal,dcm(DE3,pLysS ,Camr
4:JM109菌株
该菌株在使用pUC系列质粒载体进行DNA转化或用M13 phage载体进行转染时,由于载体DNA产生的LacZa多肽和JM09编码的LacZΔM15进行α-互补,从而显示β-半乳糖苷酶活性,由此很容易鉴别重组体菌株
基因型:recA1,endA1,gyrA96,thi-1,hsdR17,supE44,relA1,Δ(lac-proAB)/F’[traD36,proAB+,lacIq,lacZΔM15]
5:TOP10菌株
该菌株适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
基因型:F- ,mcrAΔ(mrr-hsd RMS-mcrBC),φ80 ,lacZΔM15,△lacⅩ74,recA1 ,araΔ139Δ(ara-leu)7697,galU ,galK ,rps,(Strr) endA1,nupG
6:HB101菌株
该菌株遗传性能稳定,使用方便,适用于各种基因重组实验
基因型:supE44,hsdS20(rB-mB-),recA13,ara-14,proA2,lac Y1,galK2,rpsL20,xyl-5,mtl-1,leuB6,thi-1
M110或SCS110
大多数大肠杆菌菌株中含有Dam甲基化酶和Dcm甲基化酶,前者可以在GA TC序列中腺嘌呤N-6位上引入甲基,后者在CCA/TGC序列的第一个胞嘧啶C-5位置上引入甲基。
常用的菌株都会产生dam,dcm,从而受到甲基化的影响.
部分限制性内切酶对甲基化的DNA不能切割,如FbaI和MboI等,一般生物公司提供的内切酶说明中均有说明。
大多数酶切位点的甲基化不影响切割,而有些会影响,如XbaI, BclI等。
而且甲基化只发生在特定序列,以XbaI为例,只有在位点序列旁出现GA或TC,该XbaI位才会被甲基化。
而要解除这种限制修饰作用通常有两种方法:
(1)选用上述酶的同功酶,如Sau3AI,DNA识别切割位点与MboI相同;但不受甲基化影响;
(2)利用甲基化酶缺失的受体细胞进行DNA的制备,如E.coli JM110和链霉菌等,前者Dam和Dcm甲基化酶已敲出,而后者细胞内本就没有甲基化酶,从这些细胞中抽提的DNA 就能被上述酶切割。
E.coli JM110
要排除dam,dcm甲基化的影响,需要用特定的dam-,dcm-的菌株,如JM110
如果由JM110或SCS110等甲基化缺失的菌株产生的质粒,则不会被甲基化.。