09基础化学试卷A
- 格式:doc
- 大小:80.50 KB
- 文档页数:3


2009年普通高等学校招生全国统一考试理科综合能力测试I 卷化学部分一、选择题(本题共13小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)6.下列各组离子,在溶液中能大量共存、加入NaOH 溶液后加热既有气体放出又有沉淀生成的一组是A .Ba 2+、NO 3-、NH 4+、Cl -B .Ca 2+、HCO 3-、NH 4+、AlO 2-C .K +、 Ba 2+、 Cl -、 HSO 3-D .Mg 2+ 、NH 4+、SO 42-、K + 答案D【解析】离子共存。
A 项,加入NaOH 会与NH 4+ 产生NH 3,但没有沉淀;B 项NH 4+、HCO 3-都能与AlO 2-生成Al(OH)3 沉淀:NH 4++AlO 2-+H 2O === Al(OH)3↓+NH 3↑;HCO 3-+AlO 2-+H 2O === Al(OH)3↓+CO 32-。
C 项,OH -与HSO 3-生成SO 32 -、与Ba 2+可生成BaSO 3沉淀,但无气体。
D 项,OH -与NH 4+ 产生NH 3,与Mg 2+会产生Mg(OH)2沉淀,正确。
7.将15ml ,2mol/L Na 2CO 3溶液逐滴加入到40ml ,0.5mol/LMCl n 盐溶液中,恰好将溶液中的M n+离子完全沉淀为碳酸盐,则MCl n 中n 值是A. 4B. 3C. 2D. 1 答案B【解析】化学计算。
M 的化合价为+n ,根据电荷守恒:2M n+ ~M 2(CO 3)n ~ nCO 32 -2 n15×10-3×2 40×10-3×0.5 可得n=3,故选B 。
8.下列表示溶液中发生反应的化学方程式错误..的是 A .2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑B .2KMnO 4+HCOO K +KOH =K 2MnO 4+CO 2↑+H 2OC .MnO 2 + 4HCl(浓)△2 + Cl 2↑+ 2H 2OD .K 2Cr 2O 7+6FeSO 4+7H 2SO 4=Cr 2(SO 4)3+3 Fe 2(SO 4)3+K 2SO 4+7H 2O答案B【解析】氧化还原反应方程式正误判断,涉及有机氧化还原反应,主要考查产物及其存在形式、电子得失守恒。

装线订中国地质大学(武汉)考试出题专用纸 教务处制 试卷类别 [A] [B] 使用班级 031091-9 使用学期 2009下 任课教师 夏华 程国娥 教研室主任 审核签字(C)6. 不用惰性电极的电池反应是(A) H2 + Cl2 → 2HCl(aq) (B) Ce4++ Fe2+→ Ce3++ Fe3+(C) Ag++ Cl-→ AgCl(s) (D) 2Hg2++ Sn2++ 2Cl-→ Hg2Cl2+ Sn4+(D)7. 氢原子中3s, 3p, 3d, 4s轨道能量高低的情况为(A) 3s<3p<3d<4s (B) 3s<3p<4s<3d(C) 3s=3p=3d=4s (D) 3s=3p=3d<4s(D)8. 原子序数为19 的元素的价电子的四个量子数为(A) n=1, l=0, m=0, m s=+1/2(B) n=2, l=1, m=0, ms=+1/2(C) n=3, l=2, m=1, ms=+1/2(D) n=4, l=0, m=0, ms=+1/2 (A)9. 性质最相似的两个元素是(A) Zr 和Hf (B) Ru 和Rh(C) Mn 和Mg (D) Cu 和Cr(C)10. 18 电子构型的阳离子在周期表中的位置是(A) s和p区(B) p和d区(C) p和ds区(D) p,d和ds区(B)11. 在气态C2中, 最高能量的电子所处的分子轨道是(A) σ2p(B)π2p(C) σ*2p(D) π*2p(D)12. 下列各对物质中,分子间作用力最弱的是(A) NH3和PH3 (B) H2O和CO2(C) N2和O2(D) He和Ne(B)13.既能溶于Na2S又能溶于Na2S2的硫化物是(A) ZnS (B) As2S3(C) HgS (D) CuS(D)14.将K2MnO4溶液调节到酸性时, 可以观察到的现象是(A)紫红色褪去(B)绿色加深(C)有棕色沉淀生成(D)溶液变成紫红色且有棕色沉淀生成(A)15. 一级反应的半衰期与反应物初始浓度的关系是(A)无关(B)成正比(C)成反比(D)平方根成正比解得:根据题意n(NH3·H2O)=n(HCl),X=1.3L 总体积为3.3LK(K(AgBr)=5.0)计算原电池的)计算反应的和(=0.771V =0.5355V )。



1.化学与生活密切相关,下列有关说法正确的是A.维生素C 具有还原性,在人体内起抗氧化作用B.糖类、蛋白质、油脂属于天然高分子化合物C.煤经气化和液化两个物理变化过程,可变为清洁能源D.制作航天服维和用于光缆爱信的光导纤维都是新型无机非金属材料 【答案】A【解析】油脂不属于高分子化合物;煤的气化为煤与水蒸气反应生成水煤气,属于化学变化;聚酯纤维为有机材料。
【考点定位】本题考查化学基础知识以及基本概念,属于容易题。
2. 25 ℃时,浓度均为0.2 mol/L 的NaHCO 3和Na 2CO 3溶液中,下列判断不正确...的是 A.均存在电离平衡和水解平衡 B.存在的粒子种类相同 C.c (OH -)前者大于后者D.分别加入NaOH 固体,恢复到原温度,c(CO 3-3)均增大 4.下列叙述正确的是5.人体血液内的血红蛋白(11b)易与O 2结合生成HbO 2,因此具有输氧能力,CO 吸入肺中发生反应:CO+HbO 2O 2+HbCO,37 ℃时,该反应的平衡常数K=220. HbCO 的浓度达到HbO2溶液的0.02倍,导致人智力受损。
据此,下列结论错误的是 A.CO 与HbO 2反应的平衡常数K=22(O )(HbCO)(CO)(HbO )c c c cB.人体吸入的CO 越多,与血红蛋白结合的O 2越少C.当吸入的CO 与O 2浓度之比大于或等于0.02时,人的智力才会受损D.把CO 中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 【答案】C【解析】根据平衡常数以及氧气和一氧化碳的浓度的关系可得2201002)()(2=⨯CO c O c ,则52100.9)()(-⨯=O c CO c ,所以C 项错误。
根据勒夏特列原理判断B 和D 项正确。
【考点定位】本题考查了化学平衡以及计算的知识,属于中等难度题。
6.已知:2CO(g)+O 2(g)=2CO 2(g) ΔH=-566 kJ/mol Na 2O 2(s)+CO 2(g)=Na 2CO 3(s)+21O (g)2D.CO(g)与Na 2O 2(s)反应放出509 kJ 热量时,电子转移数为6.02×1023 【答案】C【解析】燃烧热的单位为kJ/mol ,图中表示的为2摩尔一氧化碳燃烧的能量变化,将题目所给的两个反应相加后可得,总反应为CO(g)+Na 2O 2(s)=Na 2CO 3;ΔH=-509kJ/mol 。

2009学年第一学期九年级 化学科期末测试题答案一、(每小题2分,40分)第Ⅱ卷 (非选择题,共60分)二、本题包括10小题(共40分)21、(4分)(1)O 5 H 2O CaFe 2O 3 (每空1分,书写不规范的不得分)22、(10分)(1) 氧气 (O 2)(1分) C + O 2点燃CO 2(2)二氧化碳(CO 2)(1分) CO 2 + Ca(OH)2 ═ CaCO 3↓ + H 2O(3)一氧化碳(CO )、氢气(H 2)(共1分,漏写或多写0分)CuO + CO△Cu + CO 2 CuO + H 2△2O(4)一氧化碳(CO)、甲烷(CH 4)(1分)2CO +2 O 2点燃2CO 2↑ CH 4 +2 O 2点燃CO 2 +2 H 2O(每个方程式1分,对应正确才得分;若化学式、配平、条件及箭头,错其中一样该方程式为0分) 23、(8分)(1)石油 天然气。
(各1分,共2分) 太阳能(或其他正确答案)(1分)(2)12 : 3 : 8 (1分) 2.4 (1分) (3)导管口不出现气泡; (1分)2CuO + C高温2Cu + CO 2 ↑(1分)(化学式、配平、条件及箭头,错其中一样该方程式为0分); 6(1分)24、(2分) ⑦⑧⑨(共2分,漏选或错选1个扣1分,至为0分,不出现负分) 25、(6分) (1) 吸附..和过滤..(共1分,漏写1 个0分) (2)分隔..石英沙和活性炭 (1分) (3)硬水(1分) (4)①检查装置的气密性........(1分)②防止加热时产生的暴沸..(1分) ③冷凝..水蒸气(1分) 26、(5分) (1)4P + 5O 2点燃2P 2O 5(1分)(化学式、配平、条件,错其中一样该方程式为0分)说明H 2空气中的氧气被消耗了..........,集气瓶内的压力降低.........,烧杯中的水进入到集气瓶, 液面从A 上升到B 。

可能用到的相对原子质量:Na 23 K 39 S 32 N 14 O 16 H 1 C 12 Mn 55 Ba 137 Cl 35.5 Cu 64 一、选择题(每小题只有一个选项符合题意,3分×7= 21分)1.下列物质中既能导电,又属于电解质的一组物质是()A.石墨、醋酸溶液、食盐晶体 B.熔融状态的KOH、熔融状态的NaClC.稀H2SO4、NaOH溶液、纯HNO3D.液氨、石灰水、水银2.从碘水中提取碘可以采用的方法是()A.萃取 B.沉淀 C.蒸馏 D.过滤3.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是()A.HCl B.Cl2 C.NH3D.NO4.把过量CO2通入下列溶液中,最终会有沉淀的是()A.CaCl2 B.Ca(OH)2C.Na2SiO3D.NaHCO35.美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难——石棉污染,使吸入石棉纤维者易患肺癌。
已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2Mg X Si Y O22(OH)2,X、Y的值分别为()A.5,8 B.8,3 C.3,8 D.5,56.下列物质只能作还原剂的是()A.S2- B.Fe2+ C.Fe3+ D.H +7.在无色溶液中,下列离子能大量共存的是()A.Na+、NH4+、NO3-、MnO4- B.Mg2+、SO42-、K+、Cl-C.K+ 、Cu2+、Cl-、Br- D.Ba2+、Na+、OH-、HCO3-二、选择题(每小题只有一个选项符合题意,5分×6= 30分)8.下列离子方程式中书写正确的是()A.铝与盐酸反应 Al + H+ ==Al3+ + H2↑B.硫酸铜与Ba(OH)2溶液反应 Cu2++ 2OH-== Cu(OH)2↓C.铁与FeCl3溶液反应 Fe + Fe3+ == 2Fe2+D.硝酸银溶液与氯化钠溶液反应 Ag++ Cl-== AgCl↓9.现有NaCl、MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl六种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是()A.浓NaOH B.AgNO3C.浓氨水D.H2SO410.右图装置可用于()A.加热NaHCO3制CO2B.Cu和稀HNO3反应制NOC.NH4Cl与浓Ca(OH)2溶液反应制NH3D.Cu和浓HNO3反应制NO211.下列除杂所选用的试剂及操作方法均正确的一组是()12.在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂与被氧化HCl的物质的量之比为()2009-2010学年度下学期09化学满分:100分时间:60分钟命题人:选项待提纯的物质选用的试剂操作方法A NaOH(Na2CO3)盐酸-B CO2(CO)CuO 加热C Fe (Al)稀硫酸过滤D CO2(HCl)Na2CO3溶液洗气水A.1∶10 B.1∶8 C.1∶5 D.1∶113.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能有①Cl2,②NO2,③CO2,④SO2,⑤HCl,⑥溴蒸气中的()A.①③④ B.①②⑤ C.②④⑤ D.①②⑥三、非选择题(共4小题, 49分。
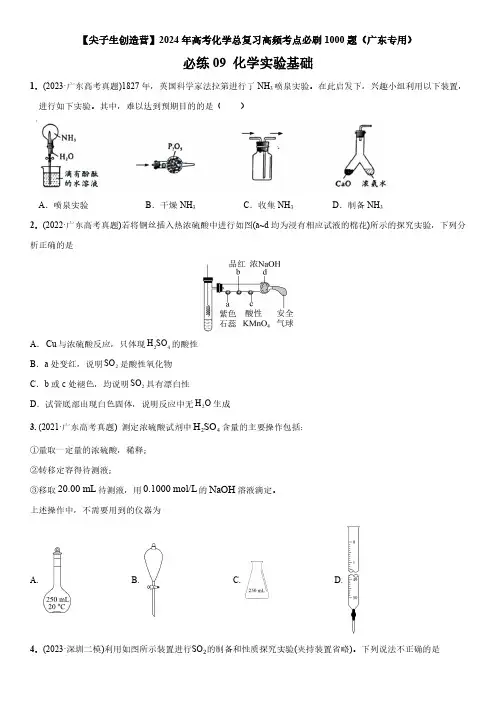
【尖子生创造营】2024年高考化学总复习高频考点必刷1000题(广东专用)必练09化学实验基础1.(2023·广东高考真题)1827年,英国科学家法拉第进行了NH3喷泉实验。
在此启发下,兴趣小组利用以下装置,进行如下实验。
其中,难以达到预期目的的是()A.喷泉实验B.干燥NH3C.收集NH3D.制备NH3 2.(2022·广东高考真题)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是H SO的酸性A.Cu与浓硫酸反应,只体现24SO是酸性氧化物B.a处变红,说明2SO具有漂白性C.b或c处褪色,均说明2D.试管底部出现白色固体,说明反应中无2H O生成H SO含量的主要操作包括:3.(2021·广东高考真题)测定浓硫酸试剂中24①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00mL待测液,用0.1000mol/L的NaOH溶液滴定。
上述操作中,不需要用到的仪器为A. B. C. D. 4.(2023·深圳二模)利用如图所示装置进行SO2的制备和性质探究实验(夹持装置省略)。
下列说法不正确的是A.固体X可为CuB.若试剂Y为氢硫酸,则试管中可产生淡黄色沉淀C.为证明SO2具有还原性,试剂Y可为酸性KMnO4溶液D.该装置中试管口应塞一团浸有NaOH溶液的棉团5.(2023·深圳一模)化学实验是化学探究的一种重要途径。
下列有关实验的描述正确的是A.用湿润的蓝色石蕊试纸检验NH3B.中学实验室中,可将未用完的钠放回原试剂瓶C.进行焰色试验时,可用玻璃棒替代铂丝D.酸碱中和滴定实验中,应先用待测液润洗锥形瓶6.(2023·韶关一模)在实验室采用如图装置制备气体,不合理的是A B C D制备Cl2制备NH3制备CO2制备O27.(2023·韶关二模)利用下列装置(夹持装置略)进行实验,能达到实验目的的是C.制备并收集氨气D.制备并收集SO2 A.制备无水MgCl2B.制备溴苯并验证有HBr产生8.(2023·汕尾模拟)实验室制备并收集氨气,下列装置不能达到实验目的的是A.B.C.D.9.(2023·汕头一模)《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干”。

2009级基础化学理论考试A卷参考答案及评分细则一、填空题(每空1分,共30分)1、+141.5 kJ2、[Fe(CN)6]3-3、四硝基•(乙二胺)合钻(IH)酸铉;64、3d24s2 ; d; 4; IVB5、2 ;平面正方形6、胶粒带有相同的电荷;水合膜层的保护7、负极8、吸收光谱;物质对光的吸收定律9、反向渗透10、大;大11、E0(Cr2O727Cr3+) >E0(Fe3+/Fe2+) >E0(Sn4+/Sn2+); Cr2O72 ; Sn2+12、2; r = kC(A)213、总浓度;缓冲比;pKa+114、降低;不变;同离子效应15、5.6X10-U(1分)(1分) (1分) (1分)(1四、计算题(共30分) 1、(7 分)解:(1)根据吉布斯一亥姆霍兹公式A r G 0m (298K)=A r /f 0m (298K)- 7'A r 50m (298K) 而△rH 0m(298K) ^DB A^CB,!)=A f ^0m ((NH 2)2CO(s),298K)+A f ^0m (H 2O(l),298K) 一 △fH°m(CO2(g),298K)—2A f fl 0m (NH 3(g),298K) =-333.19+ (-285.83) - (-393.509) -2x (-46.11) =-133.29 (kJ mol 1)△梦m(298K) =2>B5®m(B,O= 50m ((NH 2)2CO(s),298K)+50m (H 2O(l),298K) -5®m(CO2(g),298K) - 25®m(NH3(g),298K) =104.60+69.91 — 213.74-2x (192.45) =-424.13( JK'-mol 1)故 △rG®m(298K) =-133.29kJ mor 1-298.15Kx(-424.13)xl0'3 kJ-K '-mol 1=一 6.84 kJ ・mo 「i<0 此温度时正向反应自发。
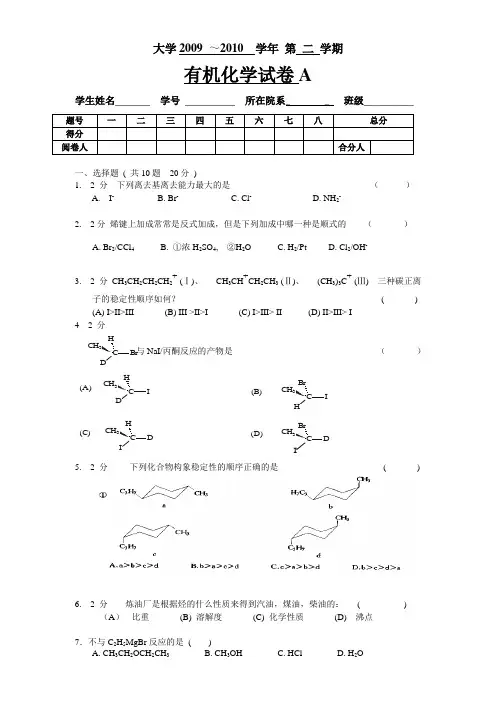
大学2009 ~2010 学年 第 二 学期有机化学试卷A学生姓名_______ 学号 __________ 所在院系_ _ 班级__________题号 一 二 三 四 五 六 七 八 总分 得分阅卷人合分人一、选择题 ( 共10题 20分 )1. 2 分 下列离去基离去能力最大的是 ( )A. I -B. Br -C. Cl -D. NH 2-2. 2分 烯键上加成常常是反式加成,但是下列加成中哪一种是顺式的 ( )A. Br 2/CCl 4B. ①浓H 2SO 4, ②H 2OC. H 2/PtD. Cl 2/OH - 3. 2 分 CH 3CH 2CH 2CH 2+ (Ⅰ)、 CH 3CH +CH 2CH 3 (Ⅱ)、 (CH 3)3C +(Ⅲ) 三种碳正离子的稳定性顺序如何? ( ) (A) I>II>III (B) III >II>I (C) I>III> II (D) II>III> I 4 2 分 与NaI/丙酮反应的产物是 ( )5. 2 分 下列化合物构象稳定性的顺序正确的是 ( )6. 2 分 炼油厂是根据烃的什么性质来得到汽油,煤油,柴油的: ( )(A ) 比重 (B) 溶解度 (C) 化学性质 (D) 沸点7.不与C 2H 5MgBr 反应的是 ( )A. CH 3CH 2OCH 2CH 3B. CH 3OHC. HClD. H 2O(D)I(C)(B)C D BrCH 3C D I H CH 3C IHBr CH 3(A)C I D HCH 3C BrD HCH 38. 2 分CH3BrHC2H5与CH3BrHH5C2一对化合物的相互关系是: ( )A. 相同化合物B. 对映异构体C. 非对映异构体D. 不同化合物9. 2 分从庚烷、1-庚炔、1,3-己二烯中区别出1-庚炔最简明的办法是采用: ()(A)Br2 + CCl4(B) Pd + H2(C) KMnO4,H+(D) AgNO3,NH3溶液10. 2 分能完成下列反应的试剂是:( )A. Ni,H2B. Lindlar Pd,H2C. Na,NH3(l)D. NaNH2二、填空题( 共20题40分)1. 2 分写出下面化合物的CCS名称:2. 2 分写出下面化合物的CCS名称:3. 2 分下面化合物的CCS名称是:4. 2分下列化合物中具有手性的是()5. 2分写出下面化合物的CCS名称:()6-20题写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
2009年普通高等学校招生统一考试理综试题化学部分(北京卷)学校_________ 班级__________ 姓名__________ 学号__________一、单选题1. 化学与人类生活密切相关。
下列说法正确的是( )A.苯酚有一定毒性,不能作消毒剂和防腐剂B.白磷着火点高且无毒,可用于制造安全火柴C.油脂皂化生成的高级脂肪酸钠,是肥皂的有效成分D.用食醋去处水壶中的水垢时所发生的是水解反应2. 下列叙述不正确的是()A.铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-D.工业上电解饱和食盐水的阳极反应: 2Cl--2e-=Cl2↑3. W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。
下列判断正确的是( )A.金属性:Y>ZB.氢化物的沸点:X>WC.离子的还原性:X>WD.原子及离子半径:Z>Y>X4. 甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。
甲是气态氢化物,在水中分步电离出两种阴离子。
下列推断合理的是A.某拿酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素5. 有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:①CH3COONa与HCl ②CH3COONa与NaOH ③CH3COONa与NaCl ④CH3COONa与NaHCO3下列各项排序正确的是()A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②6. 由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原C.若D为CO,C能和E反应,则A一定为,其电子式D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐二、填空题7. 丙烯可用于合成是杀除根瘤线虫的农药(分子式为)和应用广泛的DAP树脂;已知脂与酯克发生如下酯交换反应:(R,R’ R’’代表羟基)(1)农药分子中每个碳原子上均连有卤原子。
上海海洋大学试卷姓名:学号:专业班名:一、是非题(在以上表格中,正确的以(+)表示,错误的以(-)表示。
共20分) 1.某+3价离子的基态电子排布式为1s 22s 22p 63s 23p 63d 5,则该元素在周期表处于第VIII 族。
2.分子中原子的氧化数可能为分数。
3.EDTA 与所有金属离子都形成1:1的配合物。
4.极性化学键组成的分子也可能是非极性分子。
5.氧化剂氧化数降低的半反应叫氧化反应。
6.在酸性介质中,用KMnO 4溶液滴定草酸盐,滴定应开始快些,到滴定终点时减速。
7.[Ag(NH 3)2]+和[AgY]3-的配位数分别为2和1。
8.同一周期中,p 区元素比s 区元素原子电负性大。
9.原电池中,反应体系的化学能转化为电能。
10.共价键具有方向性和饱和性。
11.实际用到的电极电势数值都是相对值。
12.氢原子中,不存在3d 轨道。
13.高锰酸钾标准溶液配制过程中,应使用托盘天平称量高锰酸钾的质量。
14.根据能斯特方程可知,电极电势与氧化数不发生变化的物质浓度无关。
15.在EDTA 配位滴定中,pH 值愈大,酸效应系数愈大。
16.电极电势数值越负,则氧化型物质氧化性越弱,还原型物质还原性越强。
17.洪特规则是指电子在等价轨道上分布时,总是尽可能以自旋相反的方向分占各轨道。
18.n 级配位反应的总反应稳定常数θf K 与累积稳定常数的关系: ⋅⋅=21ββθf K 。
19.判断氧化还原反应能否被用于滴定分析的标准是:条件电极电位差大于0.5伏特。
20.在1s 轨道附近,有可能发现3s 电子出现。
二、选择题 (将正确答案填入以上表格相应的空格中。
共20分) 1.下列电子运动状态可以存在的是:A 、n =2,l =3,m =0,m s =+1/2B 、 n =4,l =2,m =0,m s =+1/2C 、n =2,l =2,m =+2,m s =+1/2D 、n =3,l =1,m =+2,m s =+1/2 2.原电池符号中,“|”表示 A 、盐桥 B 、 物质浓度 C 、两相界面 D 、无任何意义 3.下列物质中,不适宜做配位体的是:A 、CN -B 、H 2OC 、S 2-D 、+4NH4.EDTA 分子中配位原子的个数为:A 、2B 、4C 、6D 、85、以C 2O 42-沉淀Ca 2+时,加入过量的C 2O 42-使Ca 2+沉淀更完全,这是利用:A 、配位效应B 、酸效应C 、盐效应D 、同离子效应 6.具有sp 3等性杂化轨道类型的分子空间构型是: A 、平面正方型 B 、平面三角型 C 、正四面体 D 、正八面体 7.影响配合物类型的因素包括:A 、中心离子的电子构型B 、中心离子的电荷C 、配体种类D 、以上全对 8.下列物质的沸点最高的是:A 、H 2OB 、H 2SC 、NH 3D 、PH 39.当两个原子轨道沿着键轴方向以平行或“肩并肩”方式重叠,形成的共价键称为:A 、σ键B 、π键C 、氢键D 、杂化轨道 10.实验测定结果显示,CO 2分子为直线型结构,则C 原子杂化类型为:A 、sp 杂化B 、 sp 2 杂化C 、 sp 3 杂化D 、 sp 4杂化 11.下列方法不能提高指定滴定剂的配位滴定选择性的是:A 、控制溶液pHB 、选用更好的金属指示剂C 、加入掩蔽剂D 、以上全否 12.反应3A 2+ + 2B → 3A + 2B 3+在标准状态下电池电动势为1.8V ,某浓度时反应的电池电动势为1.6V ,则此时该反应的lgK θ值为: A 、059.08.13⨯ B 、059.06.13⨯ C 、059.08.16⨯ D 、059.06.16⨯ 13.下列电子构型的原子中,电负性最小的是:A 、2s 22p 3B 、2s 22p 4C 、2s 22p 5D 、2s 22p 6 14.KMnO 4溶液滴定Na 2C 2O 4,达到化学计量点时,下列说法正确的是:A 、溶液中两电对MnO 4-/Mn 2+和CO 2/C 2O 42-的电极电势相等B 、溶液中两电对MnO 4-/Mn 2+和CO 2/C 2O 42-的电极电势不相等C 、溶液中不存在MnO 4-和C 2O 42-离子 D 、此时溶液显示KMnO 4颜色 15.已知:ϕθCr 2O 72-/Cr 3+=1.33V ,ϕθFe 3+/Fe 2+=0.77V ,ϕθI 2/I - =0.54V ,下列还原型物质还原能力强弱次序正确的是:A 、 Cr 3+ > I - > Fe 2+B 、 Fe 2+ > Cr 3+ > I -C 、 I - > Fe 2+ > Cr 3+D 、 Cr 3+ > Fe 2+ > I -16.根据四个量子数,可以推断出各电子层所能容纳电子的最大容量为:A 、 n 2B 、 2n 2C 、 3n 2D 、 4n 2 17.为了获得纯净而易过滤、洗涤的晶形沉淀,下面哪项操作是错误的:A 、沉淀反应宜在适当稀的溶液中进行B 、沉淀反应宜在热溶液中进行C 、沉淀反应宜在不断搅拌下,逐滴加入沉淀剂D 、沉淀完成后,应马上过滤洗涤,不用陈化18.HF 和H 2O 分子之间存在的分子间相互作用包括:A 、色散力B 、色散力、诱导力C 、色散力、诱导力、取向力D 、色散力、诱导力、取向力、氢键19.氧化还原滴定中,分别用0.2mol ·L -1的Sn 2+溶液滴定0.1mol ·L -1的Fe 3+溶液和用0.02mol ·L -1的Sn 2+溶液滴定0.01mol ·L -1的Fe 3+溶液,两种情况下,滴定突跃的关系是:A 、相同B 、前者较大C 、后者较大D 、无法判断 20.对于配离子正确的说法是:A 、稳定常数越大,则稳定性越高B 、中心金属离子电荷越高,则越易形成更高配位数的配离子C 、配位原子电负性越大,则稳定性越高D 、各级累积稳定常数相乘,即得到总稳定常数三、填空题(每一空格1分,共20分)。
中南大学考试A试卷
2009--2010学年 1 学期 时间110分钟 《基础化学》课程 56 学时 3.5 学分 考试形式:闭卷
专业年级:2009级医疗大类各专业 总分100分,占总评成绩 70 %
注:此页不作答题纸,请将答案写在答题纸上
一、填空题(每空1分,共30分)
1、已知:
(1)C(s)+21
O 2(g)→CO(g), △r H Θm,1(298.15K )= -110.5k J·mol -1
(2)C(s)+O 2(g)→CO 2(g), △r H Θm,2(298.15K )= -393.5k J·mol -1
则在标准状态(100kPa )下25℃时,14g CO 的发热量是 kJ 。
3、配合物NH 4[Co(NO 2)4(en)]的系统命名为 ,中心离子的配位数
为 。
4、已知某元素原子基态的价电子层有4个价电子,它们的4个量子数(n 、 l 、m 、m s )分别
是: (4,0,0,+1/2), (4,0,0,-1/2), (3,2,0,+1/2), (3,2,1,+1/2)
则该元素原子的价电子组态是 在周期表中的位置是 区,第 周
期,第 族。
6、溶胶具有相对稳定性的主要因素是 和 。
9、在溶液液面上施加大于渗透压的外压,则溶剂分子由溶液进入溶剂,此过程称
为 。
11、在标准状态下,下列反应能自发进行:
(1) 2+2++3+3+272C r O +6Fe +14H =2C r +6Fe +7H O
(2) 3+2+2+4+2Fe Sn 2Fe +Sn +=
可推断三个电对ϕΘ值的大小顺序是 ,氧化性最强的是 ,还
原性最强的是 。
12、2A B →为双分子基元反应,该反应的级数为 ,速率方程式为 。
13、影响缓冲能力的两个重要因素是 和 ;对于某缓冲系,其有效缓冲
范围为 。
14、在BaSO 4溶液中加入BaCl 2, 会使BaSO 4的溶解度 ,其沉淀溶解平衡的平衡常
数将 ,此效应称为 。
15、已知 HCOOH 在25℃时的酸解离平衡常数K a = 1.8×10-4,则其共轭碱HCOO -的K b 为 。
二、是非题(每题1分,共10分)
1、配合物溶液的pH 升高时,由于中心离子发生水解会使配离子稳定性下降。
( )
3、碳酸钙的生成热等于CaO(s)+CO 2(g)=CaCO 3(s)的反应热。
( )
4、杂化轨道理论不仅能对分子结构进行解释,还能对分子结构进行预测。
( )
6、相同外界条件下,某溶液沸腾时所产生的蒸汽压比纯溶剂沸腾时产生的蒸汽压小。
( )
9、饱和氢硫酸(H 2S )溶液中H +(aq )与S 2-(aq )浓度之比不为2:1。
( )
10、H 2CO 3溶液中CO 32-的浓度近似等于H 2CO 3的K a2 。
( )
三、选择题(单选题,每题2分,共30分)
1、在下列反应中,Q p ≈Q V 的反应为( )。
A .CaCO 3(s) →CaO(s)+CO 2(g)
B .N 2(g)+3H 2(g) →2NH 3(g)
C .C(s)+O 2(g) →CO 2(g)
D .2H 2(g)+O 2(g) →2H 2O (l )
2、配制pH=9.30的缓冲溶液,下列缓冲对中最合适的是( )
A .NaHCO 3-Na 2CO 3(H 2CO 3的p K a2 = 10.33)
B .HAc - NaAc (HAc 的p K a = 4.75)
C .NH 4Cl – NH 3·H 2O (NH 3·H 2O 的p K b = 4.75)
D .Na 2HPO 4 – Na 3PO 4(H 3PO 4的p K a3 = 12.32)
3、在NH 3的水解平衡NH 3(aq) + H 2O(l)
+4NH (aq) + OH -(aq) 中,为使[OH -
] 增大,可行的方法是( )
A .加 H 2O
B .加NH 4Cl
C .加NaCl
D .加HAc
6、渗透压相等的溶液应是( )
A .相同温度下,蒸气压下降值相等的两溶液
B .物质的量浓度相等的两溶液
C .物质的量相等的两溶液
D .质量摩尔浓度相等的两溶液
7、在下列物质中,沸点最高的是( )
A . H 2
B . HF
C . Ne
D . CO
8. 用等浓度下列电解质溶液聚沉Fe(OH)3溶胶时,用量最少的是( )
A . K 2SO 4
B . AlCl 3
C .K 4[Fe(CN)6]
D . Na 3PO 4
9、下列关于电子亚层的说法正确的是( )
A .同一亚层的各轨道是等价的
B .同一亚层电子的运动状态相同
C .P 亚层有一个轨道
D .S 亚层电子的能量低于P 亚层电子
14、某反应在一定条件下平衡的转化率为25%,当有催化剂存在时,其转化率应当( )
25% 。
A .无法确定
B .小于
C .大于
D .等于
15、 电池Cu │Cu +‖Cu +,Cu 2+│Pt 和电池Cu │Cu 2+‖Cu 2+,Cu +│Pt 的反应均可写成
Cu + Cu 2+ = 2Cu +,此两电池的( )
A . m r G ∆, E 均相同
B . m r G ∆, E 均不同
C . m r G ∆不同, E 相同
D . m r G ∆相同,
E 不同
四、计算题(共30分)
1、(7分)对生命起源问题,有人提出最初植物或动物的复杂分子是由简单分子自动形成的。
例如尿素(NH 2CONH 2)的生成可用反应方程式表示如下:
CO 2(g)+2NH 3(g) →(NH 2)2CO(s)+H 2O(1)
已知298.15K 时,△f H Θm [CO 2(g)]、 △f H Θm [NH 3(g)]、△f H Θm [(NH 2)2CO(s)]、△f H Θm [H 2O(1)]
分别为-393.509、-46.11、-333.19、-285.83 kJ·mol -1; S Θm [CO 2(g)]、S Θm [NH 3(g)]、
S Θm [(NH 2)2CO(s)]、S Θm [H 2O(1)]分别为213.74、192.45、104.60、69.91 J·K -1·mol -1。
(1)计算298.15K 时的△r G Θm ,并说明上述反应在此温度和标准态下能否自发;
(2)在标准态下最高温度为何值时,反应就不再自发进行了?
(3)若CO2(g) 、NH3(g)的起始分压分别为10.0、10.0kPa,试判断300K时上述反应正向能否自发?
2、(6分)有一固体混合物,仅由NaH2PO4和Na2HPO4组成,称取该混合物1.91g,用水溶解后,用容量瓶配成100.0 mL,测得该溶液的凝固点为-0.651℃(忽略离子强度的影响,忽略溶液中除Na+、H2PO4-、HPO42-之外的其它粒子对溶液依数性的影响)
(1)计算溶液的渗透浓度(质点浓度)
(2)计算该溶液的pH值。
已知H3PO4的p K a1=2.16、p K a2=7.21、p K a3=12.32;M r(NaH2PO4)=120.0,M r(Na2HPO4) =141.9;K f =1.86 K·kg·mol-1。
3、(6分)298K时,在pH=9.00的NH4Cl-NH3缓冲溶液中,NH3的浓度为0.072mol·L-1。
向100ml该溶液中加入1.0×10-4mol研成粉末的Cu(Ac)2,忽略体积变化。
试问(1)游离铜离子浓度[Cu2+]为多少?
(2)有无Cu(OH)2沉淀生成?
(已知K s(Cu(NH3)42+)= 2.1×1013,K sp(Cu(OH)2) = 2.2×10-20)
4、(6分)放射性同位素32
15P的蜕变3232
1516
P Sβ
→+为一级反应,现有一批该同位素的样品,
经测定其活性在10天后降低了38.42%。
求蜕变速率常数、半衰期及经多长时间蜕变99.0%。
5、(5分)通过计算判断反应Cu2++Cu +2Cl-=== 2CuCl(s) 在298K、标准状态下能否自发进行,并计算反应的平衡常数KΘ和标准自由能变化∆r G mΘ。
已知ϕΘ(Cu+/Cu)=0.521 V,ϕΘ(Cu2+/Cu+)=0.153V,K spΘ(CuCl)=2.0×10-6。