试验二十主族金属碱金属碱土金属铝锡铅锑铋
- 格式:ppt
- 大小:1.76 MB
- 文档页数:7

锡铅锑铋的化学实验报告嘿,大家好,今天咱们来聊聊一个有趣又神秘的话题——锡、铅、锑和铋!听起来就像是化学课本里的魔法四人组,对吧?其实它们可都是我们生活中常见的元素,有的甚至和我们的日常生活息息相关。
别急,咱们一步步来,聊聊它们的特性和实验中发生的那些事儿。
咱们得先说说锡。
锡啊,在生活中可是个老朋友了。
想想那些闪亮亮的罐头和一些小玩意儿,嘿,没错,很多都是锡做的!它的熔点低,没事儿的时候用点锡焊,还能把各种金属牢牢地粘在一起。
这次实验里,我们准备了一些锡,真是像小孩看到糖果一样兴奋!嘿,拿着锡的时候,心里总是想着它能带来什么样的奇迹呢。
接下来是铅,哎,铅可得小心翼翼地对待。
虽然它很重,而且常常被用来制造电池,但铅也不是个好东西,大家都知道,接触太多可不好。
实验的时候,我们戴上手套,像变魔术一样,生怕碰到铅。
可别以为铅就只会让人紧张,它的特性可真不少,像是高密度、耐腐蚀,嘿,简直是个化学界的小明星!然后是锑,这个家伙就更神秘了。
锑的颜色好看得很,银白色的外表像极了贵金属。
我们在实验中仔细观察,发现它在加热的时候会变得非常活跃,冒出各种气泡,像是在跟我们玩捉迷藏。
大家伙儿都惊呼:“哇,真有趣!”我想这大概就是化学的魅力吧,它总能在不经意间给你带来惊喜。
是铋。
这小子可是个性格鲜明的家伙。
铋的密度很大,颜色也独特,像彩虹一样,五光十色。
听说它在冷却的时候会形成漂亮的晶体,那种效果简直让人惊艳。
我们在实验室中像孩子一样围着铋,纷纷拍照留念,仿佛在捕捉一瞬间的魔法。
实验的过程中,大家都很兴奋,互相开玩笑,讨论着这些金属的奇妙之处。
每当我们观察到一个新现象,哇,整个实验室都像炸了锅,兴奋的声音此起彼伏。
感觉就像在进行一场化学的探险,大家都是勇敢的探险者。
准备实验材料的时候,大家纷纷分享各自的经验,就像一场热火朝天的聚会,谁都不愿意错过任何一个精彩瞬间。
我们还试着把这些金属混合在一起,嘿,这可真是个挑战!有的同学开玩笑说,这简直是给化学配乐!每次混合的声音都像是一首乐曲,伴随着我们的欢声笑语。

锡、铅、锑、铋实验报告一、实验目的二、实验内容3、锡、铅、锑、铋的难溶物4、锡(Ⅱ)的还原性和铅(Ⅳ),铋(Ⅲ、Ⅴ)的氧化性及在离子鉴定中的应用赠送以下资料股权转让申请报告我公司是年月由(审批机关)批准成立的中外合资(合作、独资)企业。
公司投资总额为万美元,注册资本为万美元,其中(股东)万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
目前公司注册资本金已经全部缴清。
由于(原因)申请将(股东)持有的%股权以(价格)转让给(新股东)。
股权变更后,公司的注册资本不改变,股权结构变更为(股东)出资万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
现将相关申请材料报送审批机关,请予审核批准。
申请企业(盖章)年月日赠送以下资料一、选择题的特点与答题技巧选择题有单项选择和多项选择之分,通常占卷面分数的30%—40%左右,主要测试考生对基本知识、基本方法的掌握程度,具有很大的灵活性。
命题者常常使迷惑答案具有同等吸引力。
因此,不把考试大纲要求掌握的内容吃透,你是很难回答有经验的命题者所设计的选择题的。
答好选择题,当然必须掌握一定的知识。
但如果再掌握一些答题技巧,就将使你如虎添翼。
下面的提示有助于你掌握答题的技巧:(l)计划答题时间,保持稳定的答题速度。
前已述及,采用选择题型,其中最主要的原因是一份试题可以覆盖大量的材料。
因此,选择题考试通常要求在短时间内作答。
在考试开始时,你应该看一看试题的分量,并且对每道题应占用的时间迅速作出估计。
也许你会发现,每道选择题允许作答的时间不到一分钟。
在某些情况下,这似乎不大可能。
但你不必担心,有不少问题可能只需几秒钟就可作出选择。
这样,你就有足够时间去考虑相对较难的问题。
保持稳定的答题速度,也是很必要的。
一般的做法是:首先通读并回答你知道的问题,跳过没有把握作答的问题。
然后重新计算你的时间,看看余下的每道题要花多少时间。
在一道题上花过多的时间是不值的,即使你答对了,也可能得不偿失。

锡铅锑铋实验报告实验目的,通过实验,掌握锡铅锑铋的性质及其常见化合物的制备方法。
实验原理,锡铅锑铋是一组金属元素,它们在化学性质上有一些相似之处。
锡是一种具有金属光泽的银白色金属,具有较好的延展性和韧性,能够制成薄片。
铅是一种比较常见的金属元素,具有较好的延展性和韧性,可以制成管、线、板等。
锑是一种蓝白色的金属,具有较好的导电性能,可以用于制造半导体材料。
铋是一种蓝白色的金属,具有较好的导电性能,可以用于制造半导体材料。
实验步骤:1. 实验前准备,将所需的实验器材和药品准备齐全,保持实验台面整洁。
2. 制备锡的氢氧化物,将适量的锡粉加入到稀盐酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
3. 制备铅的氧化物,将适量的铅粉加入到稀硝酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
4. 制备锑的氧化物,将适量的锑粉加入到稀盐酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
5. 制备铋的氧化物,将适量的铋粉加入到稀硝酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
实验结果及分析:通过实验,我们成功地制备了锡、铅、锑、铋的氢氧化物。
在实验过程中,我们发现锡的氢氧化物呈白色沉淀,铅的氢氧化物呈黄色沉淀,锑的氢氧化物呈橙色沉淀,铋的氢氧化物呈棕色沉淀。
这些颜色的差异可以帮助我们区分这些金属元素的化合物。
实验结论:通过本次实验,我们深入了解了锡铅锑铋这一组金属元素的性质,掌握了它们的常见化合物的制备方法。
这对于我们进一步学习金属元素的化学性质和化合物的制备方法具有重要的意义。
实验注意事项:1. 在实验过程中,要注意安全,避免化学品的直接接触和吸入。
2. 实验结束后,要及时清理实验器材和台面,保持实验环境的整洁。
3. 实验中产生的废弃物要根据规定进行处理,避免对环境造成污染。
总结:本次实验使我们对锡铅锑铋这一组金属元素有了更深入的了解,通过实际操作,我们掌握了它们的性质及常见化合物的制备方法。


主族金属碱金属,碱土金属实验报告实验目的:1. 了解主族金属、碱金属和碱土金属的化学性质。
2. 熟悉实验操作过程。
3. 掌握安全实验技能。
实验原理:主族金属:主族金属是指在元素周期表周期表中,第1A-8A族的元素,这些元素通常具有很快的反应性和良好的导电性。
它们通常是纯净金属,在大气中易被氧化,因此实验中一般用封闭容器。
碱金属:碱金属是元素周期表第一列Ia族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属具有低密度、柔软、良好的导电性等通用特性。
极易与其他元素化合形成盐和碱性氧化物。
碱金属还有着很强的还原性和活泼性。
碱土金属:碱土金属是元素周期表第二列ⅡA族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属的物理和化学性质与碱金属非常相似。
与碱金属相比,碱土金属更多地呈现出“电子Z的增大而大幅度降低成键能力,共价半径迅速增大,以及更高电离能”。
实验步骤:1. 确认实验器具是否齐备完整。
2. 用溴酸钾的火焰颜色实验手册作为比较标准,进行钠、钾、锶、钙、镁、铝金属燃烧实验。
记录每个实验结果。
3. 测定钙、银反应生成的沉淀。
4. 确认锌含量测量样品。
5. 测定钾或锂的电气化学性质。
实验结果:1. 钠、钾、锶、钙和镁金属进行燃烧实验,分别观察到明亮的黄色、紫色、红色、橙色和白色火花。
2. 测定了钙和银反应生成的沉淀,结果显示产生了白色、坚硬的沉淀物。
3. 测定结果表明,盐酸和氧化锌反应,二氧化碳气体被释放并导致溶液呈现棕色或红色。
4. 测定结果显示,由铜氯盐处理的锌棒,一引入棕色气体就失去了它的重量。
5. 测定了钾和锂的电气化学性质,测定结果显示它们都完全被氧化,而且反应速度很快。
通过本实验,我们进一步掌握了主族金属、碱金属和碱土金属的化学性质,熟悉了实验操作过程,并掌握了安全实验技能。
此次实验也使我们了解到了这些元素的广泛应用和重要性。

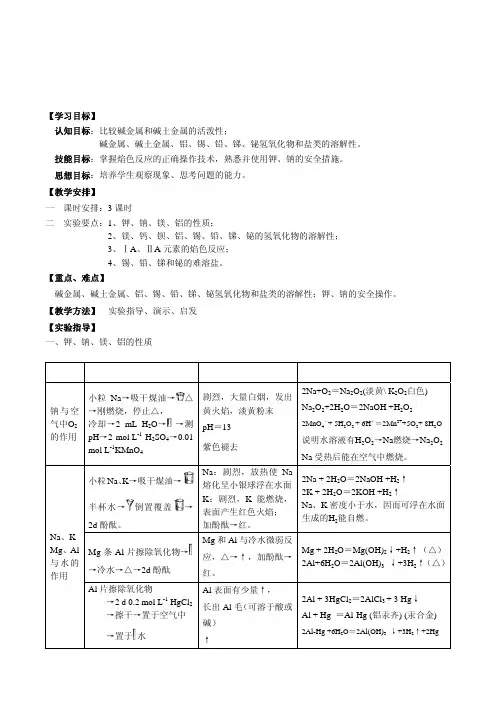
实验二十:主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)〔实验目的〕1.比较碱金属、碱土金属的活泼性;2.试验并比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性;3.练习焰色反应并熟悉使用金属钠、钾的安全措施。
〔实验原理〕主族金属包括ⅠA、ⅡA、p区位于硼到砹梯形连线的左下方元素。
金属元素的金属性表现在:其单质在能量不高时,易参加化学反应,易呈现低的正氧化态,并形成离子键化合物;标准电极电势是有较负的数值,氧化物的水合物显碱性,或两性偏碱性。
碱金属和碱土金属位于ⅠA和ⅡA族,在同一族中金属活泼性由上而下逐渐增强;在同一周期中从左至右逐渐减弱。
例如碱金属和碱土金属都易和氧化合。
碱金属在室温下能迅速地与空气中的氧反应。
钠、钾在空气中稍微加热即可燃烧生成过氧化物和超氧化物。
碱土金属活泼性略差,室温下这些金属表面会缓慢生成氧化膜。
加热燃烧时除可生成正常氧化物外,还可生成氮化物。
碱金属盐类最大的特点是易溶于水。
少数盐难溶于水:① Li+的难溶盐:LiF,Li2CO3,Li3PO4② K+的难溶盐:K2Na[Co(NO2)6]六亚硝酸根合钴(Ⅲ)酸钠钾(亮黄色);K[B(C6H5)4]四苯基硼酸钠(白色);KHC4H4O6酒石酸氢钾(白色)③ Na+的难溶盐:NaAc·ZnAc2·3UO2Ac2·9H2O醋酸铀酰锌钠(淡黄色);Na[Sb(OH)6]碱土金属盐类的重要特征是它们的难溶性,除氯化物、硝酸盐、硫酸镁、铬酸镁、铬酸钙易溶于水外,其余碳酸盐、硫酸盐、草酸盐、铬酸盐皆难溶。
氢氧化铝是两性氢氧化物,它可溶于过量的碱生成[Al(OH)4]-。
Al3+还能与一些配体形成稳定的配合物,如[AlF6]3-,[Al(C2O4)3]3-和[Al(EDTA)]-等。
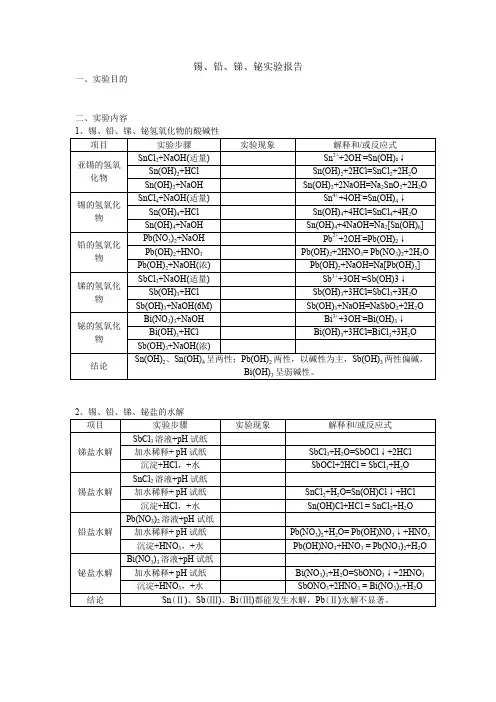
锡、铅的氢氧化物都是两性的。
它们的酸碱性递变规律为:酸性增强Sn(OH)4Pb(OH)4 碱性增强Sn(OH)2Pb(OH)2砷、锑、铋的氧化值为+3的氢氧化物有H3AsO3,Sb(OH)3和Bi(OH)3,它们的酸性依次减弱,碱性依次增强。

实验一十主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋 实验摘要:同一主族中,金属活泼型由上至下逐渐增强, 同一周期中从左至右金属性逐渐减弱, 通过让钠、钾、镁分别和水反应的剧烈程度来验证,发现钾与水反应最剧烈,铝和水的反应 在加热条件下才可进行。
为比较碱土金属、 铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性, 分别向氯化镁、氯化钙、氯化钡、氯化铝、二氯化锡、硝酸铅、三氯化锑、硝酸铋的溶液中 加入氢氧化钠溶液, 观察是否生成沉淀, 再向沉淀中分别加入盐酸和氢氧化钠溶液, 淀是否溶解。
再向氯化镁和氯化铝溶液中加入氨水和氯化铵溶液, 究氢氧化铝和氢氧化镁的生成条件。
碱金属、碱土金属和钙、时会发生焰色反应,根据火焰的颜色定性鉴别这些元素的存在。
锡、 溶于水的硫化物,硫化锡呈棕色,硫化铅呈黑色,硫化锑呈橘黄色,化锡呈黄色。
铅的+2氧化态较稳定,向硝酸铅溶液中分别加入稀盐酸、碘化钾、铬酸钾、 硫酸钠溶液,观察沉淀特征,并探究沉淀性质。
关键词:碱金属 碱金属 金属性焰色反应氢氧化物的溶解性实验用品:实验内容:本实验观察沉观察沉淀的生成现象, 探 钡的挥发性盐在氧化焰中灼烧 铅、锑、铋都能形成难 硫化铋呈棕黑色,二硫烧杯 试管 小刀 镊子 坩埚坩埚钳.镁、钙、钡、铝、锡、铅、锑、铋的氢氧化物的溶解性氢氧化镁和氢氧化铝的形成条件三.1 A、U A元素的焰色反应用洁净的镍丝分别蘸取 1 mol • L-1LiCI、NaCI、KCI、CaCb、SrCl2、BaCb溶液在氧化焰中灼烧。
观察火焰的颜色。
四.锡、铅、锑、铋的难溶盐1■硫化物2■铅的难溶盐结果及讨论:同族中,原子叙述递增,还原性增强;同周期碱金属比同周期碱土金属更活泼。
镁、钙、钡、铝、锡、锑、铅、铋氢氧化物在水中溶解度很小,但都溶于酸;镁、钙、钡、铋的氢氧化物不能溶于过量的碱;铝、锡、铅、锑的氢氧化物呈两性,能溶于过量的酸和碱。
通常原子处于稳定的状态,当受热汽化时,告诉运动的气态离子、电子相互碰撞获得了能量,使外层电子从基态跃迁到激发态,电子从激发态返回基态时会将多余的能量以光的形式放出,显示不同颜色。

锡铅锑铋实验报告实验目的:探究锡、铅、锑、铋的性质,并验证它们在酸中的溶解度。
实验仪器与试剂:1. 锡粉、铅粉、锑粉、铋粉2. 硝酸3. 硫酸4. 碳酸钠溶液5. 纸滤器6. 醋酸铅溶液实验原理:1. 锡是一个易被热还原的金属,可以和盐酸反应生成可溶性盐和氢气。
2. 铅是一种稳定的金属,不与常见的非氧化性酸发生反应。
3. 锑是一种中等活性的金属,可以和浓硫酸反应生成二氧化硫。
4. 铋是一种不活泼的金属,在常温下不与任何非氧化性酸发生反应。
实验步骤:1. 将锡、铅、锑、铋的粉末分别放入4个量级相等的试管中。
2. 用滴管向每个试管中滴加少量的硝酸。
观察是否有气体的产生和颜色的变化。
3. 将硝酸溶液滴加到第一个试管中,观察是否有气体的产生和颜色的变化。
4. 取第二个试管中的溶液,用滤纸过滤出固体。
5. 向第三个试管中加入少量的硫酸,并观察是否有气体的产生和颜色的变化。
6. 取第四个试管中的溶液加入碳酸钠溶液,观察是否有沉淀的产生。
实验结果:1. 锡:在与硝酸反应时产生了气体,生成了白色的锡酸盐。
2. 铅:与硝酸无反应。
3. 锑:在与硝酸反应时产生了气体,生成了无色的硝酸锑。
4. 铋:与硝酸无反应。
实验结论:1. 锡在酸中具有较好的溶解度,并且与硝酸反应生成的锡酸盐是可溶性的。
2. 铅在常见的非氧化性酸中不发生反应,表明铅具有较低的活性。
3. 锑在酸中具有一定的溶解度,并且与硝酸反应生成的硝酸锑是可溶性的。
4. 铋在常温下不与非氧化性酸发生反应,表明铋是一种不活泼的金属。
实验中,我们还观察到了锑与浓硫酸反应时生成二氧化硫气体的现象。
这是因为锑具有中等活性,在浓硫酸的作用下可以发生反应,生成二氧化硫气体。
本实验旨在研究锡、铅、锑、铋的性质,并验证它们在酸中的溶解度。
通过实验得出的结论有助于了解和选择适当的实验条件用于这些金属的处理和应用。

一、实验目的1. 了解锡、铅、锑、铋等金属元素的基本性质。
2. 掌握这些金属元素与酸、碱等无机试剂的反应规律。
3. 通过实验,加深对无机化学基本理论的理解。
二、实验原理锡、铅、锑、铋均为过渡金属元素,具有不同的化学性质。
本实验通过观察这些金属与酸、碱等试剂的反应,了解它们的氧化还原性质、酸碱性、沉淀反应等。
三、实验材料1. 试剂:锡片、铅片、锑片、铋片、稀盐酸、稀硫酸、氢氧化钠溶液、氯化钠溶液、氯化钡溶液、硝酸银溶液等。
2. 仪器:试管、烧杯、酒精灯、镊子、滴管、玻璃棒等。
四、实验步骤1. 锡片与稀盐酸的反应(1)取一支试管,加入少量锡片。
(2)滴加稀盐酸,观察反应现象。
(3)记录反应方程式。
2. 铅片与稀硫酸的反应(1)取一支试管,加入少量铅片。
(2)滴加稀硫酸,观察反应现象。
(3)记录反应方程式。
3. 锑片与氢氧化钠溶液的反应(1)取一支试管,加入少量锑片。
(2)滴加氢氧化钠溶液,观察反应现象。
(3)记录反应方程式。
4. 铋片与氯化钡溶液的反应(1)取一支试管,加入少量铋片。
(2)滴加氯化钡溶液,观察反应现象。
(3)记录反应方程式。
5. 锡、铅、锑、铋氢氧化物的酸碱性(1)分别取锡、铅、锑、铋盐溶液,加入氢氧化钠溶液,观察沉淀现象。
(2)用稀盐酸或稀硫酸滴定沉淀,观察沉淀溶解现象。
(3)记录反应方程式。
五、实验现象1. 锡片与稀盐酸反应,产生氢气,溶液由无色变为浅绿色。
2. 铅片与稀硫酸反应,产生氢气,溶液由无色变为浅绿色。
3. 锑片与氢氧化钠溶液反应,产生白色沉淀。
4. 铋片与氯化钡溶液反应,产生白色沉淀。
5. 锡、铅、锑、铋氢氧化物在氢氧化钠溶液中均产生白色沉淀,沉淀在稀盐酸或稀硫酸中溶解。
六、实验结论1. 锡、铅、锑、铋均为过渡金属元素,具有不同的化学性质。
2. 锡、铅与稀盐酸、稀硫酸反应,产生氢气。
3. 锑与氢氧化钠溶液反应,产生白色沉淀。
4. 铋与氯化钡溶液反应,产生白色沉淀。
5. 锡、铅、锑、铋氢氧化物均为两性氢氧化物,在氢氧化钠溶液中产生白色沉淀,沉淀在稀盐酸或稀硫酸中溶解。
实验二十主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)实验摘要:同一主族中,金属活泼型由上至下逐渐增强,同一周期中从左至右金属性逐渐减弱,本实验通过让钠、钾、镁分别和水反应的剧烈程度来验证,发现钾与水反应最剧烈,铝和水的反应在加热条件下才可进行。
为比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性,分别向氯化镁、氯化钙、氯化钡、氯化铝、二氯化锡、硝酸铅、三氯化锑、硝酸铋的溶液中加入氢氧化钠溶液,观察是否生成沉淀,再向沉淀中分别加入盐酸和氢氧化钠溶液,观察沉淀是否溶解。
再向氯化镁和氯化铝溶液中加入氨水和氯化铵溶液,观察沉淀的生成现象,探究氢氧化铝和氢氧化镁的生成条件。
碱金属、碱土金属和钙、钡的挥发性盐在氧化焰中灼烧时会发生焰色反应,根据火焰的颜色定性鉴别这些元素的存在。
锡、铅、锑、铋都能形成难溶于水的硫化物,硫化锡呈棕色,硫化铅呈黑色,硫化锑呈橘黄色,硫化铋呈棕黑色,二硫化锡呈黄色。
铅的+2氧化态较稳定,向硝酸铅溶液中分别加入稀盐酸、碘化钾、铬酸钾、硫酸钠溶液,观察沉淀特征,并探究沉淀性质。
关键词:碱金属碱金属金属性焰色反应氢氧化物的溶解性实验用品:烧杯试管小刀镊子坩埚坩埚钳实验内容:内容操作现象解释及原理钠与空气中氧气的作用取一小块(绿豆大小)金属钠,用滤纸吸干其表面的煤油,放在坩埚中加热。
当开始燃烧时,停止加热,观察反应情况和产物的颜色、状态。
冷却后,往坩埚中加入2mL蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。
再用2mo l·L-1H2SO4酸化,滴加1~2滴·L-1KMnO4溶液。
淡黄色粉末。
pH呈碱性。
KmnO4溶液褪色。
2Na+O2=Na2O2Na2O2+2H2O=2NaOH+H2O25H2O2+2MnO4-+6H+=2Mn2++8H2-O+5O2↑钠、钾、分别取一小块(绿豆大小)金属钠和钾,用滤纸吸干其表面煤油,把它们分别投入盛有半杯水的烧杯中,观察反应情况。
锡铅锑铋实验报告导言:锡铅锑铋是一组常见的金属元素,它们有着多样的应用领域和独特的化学性质。
本次实验旨在通过实际操作和观察,进一步了解锡铅锑铋的物理和化学性质,为我们对这些金属元素的应用提供更深入的认识。
实验材料与方法:1. 实验材料:- 锡(Sn)- 铅(Pb)- 锑(Sb)- 铋(Bi)- 实验室工具:坩埚、火花吹管、酒精灯等。
2. 实验方法:a. 准备工作:清洗和烘干所需的实验器具,以确保实验结果的准确性。
b. 实验操作:- 实验一:将锡、铅、锑和铋分别放入不同的坩埚中。
- 实验二:通过调节酒精灯的火焰强度,分别对锡、铅、锑和铋进行加热,并观察其变化。
- 实验三:将火花吹管放置在实验室提供的某一金属上,并进行火花测试,以确定该金属的身份。
实验结果与讨论:1. 实验一观察结果:通过实验操作,我们可以得到不同金属元素的观察结果。
锡呈灰白色,以块状存在;铅呈银白色,以块状存在;锑呈灰白色,以颗粒状存在;铋呈银白色,以片状存在。
这些观察结果为我们后续的实验操作提供了基础。
2. 实验二观察结果和讨论:在进行加热实验时,我们发现不同金属元素在受热过程中表现出不同的性质。
锡在经过一段时间加热后开始融化,并产生明显的液体状态;铅也在一段时间后开始融化,但熔点较锡更高;锑在加热过程中熔点较高,几乎不发生熔化;铋的熔点较锡、铅和锑更高,经过一段时间的加热后才出现明显的熔化现象。
这表明不同金属元素的熔点不同,其熔化过程也存在差异。
3. 实验三观察结果和讨论:通过火花测试,我们可以根据观察到的火花特征来识别金属元素。
不同金属元素在加热后,产生的火花颜色和形态具有一定的区别。
例如,锡产生的火花呈亮白色;铅产生的火花也呈亮白色,但比锡的火花量更大;锑产生的火花呈白色,且数量更多;铋产生的火花则较为明亮且有较长的延展性。
通过火花测试,我们可以确定各金属元素的身份。
结论:通过本次实验,我们对锡铅锑铋的物理和化学性质有了更深入的了解。