苏教版化学必修二2.3 化学能与电能的转化(学生版)
- 格式:doc
- 大小:2.51 MB
- 文档页数:29









化学能与电能__________________________________________________________________________________ __________________________________________________________________________________1.理解原电池的原理及其应用2.电极反应和电池反应的书写3.了解钢铁的电化学腐蚀4.电解池中两极电极反应的书写5.电解池、原电池的区别6.电解饱和食盐水、电镀、电解法冶炼金属的原理知识点一.原电池原理1.实验探究2.原电池(1)定义:将化学能转变为电能的装置.(2)工作原理:(以锌—铜—稀硫酸原电池为例)现象 锌片逐渐溶解 铜片上产生气泡得失电子 失电子 得电子 正负极判断 负极 正极 电子流向 流出 流入 反应类型 氧化反应 还原反应 电极反应式 Zn -2e -===Zn 2+2H ++2e -===H 2↑总反应式 Zn +2H +===Zn 2++H 2↑(3)构成条件:①能进行自发的氧化还原反应;②两个活泼性不同的金属(或金属与非金属); ③电极插入电解质溶液中; ④构成闭合回路. 3.钢铁的电化学腐蚀 (1)电化学腐蚀:金属跟电解质溶液接触――→发生 原电池反应――→结果比较活泼的金属失去电子而被氧化。
(2)钢铁的腐蚀: ①构成条件:电极-铁与少量的碳形成两电极电解质溶液-钢铁表面水膜中溶有少量H +和OH -,还溶解了氧气等气体。
②电极反应:负极(铁)- 2Fe -4e -===2Fe 2+正极(碳)-O 2+4e -+2H 2O===4OH -总反应- 2Fe +O 2+2H 2O===2Fe(OH)2后续反应:4Fe(OH)2+O 2+2H 2O===4Fe(OH)3,Fe(OH)3易分解生成铁锈(Fe 2O 3·x H 2O)。
化学:2.3.1化学能转化为电能教案(苏教版必修2)[教学目的] (1)通过实验和实例了解化学能与电能的转化关系。
(2)初步认识原电池概念、原理、组成及应用。
[教学重点] 认识原电池概念、原理、组成及应用。
[教学难点]通过对实验的研究,引导学生从电子转移角度理解化学能向电能转化的本质。
[教学方法] 实验探究法——通过实验,分析、讨论、思考、交流、归纳、小结。
[教具准备] 1.铁丝、铜丝、锌片、铜片、石墨棒、稀硫酸、CuSO4溶液、ZnSO4溶液,乙醇、西红柿(或其他水果),灵敏电流计、烧杯、导线 2.多媒体课件[引入新课]下面我们在前人研究的基础上来探究化学能与电能之间是如何转化的?火电站工作原理示意图分析思考与交流化学能要经过一系列能量转换才能转化为电能。
要使氧化还原反应释放的能量不通过热能而直接转化为电能,把可产生的电能以化学能的形式储存起来,就要设计一种装置。
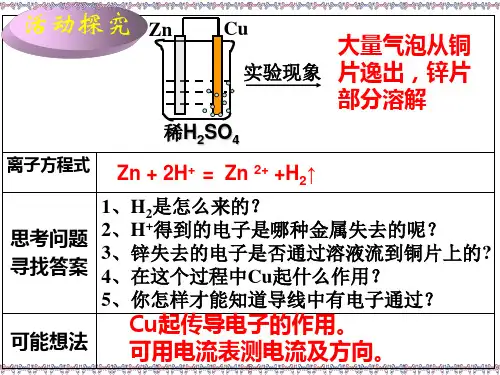
将化学能直接转化为电能,高效利用燃料、不浪费能源、开发出高能清洁燃料?[讲授新课]实验探究 [实验2-4]实验1:把一块锌片和铜片分别插入盛有稀硫酸的烧杯里。
实验2:用导线将锌片和铜片连接起来。
实验3:在导线中接入一个灵敏电流计。
交流与讨论(组织学生小组讨论并回答)1、锌和稀H 2SO 4直接反应的实质是什么?2、什么原因造成实验1和实验2中的现象的不同?3、铜片与稀硫酸不反应,锌片和铜片用导线连接后插入稀硫酸中,为什么在铜片表面有气泡产生?你认为这种气体可能是什么?锌片和铜片上可能分别发生什么反应?如何证明?4、灵敏电流计的指针发生偏转,偏向何方?你如何解释这一现象?分析 灵敏电流计指针偏转→有电流产生→产生电能→化学能转化为电能的装置→原电池。
分析 原电池的微观原理启发归纳 在原电池中,从不同角度判定电极名称 1.指针偏向哪一极,该极为正极,另外一极为负极。
2.从电极材料,金属活泼性判断。
3.相对活泼金属为负极,相对不活泼金属为正极。
化学能与电能的转化【教学目标】1.获得化学能与电能转化的化学实验的基础知识和基本技能,学习实验研究的方法,能设计并完成化学能与电能转化的化学实验。
2.形成原电池的概念,探究构成原电池的条件。
【教学过程】【第一课时】[实践活动]水果电池的制作1.实验准备:水果样品(柠檬、番茄、桔子、葡萄或其它水果)、金属(铁丝、铜丝、锌片或铝片)、石墨电极、电铃、灯泡、微安电流计、导线若干、小刀、pH试纸2.学生分小组活动鼓励学生利用各种自备的水果、金属片制作电池,用微安电流计或耳机测试是否能产生电流,比较电流的大小。
若用小刀切开水果,使两个极板分离,观察电流是否消失,将水果重新合拢是否又产生电流?探究其原因。
学生设计实验方案,教师参与活动并适时点拨、鼓励、引导。
[讨论与交流]小组代表汇报说明实验结果,交流发现的问题与解决方法。
[总结与评价]说明水果电池的构成,为什么可以产生电流。
[教师补充讲解]电池在生活、工农业生产和科学技术等方面有广泛的用途,人们利用原电池原理,制作了多种电池,制作了多种电池,如干电池、蓄电池、充电电池、高能电池等,以满足不同的需要。
一、化学电源依据原电池的反应原理,人们发明并制造了多种多样的化学电源。
化学电源有一次电池与二次电池之分。
各种干电池是一次电池,用过之后不能复原。
蓄电池是二次电池,在充电后能继续多次使用。
化学电源的能量转化率是燃料燃烧所不可比拟的。
化学电源不仅在生活中得到了广泛的应用,而且在高科技领域乃至航天技术中也是不可或缺的。
请结合生活经验和自己的了解,请同学们说说你所知道的电池的用途。
[投影]各种电池(学生分别述说电池的用途)1.干电池2.铅蓄电池[展示]干电池和铅蓄电池实物。
(由学生和教师分别讲述这两种电池的构造和用途)[阅读]课本中3.锂电池4.新型燃料电池(由学生自学完成)[讲述]生活经验告诉我们,有些金属制品在使用一段时间以后,会失去表面的光泽,严重的会变得锈迹斑斑影响使用,尤其是钢铁制品,在潮湿的空气里,很容易生锈,这实际上是一种被叫做金属腐蚀的现象。
2.3.1化学能转化为电能 化学电源1.构成原电池的条件 (1)有活泼性不同的两个电极; (2)电极插入电解质溶液中; (3)电极间形成闭合回路; (4)能自发地发生氧化还原反应。
2.原电池工作原理口诀原电池分两极(正、负);负极氧化正(极)还原;电子由负(极)流向正(极);阳(离子)向正(极)阴(离子)向负(极)。
3.原电池正、负极的判断化合价升高―→失去电子―→发生氧化反应―→负极; 化合价降低―→得到电子―→发生还原反应―→正极。
4.钢铁发生电化学腐蚀的电极反应和总反应 负极反应:Fe -2e -===Fe 2+,正极反应:O 2+4e -+2H 2O===4OH -, 总反应:2Fe +O 2+2H 2O===2Fe(OH)2, 4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
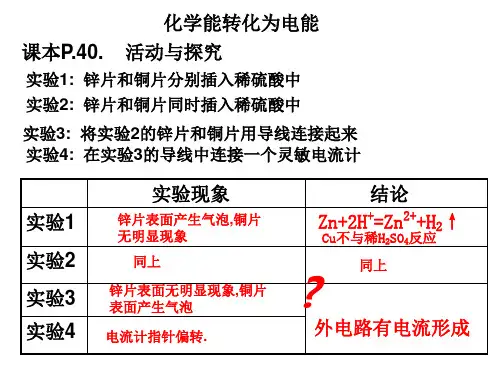
原电池及其工作原理1.实验探究[实验1]把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯中,观察实验现象。
[实验2]把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯中,观察实验现象。
实验1、2现象:实验1、2中现象相同,均为锌片周围有气泡产生,铜片周围无明显现象。
实验结论:锌在金属活动性顺序中位于氢前面,能置换酸中氢;铜片在金属活动性顺序中位于氢后面,不能置换酸中氢。
[实验3]用导线把实验2中的锌片和铜片连接起来,观察实验现象。
[实验4]在导线中间接一个灵敏电流计,观察实验现象。
实验3、4现象:锌片周围无气泡产生,铜片周围有气泡产生;电流计指针发生偏转。
实验结论:锌、铜用导线连接后插入稀硫酸溶液中,导线中有电流产生。
2.原电池(1)概念:将化学能转变为电能的装置。
(2)工作原理(以锌-铜-稀H2SO4原电池为例):(3)构成条件a.有活泼性不同的两个电极b.电极插入电解质溶液中c.电极间构成闭合回路d.能自发地发生氧化还原反应(4)原电池的电极反应负极→流出电子→发生氧化反应,正极→流入电子→发生还原反应。
[特别提醒]原电池的正极是导体,它不参与化学反应;负极反应不一定是负极材料本身的反应,有的原电池的负极既是导体又是负极反应物(如铜锌原电池),有的原电池负极的作用是导体(如H2、O2燃料电池),它不参与化学反应。
1.将铁片、镁片用导线连接插入稀硫酸中,则铁片上发生什么反应,电极反应式如何书写?提示:镁比铁活泼,镁作负极,铁作正极,铁电极上发生还原反应,电极反应式是2H ++2e-===H↑。
22.原电池的电极材料都必须是金属吗?提示:原电池的电极材料可以是两种活泼性不同的金属,也可以是一种金属与一种可导电的惰性材料(如石墨),在燃料电池中,电极本身均不发生反应,故两极均可用惰性材料。
3.原电池内部阴、阳离子是如何移动的?提示:阴离子向负极移动,阳离子向正极移动。
1.原电池的判断2.原电池正负极的判断1.如图所示的装置,能够组成原电池产生电流的是________。
2.(2015·浙江10月考试)如图所示进行实验,下列说法不正确的是()A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生B.甲、乙装置中的能量变化均为化学能转化为电能C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转D.装置乙中负极的电极反应式:Zn-2e-===Zn2+原电池原理的应用1.钢铁的电化学腐蚀(1)电化学腐蚀金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
(2)钢铁的电化学腐蚀2.金属活动性强弱的判断由A、B、C、D四种金属按下表中装置进行实验(1)装置甲中负极的电极反应式是A-2e-===A2+。
(2)装置乙中正极的电极反应式是Cu2++2e-===Cu。
(3)四种金属活动性由强到弱的顺序是D>A>B>C。
1.锌与稀硫酸反应时,若滴几滴硫酸铜溶液,反应速率会加快,试分析其原因。
提示:滴加硫酸铜溶液后,会有少量锌与硫酸铜反应置换出铜,生成的铜、锌分别作为原电池的两个电极而形成原电池,从而加快锌与稀硫酸的反应。
2.已知反应Cu+2Ag+===2Ag+Cu2+,请将该反应设计成原电池,画出原电池装置图并标出正、负极。
提示:先确定两个电极,负极失电子化合价升高,所以铜作负极,再找活泼性比铜弱的碳棒或银棒作正极;从反应中可以看出电解质溶液中必须含有银离子,所以用硝酸银溶液作电解质溶液。
装置图见右图。
原电池原理的应用1.加快氧化还原反应的速率(1)原理:在原电池中,氧化反应和还原反应分别在两极进行,使溶液中的粒子运动时相互间干扰减小,使反应速率增大。
(2)应用:实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。
原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
2.比较金属的活动性强弱(1)原理:原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。
(2)应用:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池(1)首先将已知氧化还原反应拆分为两极反应式。
氧化反应:还原剂-n e-===氧化产物(负极反应式);还原反应:氧化剂+n e-===还原产物(正极反应式);正极反应式+负极反应式=电池的总反应式。
(2)根据原电池的电池反应特点,结合两极反应式找出正负极材料及电解质溶液。
①电解质溶液的选择:电解质溶液一般要能够与负极发生反应或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。
②电极材料的选择:在原电池中,一般选择活泼性较强的金属作为负极,活泼性较弱的金属或能导电的惰性材料作正极。
负极材料或还原性物质在负极上失去电子被氧化,氧化性物质在正极上得到电子被还原。
(3)实例:1.100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2的总量,可采用的方法是()A.加入适量6 mol·L-1的盐酸B.加入几滴CuCl2溶液C.加入适量蒸馏水D .加入适量的NaCl 溶液2.有A 、B 、D 、E 四种金属,当A 、B 组成原电池时,电子流动方向A →B ;当A 、D 组成原电池时,A 为正极;B 与E 构成原电池时,电极反应式为E 2++2e -===E ,B -2e-===B 2+。
则A 、B 、D 、E 金属性由强到弱的顺序为( )A .A>B>E>DB .A>B>D>EC .D>E>A>BD .D>A>B>E化学电源1.原理 2.优点化学电源的能量转化率比燃料燃烧大的多。
3.分类⎩⎪⎨⎪⎧一次电池:用过之后不能复原,如锌锰干电池、纽扣电池等;二次电池:充电后能继续使用,如铅蓄电池、镍氢电池等;燃料电池:燃料不贮存在电池内部,可持续使用,能量利用率高,如氢氧燃料电池、甲醇燃料电池。
4.常见化学电源的组成1.铅蓄电池的正、负极材料是什么?电解质溶液是什么? 提示:负极:Pb ,正极:PbO 2,电解质溶液:稀H 2SO 4。
2.氢氧燃料电池在酸性条件和碱性条件下的正极反应式相同吗?若不同,请分别写出反应式。
提示:不相同;酸性条件下正极反应式:O 2+4H ++4e -===2H 2O ,碱性条件下正极反应式:2H2O+O2+4e-===4OH-。
3.除氢氧燃料电池外,其他燃料电池的负极反应物通常还有哪些?正极放电的是什么物质?提示:负极还可以是烃(如甲烷、乙烷等)、醇(如甲醇、乙醇等)、氨、煤气等可燃性气体或液体。
正极放电的是氧气。
1.常见化学电源的反应原理(1)锌锰干电池Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH)(2)铅蓄电池2PbSO4+2H2OPbO2+Pb+2H2SO 4放电充电(3)甲醇-空气燃料电池2CH3OH+3O2+4OH-===2CO2-3+6H2O2.氢氧燃料电池(1)燃料电池的本质是燃料与氧化剂之间能够发生自发的氧化还原反应,且能够对外放出能量。
(2)燃料电池在使用过程中,并没有发生燃料的燃烧,而是燃料和氧化剂分别在两极放电,将化学能转化为电能。
(3)燃料的燃烧是一种剧烈的氧化还原反应,而燃料电池中发生的氧化还原反应则是缓和平稳的。
(4)燃料燃烧时,大量的热能释放到空气中,能量利用率低,燃料电池工作时,能量转化率较高,是一种高效、环境友好的发电装置。
1.燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能,氢氧燃料电池的基本反应是:X 极:12O 2+H 2O +2e -===2OH -Y 极:H 2+2OH --2e -===2H 2O 下列说法正确的是( ) A .X 是负极 B .Y 是正极C .Y 极上发生还原反应D .Y 极上发生氧化反应2.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。
某种锂电池的总反应式为Li +MnO 2===LiMnO 2,下列说法正确的是( )A .Li 是正极,电极反应为Li -e -===Li +B .Li 是负极,电极反应为Li -e -===Li +C .MnO 2是负极,电极反应为MnO 2+e -===MnO -2 D .Li 是负极,电极反应为Li -2e -===Li 2+[方法技巧](2)寻找易写电极反应突破法根据总反应方程式和电解质特点,写出较易写的电极反应,然后用总反应减去该电池反应可得另一极的电极反应。
复杂电极反应=总反应-较简单一极的电极反应 如CH 4酸性燃料电池中:CH4+2O2===CO2+2H2O……总反应2O2+8H++8e-===4H2O……正极反应式CH4+2H2O-8e-===CO2+8H+……负极反应式[三级训练·节节过关]1.如下图所示装置,能够组成原电池的是()2.下列有关电池的说法中不正确的是()A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极3.如图装置所示,铜片上发生的反应为()A.Zn2++2e-===ZnB.2H++2e-===H2↑C.Zn-2e-===Zn2+D.Cu2++2e-===Cu4.(2016·绍兴一中期中)如图是铜锌原电池示意图。
当该原电池工作时,下列描述不正确的是()A.溶液逐渐变蓝B.锌片逐渐溶解C.铜片上有气泡产生D.电流计指针发生偏转5.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl===NaCl+H2O;B.Zn+H2SO4===ZnSO4+H2↑,判断能否设计成原电池:A.________,B.________(填“能”或“不能”)。