例6-1苯(A)与甲苯(B)的饱和蒸气压和温度的关系数据如本
- 格式:doc
- 大小:532.01 KB
- 文档页数:30

化工原理蒸馏试题蒸馏一.填空题1.蒸馏是分离____________的一种方法,蒸馏分离的依据是_______________________________。
2.气液两相呈平衡状态时,气液两相温度_______,但气相组成________液相组成。
3.气液两相组成相同时,则气相露点温度________液相泡点温度。
4.在精馏过程中,增大操作压强,则物系的相对挥发度________,塔顶温度_________,塔釜温度_______,对分离过程___________。
5.两组分溶液的相对挥发度是指溶液中_______的挥发度对________的挥发度的比值,a=1表示_______。
6.所谓理论板是指该板的气液两相____________,且塔板上_________________。
7.某两组分物系,其相对挥发度α=3,对第n,n-1两层理论板,在全回流条件下,已知x n=0.3,则y n-1 =_________________。
8.某精馏塔的温度精馏段操作线方程为y=0.75+0.24,则该精馏塔的操作回流比是____________,馏出液组成为____________________。
9.精馏塔的塔顶温度总是低于塔底温度,其原因是_____________和_________________。
10.在总压为103.3kPa温度为95℃下,苯与甲苯的饱和蒸汽分别为=155.7kPa =63.3 kPa,则平衡时苯的液相组成为=_________,气相组成为y=______________,相对挥发度为α=____________。
11.精馏塔有____________进料热状态,其中__________进料q值最大,进料温度____泡点。
12.在操作的精馏塔中,测得相邻两塔板的两相四个组成为0.62,0.70,0.75,0.82.则=_________,=________,=_________,=_______.13.对于不同的进料热状态,,与的进料关系为(1)冷液进料,_________,___________(2)饱和液体进料,_________,__________(3)气液混合物进料,_________,___________(4)饱和蒸汽进料,_________,__________(5)过热蒸汽进料, _________,___________14.某连续精馏塔中,若精馏段操作线方程的截距等于零,则:回流比等于_________,馏出液量等于____________,操作线方程为_______________。


苯的饱和蒸汽压温度表1. 引言苯是一种常见的有机化合物,具有广泛的应用领域。
了解苯的饱和蒸汽压与温度之间的关系对于工业生产和实验研究都具有重要意义。
本文将介绍苯的饱和蒸汽压温度表,并对其相关知识进行详细阐述。
2. 苯的基本性质苯(化学式:C6H6)是一种无色、易挥发的液体。
它具有特殊的芳香气味,并且不溶于水。
苯是一种重要的溶剂,在化学反应中被广泛应用。
3. 饱和蒸汽压与温度饱和蒸汽压是指在一定温度下,液体与其相应气体之间达到平衡时所产生的压强。
对于苯来说,它的饱和蒸汽压与温度之间存在着明确的关系。
以下是苯在不同温度下的饱和蒸汽压数据表(单位:mmHg):温度(摄氏度)饱和蒸汽压(mmHg)-40 1.0-30 2.0-20 4.0-10 8.00 15.510 30.920 58.830 105.340 179.2由上表可见,苯的饱和蒸汽压随温度的升高而增加。
这是因为温度升高会导致液体分子动能增加,从而使液体分子逃逸成为气体状态。
4. 计算苯的饱和蒸汽压苯的饱和蒸汽压与温度之间的关系可以通过公式来计算。
常用的公式有安托万方程和克劳修斯-克拉佩龙方程。
安托万方程安托万方程(Antoine equation)是一种经验公式,用于描述物质的饱和蒸汽压与温度之间的关系。
对于苯来说,安托万方程可以表示为:ln(P) = A - B / (T + C)其中,P表示饱和蒸汽压(单位:mmHg),T表示温度(单位:摄氏度),A、B、C 为实验常数。
通过实验数据拟合,可以得到苯的安托万方程参数如下:A = 6.90565B = 1211.033C = 220.79克劳修斯-克拉佩龙方程克劳修斯-克拉佩龙方程(Clausius-Clapeyron equation)是一种理论公式,用于描述物质的饱和蒸汽压与温度之间的关系。
对于苯来说,克劳修斯-克拉佩龙方程可以表示为:ln(P2/P1) = ∆Hvap/R * (1/T1 - 1/T2)其中,P1和P2分别表示两个温度下的饱和蒸汽压(单位:mmHg),T1和T2分别表示两个温度(单位:摄氏度),∆Hvap表示液体蒸发时的摩尔热焓变化(单位:J/mol),R为气体常数。

6-3. 甲醇(A)—丙醇(B)物系的气—液平衡服从拉乌尔定律。
试求: (1)温度t=80℃、液相组成x =0.5(摩尔分数)时的汽相平衡组成与总压;(2)总压为101.33kPa 、液相组成x =0.4(摩尔分数)时的汽—液平衡温度与汽相组成;(3)液相组成x=0.6、汽相组成y=0.84时的平衡温度与总压。
组成均为摩尔分数。
用Antoine 方程计算饱和蒸汽压(kPa )甲醇 86.23899.157419736.7lg +-=t P oA丙醇 19314.137574414.6lg +-=t P oB式中,t 为温度,℃。
解:(1) 当t=80℃时,甲醇258.286.23899.157419736.7lg =+-=t P oA1.181=⇒oA P (KPa) 丙醇70.119314.137574414.6lg =+-=t P oB ??????9.50=⇒o B P (KPa)又∵液相组成5.09.501.1819.50=--=--=p P P P P x o B o A o B∴所求的总压116=p (kPa) ∴汽相平衡组成PxP y o A =1161.1815.0⨯=78.0=(2)总压oB oA P P P 6.04.033.101+==联立Antoine 方程可解得 汽液平衡温度C t o 6.79=,可得:甲醇饱和蒸汽压53.178=oA P (KPa)丙醇饱和蒸汽压07.50=oB P (KPa)∴汽液组成为pxP y oA =33.10153.1784.0⨯=705.0=(3)∵液相组成6.0=x ,汽相组成84.0=y∴P P P oB oA =+4.06.0,P P oA 84.06.0= 联立二式可求得27=o B o A P P 即oB o A o B o A P P P T P lg 27lg lg 2+=⇒=即19314.137574414.627lg 86.23899.157419736.7+-+=+-t t ∴平衡温度=t 总压=P6-7. 甲醇和丙醇在80℃时的饱和蒸气压分别为181.1kPa 和50.93kPa 。

第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p = kPa 及*B p = kPa ,取样测得液面上方气相中组分A 的摩尔分数为。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为24.22035.1206032.6lg *A +-=t p58.21994.1343078.6lg *B +-=t p 式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa 初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α 6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =,*B p =203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。

苯的饱和蒸汽压表引言:在化学领域中,蒸汽压是一个重要的参数,用于描述液体的挥发性和的蒸气与液体的平衡。
我们将探讨苯的饱和蒸汽压表,研究其背后的原理和应用。
1.苯的饱和蒸汽压的定义饱和蒸汽压是指在特定温度下,液体表面的蒸发与液体中分子的反向化速率达到平衡时的压力。
对于苯来说,其饱和蒸汽压随着温度的升高而增加,呈正相关关系。
2.苯的饱和蒸汽压表的构成苯的饱和蒸汽压表通常由两列数据组成:温度和对应的饱和蒸汽压。
温度列列出了一系列特定温度下的苯的饱和蒸汽压数值,而对应的饱和蒸汽压列则给出了每个温度下的苯的饱和蒸汽压力数值。
3.苯的饱和蒸汽压表的应用苯的饱和蒸汽压表在实际应用中有着广泛的用途。
是一些常见的应用:3.1.化学实验室在化学实验室中,苯是一种常用的试剂。
知道其饱和蒸汽压可以帮助实验者更好地控制反应条件和处理液体苯的过剩量,避免由于苯的挥发性带来的安全隐患。
3.2.工业生产苯在许多工业领域中广泛应用,例如生产塑料、染料和物等。
通过苯的饱和蒸汽压表,工业生产者可以根据所需温度合适的操作条件,从而优化工艺和高生产效率。
3.3.环境监测苯是一种常见的挥发性有机物,常被用作判断空气污染程度的指标之一。
通过测量特定条件下环境中的苯的饱和蒸汽压,并与表中的数值进行比对,可以了解环境中的苯浓度及其对人体健康的潜在风险。
4.苯的饱和蒸汽压表的限制需要注意的是,苯的饱和蒸汽压表中给出的数值只适用于特定的温度范围。
若温度超出此范围,饱和蒸汽压值的计算需根据其他公式或模型进行推算。
结论:苯的饱和蒸汽压表是一个重要的工具,用于研究苯的蒸汽压与温度之间的关系。
对于化学实验室、工业生产和环境监测等领域,了解苯的饱和蒸汽压表的应用可以更好地实验设计和操作,高工艺效率和保障人体健康。
但需要注意的是,需要根据具体的温度范围来合适的饱和蒸汽压数值,以确保其准确性及适用性。
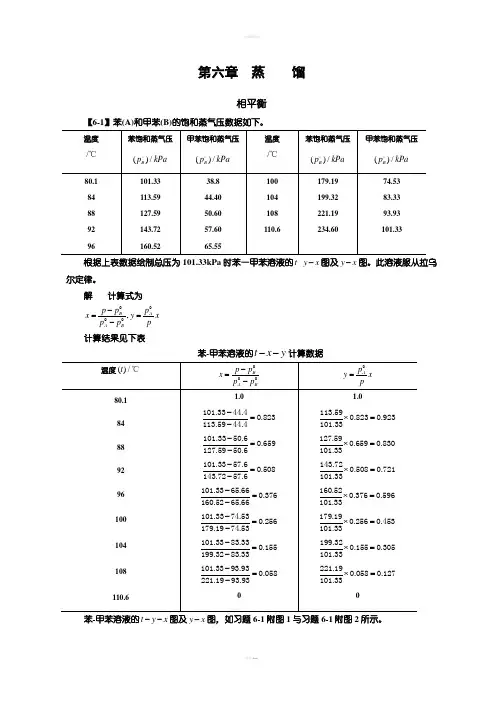
第六章 蒸 馏相平衡【6-1】苯(A)和甲苯(B)的饱和蒸气压数据如下。
101.33 38.8 179.19 74.53 根据上表数据绘制总压为101.33kPa 时苯一甲苯溶液的-t y x -图及y x -图。
此溶液服从拉乌尔定律。
解 计算式为,0000B AA Bp p p x y x p p p -==- 计算结果见下表苯-甲苯溶液的t x y --计算数据苯-甲苯溶液的t y x --图及y x -图,如习题6-1附图1与习题6-1附图2所示。
习题6-1附图1 苯-甲苯t-y-x 图习题6-1附图2 苯-甲苯y-x 图【6-2】在总压.101325kPa 下,正庚烷-正辛烷的汽液平衡数据如下。
温度/℃ 液相中正庚烷的摩尔分数()x汽相中正庚烷的摩尔分数()y温度/℃ 液相中正庚烷的摩尔分数()x 汽相中正庚烷的摩尔分数()y 98.4 105 1101.0 0.656 0.4871.0 0.81 0.673115 120 125.60.311 0.157 00.491 0.280 0试求:(1)在总压.101325kPa 下,溶液中正庚烷为0.35(摩尔分数)时的泡点及平衡汽相的瞬间组成;(2)在总压.101325kPa 下,组成.035x =的溶液,加热到117℃,处于什么状态?溶液加热到什么温度,全部汽化为饱和蒸气?解 用汽液相平衡数据绘制t y x --图。
(1) 从t y x --图上可知,.035x =时的泡点为113.8℃,平衡汽相的瞬间组成.053y =。
(2) .035x =的溶液,加热到117℃时为气液混合物,液相组成.024x =,汽相组成.040y =。
.035x =的溶液加热到118℃时,全部汽化为饱和蒸气。
习题6-2附图 正庚烷-正辛烷t-y-x 图【6-3】 甲醇(A)-丙醇(B)物系的汽液平衡服从拉乌尔定律。
(1) 试求温度80℃t =、液相组成.05x =(摩尔分数)时的汽相平衡组成与总压。

苯和甲苯的饱和蒸气压与温度引言:苯和甲苯是常见的有机化学物质,广泛应用于化工、制药、医疗等领域。
了解它们在不同温度下的饱和蒸气压,对于控制它们的物理性质、应用于实际生产中具有重要意义。
本文将从苯和甲苯的性质、饱和状态以及不同温度下的饱和蒸气压等方面进行研究。
一、苯和甲苯的性质苯是一种苯香族化合物,化学式为C6H6。
它是一种无色透明的液体,密度小于水,具有芳香味和独特的香气。
苯对人体毒性较大,具有麻醉、致癌和致畸等危害。
因此,在应用中需注意使用安全。
甲苯是苯的一种对位取代物,化学式为C7H8。
它是一种无色透明的液体,与苯类似,具有芳香味和独特的香气。
甲苯比苯对人体毒性较小,但也需注意应用中的安全性。
二、苯和甲苯的饱和状态饱和是物质在一定温度下通过加热或减压使其达到饱和状态的过程,同时所处的状态也被称为饱和状态。
苯和甲苯在不同温度下的饱和状态如下表所示:表一苯和甲苯饱和状态表温度(℃)苯的饱和蒸气压 (kPa) 甲苯的饱和蒸气压(kPa)20 12.75 2.4030 24.38 4.1240 43.63 7.2950 74.33 12.6360 122.51 21.6470 195.83 36.2080 301.56 58.45由表中可以看出,苯和甲苯的饱和蒸气压与温度呈正相关。
饱和蒸气压的增加表明在相同温度下,其蒸发速率也随之增大。
三、不同温度下的饱和蒸气压计算方法及应用苯和甲苯的饱和蒸气压是有实验值验证的,可以采用公式计算。
下面以苯的饱和蒸气压为例进行计算:直接公式法:P=10^(A-B/(C+T))因此,苯的饱和蒸气压公式如下:P(kPa)=10^(6.90565-1211.033/(T+220.7907))利用苯和甲苯的饱和蒸气压,可以进行实际生产中的计算、控制。
如在箱体内放置物品,若知道物品的蒸气压和箱体的容积,就可以通过苯和甲苯的饱和蒸气压计算出所需要的加入量,从而保持箱体内的温度和湿度稳定。
第六章 精馏§1 传质过程概述 6-1 传质过程的定义传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程,称为物质的传递过程,简称传质过程。
日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。
例如某焦化厂里,用水吸收焦炉气中的氨。
OH NH O H NH 423→+。
如图6-1所示。
图6-1 吸收传质示意图再如某酒精厂里,酒精的增浓与提纯。
即利用乙醇与水的沸点不同,或挥发度不同,使乙醇与水分离的过程。
如图6-2所示。
图6-2 精馏传质示意图这两个例子说明,有物质()O H OH H C NH 2523 , , 在相界面的转移过程,都称为传质过程。
6-2 传质过程举例焦化厂的例子,是吸收操作。
——利用组成混合气体的各组分在溶剂中溶解度不同来分离气体混合物的操作,称为吸收操作。
焦炉气中不仅含有3NH ,还有242 , , , H CH CO CO 等气体,利用3NH 易溶于水,以水为吸收剂,使3NH 从焦炉气中分离出来。
吸收主要用来分离气体混合物,所以有的教材称吸收为气体吸收。
如图6-3所示。
图6-3 吸收局部示意图水称为溶剂,3NH 称为溶质,炉气中其他气体称为惰性组分。
用水吸收氯化氢气体)(HCl ,制备盐酸,也是一种吸收操作。
酒精厂的例子,是精馏操作。
——利用液体混合物各组分沸点(或挥发度)的不同,将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。
精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。
传质过程还有,萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分离与提纯的操作过程。
例如用醋酸乙酯萃取醋酸水溶液中的醋酸。
如图6-4所示。
图6-4 萃取示意图此例中醋酸乙酯称为萃取剂)(S ,醋酸称为溶质)(A ,水称为稀释剂)(B 。
萃取操作能够进行的必要条件是:溶质在萃取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。

第二节 两组分理想物系气液平衡5-2-1 两组分理想物系的气液平衡关系所谓理想物系是指液相和气相应符合以下条件:(1)液相为理想溶液,遵循拉乌尔定律。
根据溶液中同分子间与异分子间作用力的差异,可将溶液分为理想溶液和非理想溶液。
严格地说,理想溶液是不存在的,但对于性质极相近、分子结构相似的组分所组成的溶液,例如苯—甲苯、甲醇—乙醇、烃类同系物等都可视为理想溶液。
(2)气相为理想气体,遵循道尔顿分压定律。
当总压不太高(一般不高于104kPa )时气相可视为理想气体。
一、两组分理想物系的相律相律是研究相平衡的基本规律。
相律表示平衡物系中的自由度数、相数及独立组分 数间的关系,即F=C -φ+2 (5-1) 式中 F ——自由度数;C ——独立组分数;φ——相数。
式5-1中的数字2表示外界只有温度和压强这两个条件可以影响物系的平衡状态。
对两组分的气液平衡,其中组分数为2,相数为2,故由相律可知该平衡物系的自由度数为2。
由于气液平衡中可以变化的参数有四个,即温度t 、压强P 、一组分在液相和气相中的组成x 和y (另一组分的组成不独立),因此在t 、P 、x 和y 四个变量中,任意规定其中二个变量,此平衡物系的状态也就被唯一地确定了。
又若再固定某个变量(例如压强,通常蒸馏可视为恒压下操作),则该物系仅有一个独立变量,其它变量都是它的函数。
所以两组分的气液平衡可以用一定压强下的t —x (或y )及x —y 的函数关系或相图表示。
气液平衡数据可由实验室测定,也可由热力学公式计算得到。
二、用饱和蒸汽压和相平衡常数表示气液平衡关系根据拉乌尔定律,理想溶液上方的平衡分压为p A =p A ° x A (5-2) p B =p B °x B =(1-x A ) (5-2a ) 式中 p ——溶液上方组分的平衡分压,Pa ;p °——在溶液温度下纯组成的饱合蒸气压,Pa ;x ——溶液中组成的摩尔分率。

第6章 蒸馏6-1.苯(A )和甲苯(B )的饱和蒸气压数据为定律。
解:000B A BA P P P P x --=;A A A x P P y 0=6-2(1)计算相对挥发度α。
(2)写出平衡方程式。
(3)算出x y -的一系列平衡数据与习题1作比较。
(答:(1) 44.2=α, (2)xx y 44.1144.2+=) 解:⑴00B AP P =α,⑵()xx y 44.1111+=-+=α ⑶由α计算所得的一系列y 、x 值与习题6-1之值很接近。
6-3.将含%24(摩尔分数,下同)易挥发组分的某液体混合物送入一连续精馏塔中。
要求馏出液含%95易挥发组分,釜液含%3易挥发组分。
送至冷凝器的蒸气量为1h kmol 850-⋅,流入精馏塔的回流液量为1h kmol 670-⋅。
试求:(1)每小时能获得多少kmol 的馏出液?多少kmol 的釜液?(2)回流比DL R = 为多少? (答:1h kmol 180-⋅=D , 1h kmol 6.608-⋅=W ;72.3=R )解:D L V +=,1h kmol 180670850-⋅=-=-=L V D ,72.3180670===D L R , W W D F +=+=180,W D F Wx Dx Fx +=即()03.018018095.024.0⨯-+⨯=F F ,解得:1h kmol 6.788-⋅=F ,1h kmol 6.6081806.788-⋅=-=-=D F W 。
6-4.有1h kg 10000-⋅含物质A (摩尔质量为1kmol 8kg 7-⋅ )3.0(质量分数,下同)和含物质B (摩尔质量为1kmol 0kg 9-⋅ )7.0的混合蒸气自一连续精馏塔底送入。
若要求塔顶产品中物质A 的组成为95.0,釜液中物质A 的组成为01.0。
试求:(1)进入冷凝器底蒸气流量为多少?以摩尔流量表示。
(2)回流比R 为多少?(答:(1)1h kmol 116-⋅=V ; (2) 96.1=R )解:W D F +=,W D F Wx Dx Fx +=,⇒1h kg 1.3085-⋅=D ,956.09005.07895.078/95.0=+=D x ,33.0907.0783.078/3.0=+=F x ,53.7890044.078956.0=⨯+⨯=D M ,11.869067.07833.0=⨯+⨯=F M ,1h kmol 11611.8610000-⋅==V ,1h kmol 28.3953.781.3085-⋅==D ,96.1128.391161)1(=-=-=⇒+=D VR D R V 。
化工原理(大学第二版)下册部分答案第8章2. 在温度为25 ℃及总压为101.3 kPa 的条件下,使含二氧化碳为3.0%(体积分数)的混合空气与含二氧化碳为350 g/m 3的水溶液接触。
试判断二氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。
已知操作条件下,亨利系数51066.1⨯=E kPa ,水溶液的密度为997.8 kg/m 3。
解:水溶液中CO 2的浓度为 对于稀水溶液,总浓度为 3t 997.8kmol/m 55.4318c ==kmol/m 3水溶液中CO 2的摩尔分数为由 54* 1.6610 1.44310kPa 23.954p Ex -==⨯⨯⨯=kPa 气相中CO 2的分压为t 101.30.03kPa 3.039p p y ==⨯=kPa < *p故CO 2必由液相传递到气相,进行解吸。
以CO 2的分压表示的总传质推动力为*(23.954 3.039)kPa 20.915p p p ∆=-=-=kPa3. 在总压为110.5 kPa 的条件下,采用填料塔用清水逆流吸收混于空气中的氨气。
测得在塔的某一截面上,氨的气、液相组成分别为0.032y =、31.06koml/m c =。
气膜吸收系数k G =5.2×10-6kmol/(m 2·s ·kPa),液膜吸收系数k L =1.55×10-4 m/s 。
假设操作条件下平衡关系服从亨利定律,溶解度系数H =0.725 kmol/(m 3·kPa)。
(1)试计算以p ∆、c ∆表示的总推动力和相应的总吸收系数;(2)试分析该过程的控制因素。
解:(1) 以气相分压差表示的总推动力为 t 1.06*(110.50.032)kPa 2.0740.725c p p p p y H ∆=-=-=⨯-=kPa 其对应的总吸收系数为6G 1097.4-⨯=K kmol/(m 2·s ·kPa)以液相组成差表示的总推动力为 其对应的总吸收系数为 (2)吸收过程的控制因素气膜阻力占总阻力的百分数为气膜阻力占总阻力的绝大部分,故该吸收过程为气膜控制。
化工原理第二版夏清,贾绍义课后习题解答(夏清、贾绍义主编.化工原理第二版(下册).天津大学出版)社,.)第1章蒸馏1.已知含苯(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃) 85 90 95 100 105x解:利用拉乌尔定律计算气液平衡数据**,由于总压,P1-1查例附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压P AB***t-x可得出液相组成,这样就可以得到一组绘平衡)/(P,则由P = 99kPax= (P-P-P)BAB.图数据。
以t = ℃为例 x =(99-40)/()=同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 时,相应的温度为92℃2.正戊烷(CH)和正己烷(CH)的饱和蒸汽压数据列于本题附表,试求P = 下该溶液的145612平衡数据。
温度 CH 125K CH14 6饱和蒸汽压(kPa)解:根据附表数据得出相同温度下CH(A)和CH(B)的饱和蒸汽压141256*= ℃时 P 以t = ℃时为例,当t = B*= 查得P A得到其他温度下A?B的饱和蒸汽压如下表t(℃) 248 251 279 289*(kPa) P A利用拉乌尔定律计算平衡数据平衡液相组成以℃时为例***)-Pt= ℃时 x = (P-P)/(P 当BAB=()/()= 1平衡气相组成以℃为例*x/P = ×1/ = 1 ℃时当 t= y = P A同理得出其他温度下平衡气液相组成列表如下t(℃) 279 289x 1 0y 1 0根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2的结果相比较。
解:①计算平均相对挥发度**计算出各温度下的相对挥发度理想溶液相对挥发度α= P:/P BA t(℃) α - - - - - - - -取℃和279℃时的α值做平均α= (+)/2 = m②按习题2的x数据计算平衡气相组成y的值当x = 时,y = ×[1+×]=同理得到其他y值列表如下t(℃) 279 289αx 1 0y 1 0'曲线和原先的t-x-y曲线如图③作出新的t-x-y4.在常压下将某原料液组成为(易挥发组分的摩尔)的两组溶液分别进行简单蒸馏和平衡蒸馏,若汽化率为1/3,试求两种情况下的斧液和馏出液组成。
例6-1苯(A)与甲苯(B)的饱和蒸气压和温度的关系数据如本题附表1所式。
试利用拉乌尔定律和相对挥发度,分别计算苯—甲苯混合液在总压P为101.33kPa下的气液平衡数据,并作出温度—组成图。
该溶液可视为理想溶液。
例6-1 附表1温度,℃80.1859095100105110.6,kPa101.33116.9135.5155.7179.2204.2240.0,kPa40.046.054.063.374.386.0101.33解:(1)利用拉乌尔定律,计算气液平衡数据在某一温度下由本题附表1可查得该温度下纯组分苯与甲苯的饱和蒸气压与,由于总压P为定值,即,则用式求液相组成x,再应用式求平衡的气相组成y,即可得到一组标绘平衡温度—组成(t-x-y)图的数据。
以为例,计算过程如下:和其它温度的计算结果列于本题附表2中。
例6-1 附表2t,℃80.1859095100105110.6x 1.0000.7800.5810.4120.2580.1300y 1.0000.9000.7770.6330.4560.2620根据以上数据,即可标绘得到如图所示的t-x-y图。
(2)利用相对挥发度,计算气液平衡数据因苯—甲苯混合液为理想溶液,故其相对挥发度可用下式计算,即:以95℃为例,则:其它温度下的α值列于题附表3中。
通常,在利用相对挥发度法求x-y关系时,可取温度范围内的平均相对挥发度,在本题条件下,附表3中两端温度下的α数据应除外(因对应的是纯组分,即为x-y曲线上两端点),因此可取温度为85℃和105℃下的α平均值,即:将平均相对挥发度代入下式中,即并按附表2中的各x值,由上式即可算出气相平衡组成y,计算结果也列于附表3中。
比较本题附表2和附表3,可以看出两种方法求得的x-y数据基本一致。
对两组分溶液,利用平均相对挥发度表示气液平衡关系比较简便。
例6-1 附表3t,℃80.1 85 90 95 100 105α2.54 2.51 2.46 2.41 2.37x 1.000 0.780 0.581 0.412 0.258 0.130 y 1.000 0.897 0.773 0.633 0.461 0.269例6-2对某两组分理想溶液进行常压闪蒸,已知为0.5(原料液中易挥发组分的摩尔分率),若要求气化率为60%,试求闪蒸后平衡的气液相组成及温度。
例6-1苯(A)与甲苯(B)的饱和蒸气压和温度的关系数据如本题附表1所式。
试利用拉乌尔定律和相对挥发度,分别计算苯—甲苯混合液在总压P为101.33kPa下的气液平衡数据,并作出温度—组成图。
该溶液可视为理想溶液。
例6-1 附表1,kPa,kPa解:(1)利用拉乌尔定律,计算气液平衡数据在某一温度下由本题附表1可查得该温度下纯组分苯与甲苯的饱和蒸气压与,由于总压P为定值,即,则用式求液相组成x,再应用式求平衡的气相组成y,即可得到一组标绘平衡温度—组成(t-x-y)图的数据。
以为例,计算过程如下:和其它温度的计算结果列于本题附表2中。
例6-1 附表2根据以上数据,即可标绘得到如图所示的t-x-y图。
(2)利用相对挥发度,计算气液平衡数据因苯—甲苯混合液为理想溶液,故其相对挥发度可用下式计算,即:以95℃为例,则:其它温度下的α值列于题附表3中。
通常,在利用相对挥发度法求x-y关系时,可取温度范围内的平均相对挥发度,在本题条件下,附表3中两端温度下的α数据应除外(因对应的是纯组分,即为x-y曲线上两端点),因此可取温度为85℃和105℃下的α平均值,即:将平均相对挥发度代入下式中,即并按附表2中的各x值,由上式即可算出气相平衡组成y,计算结果也列于附表3中。
比较本题附表2和附表3,可以看出两种方法求得的x-y数据基本一致。
对两组分溶液,利用平均相对挥发度表示气液平衡关系比较简便。
例6-1 附表3例6-2对某两组分理想溶液进行常压闪蒸,已知为0.5(原料液中易挥发组分的摩尔分率),若要求气化率为60%,试求闪蒸后平衡的气液相组成及温度。
常压下该两组分理想溶液的x-y及t e-x关系如本例附图所示。
解:由题意知所以,在本例附图(x-y图)中通过点e(0.5,0.5)作斜率为-0.667的直线ef,由该直线与x-y平衡曲线交点f的坐标,即可求得平衡的气液相组成,即:再由附图中t e~x曲线,从可求得平衡温度,即例6-3对例6-2中的液体混合物进行简单蒸馏,若气化率仍为60%,试求釜残液组成和馏出液平均组成。
已知常压下该混合液的平均相对挥发度为2.16。
解:设原料液量为100kmol,则:因该混合液平均相对挥发度为,则可用下式求釜残液组成x2,即:或试差解得:馏出液平均组成可由下式求得:即:所以计算结果表明,若气化率相同,简单蒸馏较平衡蒸馏可获得更好的分离效果,即馏出液组成更高。
但是平衡蒸馏的优点是连续操作。
例6-4每小时将15000kg含苯40%(质量%,下同)和甲苯60%的溶液,在连续精馏塔中进行分离,要求釜残液中含苯不高于2%,塔顶馏出液中苯的回收率为97.1%。
试求馏出液和釜残液的流量及组成,以摩尔流量和摩尔分率表示。
解:苯的分子量为78;甲苯的分子量为92。
进料组成:釜残液组成:原料液的平均分子量:原料液流量:依题意知:所以:(a)全塔物料衡算(b)或(c)联立式a、b、c,解得:例6-5分离例6-4中的溶液时,若进料为饱和液体,选用的回流比,试求提馏段操作线方程式,并说明操作线的斜率和截距的数值。
解:由例6-4知:,而因泡点进料,故:将以上数值代入下式,即可求得提馏段操作线方程式:或该操作线的斜率为1.4,在y轴上的截距为-0.0093。
由计算结果可看出,本题提馏段操作线的截距值是很小的,而一般情况下也是如此的。
例6-6用一常压操作的连续精馏塔,分离含苯为0.44(摩尔分率,以下同)的苯—甲苯混合液,要求塔顶产品中含苯不低于0.975,塔底产品中含苯不高于0.0235。
操作回流比为3.5。
试用图解法求以下两种情况时的理论板层数及加料板位置。
(1)原料液为20℃的冷液体。
(2)原料为液化率等于1/3的气液混合物。
已知数据如下:操作条件下苯的气化潜热为389kJ/kg,甲苯的气化潜热为360kJ/kg。
苯—甲苯混合液的气液平衡数据及t-x-y图见例6-1和图解:(1)温度为20℃的冷液进料①利用平衡数据,在直角坐标图上绘平衡曲线及对角线,如本例附图1所示。
在图上定出点a(x D,x D)、点e(x F,x F)和点c(x W,x W)三点。
②,在y轴上定出点b。
联ab,即得到精馏段操作线。
③先按下法计算q值。
原料液的气化潜热为:由图查出进料组成时溶液的泡点为93℃,。
由附录查得在56.5℃下苯和甲苯的比热为1.84kJ/(kg·℃),故原料液的平均比热为:所以:再从点e作斜率为3.76的直线,即得q线与精馏段操作线交于点d。
④联cd,即为提馏段操作线。
⑤自点a开始在操作线和平衡线之间绘梯级,图解得理论板层数为11(包括再沸器),自塔顶往下数第五层为加料板,如本题附图1所示。
(2)气液混合物进料①与上述的①和②两项的结果如本题附图2所示。
③由q值定义知,故:过点e作斜率为-0.5的直线,即得q线。
q线与精馏段操作线交于点d。
④联cd,即为提馏段操作线。
⑤按上法图解得理论板层数为13(包括再沸器),自塔顶往下的第7层为加料板,如附图2所示。
由计算结果可知,对一定的分离任务和要求,若进料热状况不同,所需的理论板层数和加料板的位置均不相同。
冷液进料较气液混合物进料所需的理论板层数为少。
这是因为精馏塔提馏段内循环量增大的缘故,使分离程度增高或理论板数减少。
例6-7在常压连续精馏塔中,分离乙醇—水溶液,组成为(易挥发组分摩尔分率,下同)及的两股原料液分别被送到不同的塔板,进入塔内。
两股原料液的流量之比为0.5,均为饱和液体进料。
操作回流比为2。
若要求馏出液组成为0.8,釜残液组成为0.02,试求理论板层数及两股原料液的进料板位置。
常压下乙醇—水溶液的平衡数据示于此例附表中。
例6-7 附表解:如本例附图1所示,由于有两股进料,故全塔可分为三段。
组成为的原料液从塔较上部位的某加料板引入,该加料板以上塔段的操作线方程与无侧线塔的精馏段操作线方程相同,即:(a)该操作线在y轴上的截距为:两股进料板之间塔段的操作线方程,可按图中虚线范围内作物料衡算求得,即:总物料:(b)易挥发组分:式中——两股进料之间各层板的上升蒸气流量,kmol/h;——两股进料之间各层板的下降液体流量,kmol/h。
(下标s、s+1为两股进料之间各层板的序号)由式(c)可得:(d)因进料为饱和液体,故,,则:(e)式d及式e为两股进料之间塔段的操作线方程,也是直线方程式,它在y轴上的截距为。
其中D可由物料衡算求得。
设,则对全塔作总物料及易挥发组分的衡算,得:,或联立上二式解得:所以对原料液组成为的下一股进料,其加料板以下塔段的操作线方程与无侧线塔的提馏段操作线方程相同。
上述各段操作线交点的轨迹方程分别为:和在x-y直角坐标图上绘平衡曲线和对角线,如本题附图2所示。
依,,及分别作铅垂线,与对角线分别交于a、e1、e2及c四点,按原料F1之加料口以上塔段操作线的截距(0.267),在y轴上定出点b,联ab,即为精馏段操作线。
过点e1作铅垂线(q1线)与ab线交于点d1,再按两股进料板之间塔段的操作线方程的截距(0,1),在y轴上定出点b’,联b’d1,即为该段的操作线。
过点e2作铅垂线(q2线)与b’d1线交于点d2,联cd2即得提馏段操作线。
然后在平衡曲线和各操作线之间绘梯级,共得理论板层数为9(包括再沸器),自塔顶往下的第5层为原料F1的加料板,自塔顶往下的第8层为原料F2的加料板。
例6-8根据例6-6的数据,试求实际回流比为最小回流比的倍数。
解:R min由下式计算,即:(1)冷液进料由例6-6附图1查出q线与平衡线的交点坐标为:,故实际回流比,则:或(2)气液混合物进料由例6-6附图2查出q线与平衡线的交点坐标为:,故或计算结果表明,进料热状况不同,最小回流比并不相同。
本题条件下,冷液进料时实际回流比为最小回流比的3.1倍,所取得倍数较大。
气液混合物进料时R为R min的1.7倍,一般可视为比较适宜。
由此可见,对不同的进料热状况,应选取不同的操作回流比。
当然,适宜的回流比应通过经济衡算决定。
例6-9利用例6-8的结果,用简洁法重算例6-6中气液混合物进料时的理论板层数和加料板位置。
塔顶、进料和塔底条件下纯组分和饱和蒸气压列于本例附表中。
例6-9 附表解:例6-6已知条件为:,,及。
例6-8算出的结果为。
(1)求平均相对挥发度塔顶进料塔底全塔平均相对挥发度为:精馏段平均相对挥发度为:(2)求全塔理论板层数由芬斯克方程式知:且由吉利兰图查得:即解得:(不包括再沸器)若用式(*),(,,)计算N,则:解得:(不包括再沸器)因,在(*)式的适用条件以内,故计算结果与查图所得的结果一致。
(3)求精馏段理论板层数前已查出即解得:故加料板为从塔顶往下的第7层理论板。
以上计算结果与例6-6的图解结果基本一致。
例6-10求例6-6中冷夜进料情况下的再沸器热负荷和加热蒸气消耗量以及冷凝气热负荷和冷却水消耗量。
已知数据如下:(1)原料液流量为15000kg/h。
(2)加热蒸汽绝压为200kPa,冷凝液在饱和温度下排出。
(3)冷却水进、出冷凝器的温度分别为25℃及35℃。
假设热损失可忽略。
解:由精馏塔的物料衡算求D和W,即,而原料液的平均分子量为:故及解得:,精馏段上升蒸气量为:提馏段上升蒸气量为:冷凝器的热负荷为:由于塔顶馏出液几乎为纯苯,为简化起见,焓可按纯苯的进行计算。
若回流液在饱和温度下进入塔内,则:所以冷却水消耗量为:再沸器的热负荷为:同样,因釜残液几乎为纯甲苯,故其焓可按纯甲苯进行计算,即:所以由附录查得时水的气化潜热为2205kJ/kg加热蒸气消耗量为:例6-11将二硫化碳和四氯化碳混合液进行恒馏出液组成的间歇精馏。
原料液量为50kmol,组成为0.4(摩尔分率,下同),馏出液组成为0.95(维持恒定),釜液组成达到0.079时即停止操作,设最终阶段操作回流比为最小回流比的1.76倍,试求:(1)理论板层数;(2)气化总量。
操作条件下物系的平衡数据列于本例附表1中。
例6-11 附表1解:(1)求理论板层数在x-y图上绘平衡曲线和对角线,如本例附图1所示。
在该图上查得:当时,与之平衡的,则:所以而在附图1上,联点a(,)和点b(在y轴上的截距为0.08),直线ab即为操作线。
从点a开始在平衡线和操作线间绘梯级,直至止,共需7层理论板。
(2)求气化总量由下式可知:以为截距在x-y图上作操作线,然后从点a开始绘7层梯级,最后一级对应的液相组成为,所得结果列于本例附表2中。
例6-11 附表2(由图中读出)在直角坐标上标绘和的关系曲线,如本例附图2所示。
由图可读得釜液组成从变至时,曲线所包围的面积为2.90个单位,即:所以例6-12有一含正丁烷0.2、正戊烷0.5和正己烷0.3(均为摩尔分率)的混合液,试求压强为101.33×104Pa 时的泡点温度及平衡的气相组成。