2018-2019海淀高三理综一模化学试题
- 格式:docx
- 大小:927.30 KB
- 文档页数:9

2019年4月北京市海淀区2019届高三下学期一模考试化学试卷★祝考试顺利★可能用到的相对原子质量:H 1C 12 O 16 I 1271.纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。
下列文物修复和保护的过程中涉及化学变化的是A. AB. BC. CD. D【答案】A【解析】【详解】A.银器表面锈蚀物成分大多数为氧化银、氯化银、硫化银等,除此外还常会有银合金里所含铜质的腐蚀产物。
对于锈层含较多绿锈的,可以考虑使用甲酸溶液,甲酸能有效的分解含铜矿化物,而对银不起作用;对于银器表面变色较深,锈层较厚重的,要考虑用电化学还原的方法处理,涉及到了化学变化,故A符合题意;B.变形的金属香炉复原主要原理是通过施加外力使器物恢复原状,未涉及化学变化,故B不符合题意;C.古画水洗除尘是用羊毛排笔蘸温水淋于画上,等画完全浸透进水,在用毛巾蘸干画上的水分,如此进行多次,直到毛巾中挤出的水由污黄浑浊变得澄清透明为止,说明基本将画中的污渍清除干净,未涉及化学变化,故C不符合题意;D.木器表面擦拭烫蜡是蜂蜡本身的熔点很低,可以用吹风机对固体蜂蜡吹一会,会有稍微融化,此时把软化的蜂蜡大致涂到木头上,再用吹风机的热风吹涂好蜂蜡的木器,使蜂蜡融化,完全覆盖木器,然后用棉布把多余的蜂蜡擦掉,再用热风吹,使蜂蜡更好的渗入木头当中,未涉及化学变化,故D不符合题意。
答案选A。
2.下列事实不能..用元素周期律解释的是A. 碱性:NaOH>LiOHB. 热稳定性:Na2CO3>NaHCO3C. 酸性:HClO4> H2SO4D. 气态氢化物的稳定性:HBr > HI【答案】B【解析】【详解】A.元素金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性Na>Li,则碱性:NaOH>LiOH,能用元素周期律解释,故A不符合题意;B.碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,与元素周期律无关,故B符合题意;C.元素非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性Cl> S,则酸性:HClO4> H2SO4,能用元素周期律解释,故C不符合题意;D.元素非金属性越强,气态氢化物的稳定性越强,非金属性Br >I,则气态氢化物的稳定性:HBr > HI,能用元素周期律解释,故D不符合题意。

2018-2019海淀高三理综一模化学试题可能用到的相对原子质量:H 1C 12 O 16 I 1271.纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。
下列文物修复和保护的过程中涉及化学变化的是A B C D银器用除锈剂见新变形的金属香炉复原古画水洗除尘木器表面擦拭烫蜡A. AB. BC. CD. D2.下列事实不能..用元素周期律解释的是A. 碱性:NaOH>LiOHB. 热稳定性:Na2CO3>NaHCO3C. 酸性:HClO4>H2SO4D. 气态氢化物的稳定性:HBr > HI3.下列实验沉淀的过程中,与氧化还原反应无关..的是A B C D实验将NaOH溶液滴入FeSO4溶液将SO2通入稀硝酸酸化的BaCl2溶液将Cl2通入稀硝酸酸化的AgNO3溶液将生石灰投入饱和Na2CO3溶液现象产生白色沉淀,最终变为红褐色产生白色沉淀产生白色沉淀产生白色沉淀A. AB. BC. CD. D4.辣椒素是影响辣椒辣味的活性成分的统称,其中一种分子的结构如下图所示。
下列有关该分子的说法不正..确.的是A. 分子式为C18H27NO3B. 含有氧原子的官能团有3种C. 能发生加聚反应、水解反应D. 该分子不存在顺反异构5.我国科学家在绿色化学领域取得新进展。
利用双催化剂Cu和Cu2O,在水溶液中用H原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。
下列有关说法不正确...的是A. CO2生成甲醇是通过多步还原反应实现的B. 催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒C. 该催化过程中只涉及化学键的形成,未涉及化学键的断裂D. 有可能通过调控反应条件获得甲醛等有机物6.三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)SiHCl3(g)+H2(g),同时还有其他副反应发生。


海淀区高三年级第二学期期末练习理科综合能力测试可能用到的相对原子质量:H l C 12 N 14 0 16 K 39 Mn 55第一部分(选择题共120分)本部分共20道小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.港珠澳大桥被称为“现代世界新七大奇迹”之一,涵盖了当今世界岛隧桥多项尖端科技,化工行业在这座宏伟的“超级工程”中发挥了巨大作用。
下列材料的生材属于无机材料的是A.高强度耐腐蚀钢筋B.超高分子量聚乙烯纤维C.大尺寸橡胶隔震支座D.高韧薄层沥青罩面7.化学与人类生活密切相关,下列说法与氧化还原反应无关的是A.油炸食品酸败变质B.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯C.服用阿司匹林出现水杨酸反应时静脉滴注NaHCO3溶液D.生吃新鲜蔬菜比熟吃时维生素C的损失小8. 2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,其118种元素。
短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下到说法不正确的是A.最高价氧化物对应水化物的酸性:Z>YB.W的氢化物与Z的氢化物反应,产物的水溶液呈碱性C.在元素周期表中,117号元素与Z元素位于同一主族D.工业上常用YX2漂白纸浆、毛、丝等9.下列化学用语的表述正确的是A.钢铁吸氧腐蚀中的正极反应:B.由Na和Cl形成离子键的过程:C.NaHCO3的水解平衡:D.实验室制乙炔的反应:10.汽车尾气处理存在反应:,该反应过程及能量变化如图所示:下列说法正确的是A.升高温度,平衡正向移动B.该反应生成了具有非极性共价键的CO2C.使用催化剂可以有效提高反应物的平衡转化率D.反应物转化为活化络合物需要吸收能量11.聚乙烯胺可用于合成染料Y,增加纤维着色度,乙烯胺(CH2=CHNH2)不稳定,所以聚乙烯胺常用聚合物X水解法制备。
下列说法不正确的是A.乙烯胺与CH3CH=NH互为同分异构体B.测定聚乙烯胺的平均相对分子质量,可得其聚合度C.聚合物X在酸性或碱性条件下发生水解反应后的产物相同D.聚乙烯胺和R-N=C=S合成聚合物Y的反应类型是加成反应12.某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。

2018年海淀区高三一模综化学2018.4.11 6.平昌冬奥会“北京8分钟”主创团队用石墨烯制作了-20 o C能发热 4 h的智能服饰;用铝合金管材和碳纤维制作了高 2.35m、重量仅为10 kg的熊猫木偶,向世界展现了新时代的中国形象。
下列说法中,不正确...的是A. 石墨烯是能导热的金属材料B. 铝合金是密度较低的金属材料C. 碳纤维是耐低温的无机非金属材料D. 新型材料种类多、用途广7. 下列用于解释事实的化学用语中,不正确...的是A.Na2S溶液显碱性:S2- + 2H2O H2S+ 2OH-B.K2Cr2O7溶液中含有CrO42-:Cr2O72-+ H2O 2CrO42- + 2H+C.盛放NaOH溶液的试剂瓶不能用玻璃塞:2OH- +SiO2SiO32- + H2OD.红热木炭遇浓硫酸产生刺激性气味气体:2H2SO4(浓) + C CO2↑+ 2SO2↑+ 2H2O8. 下列物质用途与物质性质的对应关系中,不正确...的是物质用途解释A 家用水壶中的水垢可用白醋浸泡除去白醋中的乙酸具有酸性B 家用消毒柜用紫外线照射的方式对餐具进行消毒灭菌蛋白质在紫外线照射下发生变性C 食品工业中以植物油和氢气为原料制造氢化植物油植物油在一定条件下能发生取代反应D 工业上用玉米淀粉为原料制备葡萄糖淀粉在一定条件下能水解转化成葡萄糖9.“空气吹出法”海水提溴的工艺流程如下:下列说法正确的是A. 进入吹出塔前,Br-被还原成了Br2B. 从吹出塔进入吸收塔的物质只有Br2C. 经过吸收塔后,溴元素得到了富集△D. 蒸馏塔中只发生了物理变化10.以甲烷为原料合成甲醇的反应如下:反应ⅠCH4(g) + CO2(g) 2CO(g) + 2H2(g)△H1 = +247 kJ·mol-1反应ⅡCO(g) + 2H2(g) CH3OH(g) △H2 = -90 kJ·mol-1已知:T1℃时,反应Ⅱ的平衡常数数值为100;T2℃时,反应Ⅱ在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol·L-1)分别为0.05、0.1、0.1。

2018年海淀区高三年级一模化学部分6.下列做法对改善大气质量无益..的是 A .推广使用无铅汽油B .在农田中焚烧秸秆为土地施肥C .开发利用太阳能、氢能等新能源D .在汽车尾气系统中安装催化转化器 7.下列说法正确的是A .硫酸钠溶液和醋酸铅溶液均能使蛋白质变性B .油脂是高级脂肪酸的甘油酯,均不能发生氢化反应C .H 2N —CH 2—COOH 既能与盐酸反应、又能与氢氧化钠溶液反应 D.合成橡胶 的单体之一是8.X 、Y 、Z 、W 是分别位于第2、3周期的元素,原子序数依次递增。
X 与Z 位于同一主族,Y 元素的单质既能与盐酸反应也能与NaOH 溶液反应,Z 原子的最外层电子数是次外层电子数的一半,Y 、Z 、W 原子的最外层电子数之和为14。
下列说法正确的是A .原子半径由小到大的顺序:X< Y < Z< WB .Z 的最高价氧化物能与水反应生成相应的酸C .Y 单质在一定条件下可以与氧化铁发生置换反应D .室温下,0.1 mol/L W 的气态氢化物的水溶液的pH > 1 9.下列实验方案不能达到实验目的的是 10.海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。
下列说法不正确...的是 A .可用BaCl 2溶液除去粗盐中的SO 42-B .从苦卤中提取Br 2的反应的离子方程式为: 2Br - + Cl 2 == 2Cl - + Br 2C .试剂1可以选用石灰乳D .工业上,电解熔融Mg(OH)2冶炼金属镁 11.下列说法不正确的是 12B .溶液①、②等体积混合后pH > 7,则c (NH 4+)< c (NH 3·H 2O)C .向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c (NH 4+):①>②D .向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH 溶液后,两溶液中的离子种类相同 25. (14分)工业上利用CO 和水蒸气在一定条件下发生反应制取氢气:CO(g)+H 2O(g) CO 2(g)+H 2(g)△H =-41kJ/mol某小组研究在相同温度下该反应过程中的能量变化。

2018年海淀区高三一模化学测试题可能用到的相对原子质量:H-1 N-14 O-161 .下列说法正确的是A. 植物油的主要成分是高级脂肪酸B. 银氨溶液可用于检验淀粉是否完全水解C. 溴乙烷与氢氧化钠水溶液反应可制取乙烯D. 丙氨酸(CfCHCOOH缩聚产物的结构简式为KfNHCHCOlMH2.实验:① 向盛有1 mL 0.1 mol/L MgCl 2溶液试管中加1 mL 0.2CH31/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。
②向沉淀c中滴加0.1mol/L FeC3溶液,沉淀变为红褐色。
F列分析不正确的是2+ —A. 浊液a中存在沉淀溶解平衡:Mg (OH) 2(s)・一-Mg (aq) + 2OH (aq)B. 滤液b中不含有Mg2+C. ②中颜色变化说明Mg (OH)转化为Fe(OH)D. 实验可以证明Fe(OH3比Mg (OH)更难溶3 .下列说法正确的是A. 油脂都不能使溴水褪色B. 氨基酸是两性化合物,能与酸、碱反应生成盐C. 福尔马林可用作食品防腐剂D. 蔗糖和麦芽糖的水解产物都是葡萄糖用下列各组仪器或装置,不能达到实验目的的是A. a组:制备少量乙酸乙酯B. b组:除去粗盐水中的泥沙C. c组:用CC4提取碘水中的碘D. d 组:配制100 mL 1.00 mol/L NaCl 溶液5 .下列解释事实的离子方程式不正确的是A. 氯化钢溶液显酸性:!-B. 氯气使湿润的淀粉KI试纸变蓝:'r'--C向硫酸铝溶液中加入氨水出现白色胶状沉淀:'D.实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:6•下列用品的主要成分及用途对应不正确..的是7•下列方程式不能.正确解释相关事实的是O-OHA. 碳酸的酸性强于苯酚:CC2+H2O+ .f^+HC Q-2A1:O3(熔融〕笔4A1 - 30二tB. 工业上用氧化铝冶炼金属铝:C. 浓硫酸具有强氧化性: C + 2H2SC4 (浓)-上- 2SC2T + CQJ + 2也0D. 金属铜能溶解于稀硝酸:Cu+ 4H++ 2NO3-=== C L T+ 2NO2 t + 2威0向容量瓶中转移液体8•下列实验装置或操作正确的是血计9•如图所示的钢铁腐蚀中,下列说法正确的是A. 碳表面发生氧化反应C. 生活中钢铁制品的腐蚀以图①所示为主===40H" 10.下列颜色变化与氧化还原反应无关..的是②B. 钢铁被腐蚀的最终产物为FeO D. 图②中,正极反应式为02 + 4e + 2H2OA. 将乙醇滴入酸性K2C0O7溶液中,溶液由橙色变为绿色B. 将S02通入滴有酚酞的NaOH溶液中,溶液红色褪去C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去D. 将乙醛加入新制Cu(OH》悬浊液中并加热至沸腾,出现红色沉淀11不考虑现代物理手段,溶液中离子的定性检验有三种基本方法,①沉淀法(观察反应中沉淀的发生或消失)、②气体法(观察反应中气体的产生及其验证)、③显色法(观察颜色变化)。

2018-2019海淀高三理综一模化学试题可能用到的相对原子质量:H 1C 12 O 16 I 127A B C D7.下列事实不能..用元素周期律解释的是A.碱性:NaOH>LiOHB.热稳定性:Na2CO3>NaHCO3C.酸性:HClO4>H2SO4D.气态氢化物的稳定性:HBr > HI8.下列实验沉淀的过程中,与氧化还原反应无关..的是分子的说法不正确...的是A. 分子式为C18H27NO3B. 含有氧原子的官能团有3种C. 能发生加聚反应、水解反应D. 该分子不存在顺反异构10. 我国科学家在绿色化学领域取得新进展。
利用双催化剂Cu和Cu2O,在水溶液中用H原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。
下列有关说法不.正确..的是A.CO2生成甲醇是通过多步还原反应实现的B.催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒C.该催化过程中只涉及化学键的形成,未涉及化学键的断裂D.有可能通过调控反应条件获得甲醛等有机物原料,制备反应的方程式为Si(s)+3HCl(g)SiHCl3(g)+H2(g),同时还有其他副反应发生。
当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如右图所示。
下列说法正确的是A.降低压强有利于提高SiHCl3的产率B.制备SiHCl3的反应为放热反应C.温度为450 K,平衡常数:K(x)>K (y)>K (z)D.增加HCl的用量,SiHCl3的产率一定会增加12.某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。
经查阅资料可知浓硝酸分解产生NO2和O2。
为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用右图装置完成以下实验:下列说法正确的是A.浓硝酸分解产生的V(NO2):V(O2)=1:1B.红棕色气体的产生表明木炭与浓硝酸发生了反应C.能使液面上木炭迅速燃烧发出亮光的主要气体是氧气D.以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO225.(17分)“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。


海淀区高三年级第二学期期中练习理科综合能力测试2019.4 本试卷j是14页.J是300分。
1J试ll·J l夭150分钟•a号牛.务必将答案特征答是西纸上,在试卷上作答龙效.考试结束l斤.将本试卷白l科炮’纸.Jl交ju],可能用到的栩刘n;r r ,世iii::IT I C 12 0 16 I 127第一部分(选择题共120分)本部分共20边小题.在:J /J、也6分,:;1-t:120分。
在每小题列出的四个选项中电选出主主符合题目要求的一项。
6.纪最片《我在故宫修文物》表现了文物修复者穿越古今与忏年之前的人迸f rX-t话的职业体验.让我们领略到历史与文化的传承。
r111文物修复和保护的过程中涉及化学变化的是A B c D专肖r4° I IHi水洗除尘| 木器表面擦拭烫跻A j8 I CI D 撒向阴阳滴入,.S02逼人稀硝酸j llff Cl 21i入I ’辄棚!阳BaCl 2棚1化的A ����M 叫巳1:::入饱和|靠自嘘声,最|产生白色沉淀|问白阶楠 1 跚a I I 1 -革时已沉淀|产生白色沉淀“白弱性成分的蜘.其中一种分平的给她hn -i:-阳二一川厅,叫唱叫且U 「问月If凉。
下列有关该分子·��~γY海淀区高三年级第二学期期中练习化学参考答案2019.4第I卷(选择题共42分)共第II卷(非选择题共58分)阅卷说明:1. 不出现0.5分,最低0分,不出现负分。
2. 简答题文字表述中划线部分为给分点。
3. 其他合理答案可酌情给分。
25.(17分)(1)醛基和溴原子(-CHO、-Br)(2分)(2)取代反应(2分)(3)ab (一个1分,错选扣1分,最低0分)(2分)(4)(2分)(5)(2分)(6)(2分)(7)H:I:J:(各1分,共3分)1(8)或或(结构合理给分)(2分)26.(12分)(1)O H(1分)(2)ii.=== + O2↑+ 2H+(2分)(3)从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快(1分);但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降(1分),所以,温度从40℃上升到50℃,反应速率不基本不变。
2018年海淀区高三一模化学 测试题可能用到的相对原子质量:H-1 N-14 O-161.下列说法正确的是A .植物油的主要成分是高级脂肪酸B .银氨溶液可用于检验淀粉是否完全水解C .溴乙烷与氢氧化钠水溶液反应可制取乙烯D .丙氨酸(CH 3CHCOOH )缩聚产物的结构简式为 2.实验:① 向盛有1 mL 0.1 mol/L MgCl 2溶液试管中加液a ,过滤得到滤液b 和白色沉淀c 。
② 向沉淀c 中滴加0.1mol/L FeCl 3溶液,沉淀变为红褐色。
下列分析不正确...的是 A .浊液a 中存在沉淀溶解平衡:Mg (OH) 2(s)Mg 2+(aq)+2OH -(aq)B .滤液b 中不含有Mg 2+C .②中颜色变化说明Mg (OH)2转化为Fe(OH)3D .实验可以证明Fe(OH)3比Mg (OH)2更难溶3.下列说法正确的是A .油脂都不能使溴水褪色B .氨基酸是两性化合物,能与酸、碱反应生成盐C .福尔马林可用作食品防腐剂D .蔗糖和麦芽糖的水解产物都是葡萄糖4.用下列各组仪器或装置,不能达到实验目的的是A .a 组:制备少量乙酸乙酯B .b 组:除去粗盐水中的泥沙C .c 组:用CCl 4提取碘水中的碘D .d 组:配制100 mL 1.00 mol/L NaCl 溶液 5.下列解释事实的离子方程式不正确的是 A .氯化钢溶液显酸性:B .氯气使湿润的淀粉KI 试纸变蓝:C .向硫酸铝溶液中加入氨水出现白色胶状沉淀:D .实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:NH 26.下列用品的主要成分及用途对应不正确...的是7.下列方程式不能..正确解释相关事实的是 A .碳酸的酸性强于苯酚:CO 2+H 2O+-OH+HCO 3-B .工业上用氧化铝冶炼金属铝:C .浓硫酸具有强氧化性:C + 2H 2SO 4(浓)2SO 2↑+ CO 2↑+ 2H 2OD .金属铜能溶解于稀硝酸:Cu + 4H ++ 2NO 3- === Cu 2++ 2NO 2↑+ 2H 2O 8.下列实验装置或操作正确的是9.如图所示的钢铁腐蚀中,下列说法正确的是①②A.碳表面发生氧化反应B.钢铁被腐蚀的最终产物为FeO C.生活中钢铁制品的腐蚀以图①所示为主D.图②中,正极反应式为O2 + 4e- + 2H2O === 4OH-10.下列颜色变化与氧化还原反应无关..的是A.将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色B.将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去C.将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去D.将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀11不考虑现代物理手段,溶液中离子的定性检验有三种基本方法,①沉淀法(观察反应中沉淀的发生或消失)、②气体法(观察反应中气体的产生及其验证)、③显色法(观察颜色变化)。
2018海淀区高三一模化学试卷及答案6.平昌冬奥会“北京8 分钟”主创团队用石墨烯制作了-20C能发热 4 h 的智能服饰; 用铝合金管材和碳纤维制作了高 2.35m、重量仅为10kg 的熊猫木偶,向世界展现了新时代的中国形象。
下列说法中,不正确的是A.石墨烯是能导热的金属材料B.铝合金是密度较低的金属材料C.碳纤维是耐低温的无机非金属材料D.新型材料种类多、用途广7.下列用于解释事实的化学用语中,不正确的是A.Na2S溶液显碱性: S2-+ 2H2O H2S + 2OH-B.K2Cr2O7溶液中含有CrO42-:Cr2O72- + H2O2CrO42- + 2H+C.盛放NaOH 溶液的试剂瓶不能用玻璃塞: 2OH-+ SiO2=SiO32-+ H2OD.红热木炭遇浓硫酸产生刺激性气味气体: 2H2SO4( 浓)+C △CO2↑+2SO2↑+2H2O8.下列物质用途与物质性质的对应关系中,不正确的是物质用途物质性质A 家用水壶中的水垢可用白醋浸泡除去白醋中的乙酸具有酸性B 家用消毒柜用紫外线照射的方式对餐具进行消毒灭菌蛋白质在紫外线照射下发生变性C 食品工业中以植物油和氢气为原料制造氢化植物油植物油在一定条件下能发生取代反应D 工业上用玉米淀粉为原料制备葡萄糖淀粉在一定条件下能水解转化成葡有糖9.“空气吹出法”海水提漠的工艺流程如下:下列说法中,正确的是A.进人吹出塔前,Br -被还原成了Br2B.从吹出塔进人吸收塔的物质只有Br2C.经过吸收塔后,溴元素得到了富集D.蒸馏塔中只发生了物理变化10.以甲烷为原料合成甲醇的反应如下:反应I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) △H1= +247 kJ/mol反应II:CO(g) + 2H2(g)CH3OH(g) △H2=-90kJ/mol已知: T℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。
北京市海淀区2018届高三一模理科综合化学试题1. 平昌冬奥会北京8分钟”主创团队用石墨烯制作了-20 C能发热4 h的智能服饰;用铝合金管材和碳纤维制作了高 2.35m、重量仅为10kg的熊猫木偶,向世界展现了新时代的中国形象。
下列说法中,不正确的是A.石墨烯是能导热的金属材料B.铝合金是密度较低的金属材料C.碳纤维是耐低温的无机非金属材料D.新型材料种类多、用途广【答案】A【解析】A、石墨烯不属于金属材料,属于非金属材料,故A说法错误;B、铝的密度较小,因此铝合金是密度较低的金属材料,故B说法正确;C、根据信息,用石墨烯制作了-20C能发热4h的智能服饰,碳纤维是由碳单质构成的,碳纤维是耐低温的的无机非金属材料,故C说法正确;D、新型材料包括合金材料、合成材料、无机非金属材料。
复合材料等,用途广泛,如涉及军事、信息等领域,故D说法正确。
2. 下列用于解释事实的化学用语中,不正确的是2- -A. Na2S 溶液显碱性:S + 2H2O ------ H2S + 2OHB. K262O7 溶液中含有CrO42-:Cr2O72-+ H2O ------------ 2CrO42-+ 2H- 2-C. 盛放NaOH溶液的试剂瓶不能用玻璃塞:2OH + SiO2=SiO3 + H2OD. 红热木炭遇浓硫酸产生刺激性气味气体:2H2SO4(浓)+C CO2T +2SOT +2HO【答案】A【解析】A、S2「属于多元弱酸根,应分步水解,即为S2「+ H2O—HS「+ OH「、HS「+H2O :H2S+ OH「,故A 错误;B、K2CHO7溶液中含有CrO42一:C"O72一+ H2O ' 2CrO42—+ 2H十,故B说法正确;C、磨口玻璃塞中的SiO2属于酸性氧化物,能与NaOH反应SiO?+ 2OH _=SiO 32「+ H2O,造成玻璃塞与瓶体黏合在一起,因此盛放碱性溶液的试剂瓶用橡胶塞,故C说法正确;D、浓硫酸具有强氧化性,在加热条件下,能与木炭发生反应,。
2018年各区一模试题汇编(海淀)26. (14分)图1所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
图1(1)结合上图判断下列说法正确的是(填字母序号)。
A. 固氮过程中,N 2只做氧化剂B. 在硝化细菌作用下发生的硝化过程需要有氧化剂参与C. 反硝化过程有助于弥补人工固氮对氮循环造成的影响D. 同化、氨化过程中,氮元素均从无机物转移至有机物(2)硝化过程中,NH 3转化成HNO 2的反应的化学方程式为 。
(3)反硝化过程中,CH 3OH 可作为反应的还原剂,请将该反应的离子方程式补充完整:5CH 3OH + 6NO 3-□N 2↑ + 4HCO 3- +□ +□(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式: 。
共价键 N ≡N H —H N —H 断开1mol 共价键所需能量(kJ ) 946436391(5)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。
电解法合成氨的两种原理及装置如图2和图3所示。
①图2中,A 电极上通入的X 为 。
②图3中,D 电极上的电极反应式为 。
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为 。
图2 图3反硝化 细菌27.(12分)金属镍具有较高的经济价值,工业上采用一定方法处理含镍废水使其达标排放并回收镍。
某电镀废水中的镍主要以NiR2络合物形式存在,在水溶液中存在以下平衡:NiR2 (aq)Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2生成NiS沉淀进而回收镍。
①该反应的离子方程式为_________________________________。
②NiS沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是_____________________、_____________________。
2018-2019海淀高三理综一模化学试题可能用到的相对原子质量:H 1 C 12 O 16 I 127A B C D7.下列事实不能..用元素周期律解释的是A.碱性:NaOH >LiOH B.热稳定性:Na2CO3>NaHCO3 C.酸性:HClO4>H2SO4D.气态氢化物的稳定性:HBr > HI8.下列实验沉淀的过程中,与氧化还原反应无关..的是该分子的说法不正确...的是A. 分子式为C18H27NO3B. 含有氧原子的官能团有3种C. 能发生加聚反应、水解反应D. 该分子不存在顺反异构10. 我国科学家在绿色化学领域取得新进展。
利用双催化剂Cu和Cu2O,在水溶液中用H原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。
下列有关说法不.正确..的是A.CO2生成甲醇是通过多步还原反应实现的B.催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒C.该催化过程中只涉及化学键的形成,未涉及化学键的断裂D.有可能通过调控反应条件获得甲醛等有机物原料,制备反应的方程式为Si(s)+3HCl(g)SiHCl3(g)+H2(g),同时还有其他副反应发生。
当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如右图所示。
下列说法正确的是A.降低压强有利于提高SiHCl3的产率B.制备SiHCl3的反应为放热反应C.温度为450 K,平衡常数:K(x)>K (y)>K (z)D.增加HCl的用量,SiHCl3的产率一定会增加12. 某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。
经查阅资料可知浓硝酸分解产生NO2和O2。
为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用右图装置完成以下实验:A.浓硝酸分解产生的V(NO2):V(O2)=1:1B.红棕色气体的产生表明木炭与浓硝酸发生了反应C.能使液面上木炭迅速燃烧发出亮光的主要气体是氧气D.以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO225.(17分)“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。
合成线路如下图所示:已知:(1)化合物A的官能团是________。
(2)反应①的反应类型是________。
(3)关于B和C,下列说法正确的是________(填字母序号)。
a.利用质谱法可以鉴别B和Cb.B可以发生氧化、取代、消去反应c.可用酸性高锰酸钾溶液检验C中含有碳碳三键(4)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为_________。
(5)反应②的化学方程式为_________。
(6)E的结构简式为________。
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:(8)聚合物F的结构简式为________。
26.(12分)羟基自由基(·OH,电中性,O为-1价)是一种活性含氧微粒。
常温下,利用·OH处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH的电子式为________。
(2)pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。
将ii 补充完整。
i. Fe2+ + H2O2 + H+ === Fe3+ + H2O +·OHii. ___ + ___ === ___ + O2↑ + 2H+(3)已知:羟基自由基容易发生猝灭2·OH === H2O2。
用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如图1所示。
0~20 min 时,温度从40℃上升到50℃,反应速率基本不变的原因是________。
图1 图2(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图2所示。
已知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH并迅速与苯酚反应。
①b极连接电源的________极(填“正”或“负”)。
②a极的电极反应式为________。
③电解液中发生的主要反应方程式为________。
27.(13分)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。
生产流程如下图所示:(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3c.热空气吹出d.降低阳极区液面上方的气压(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。
IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。
通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。
已知:吸光度越高表明该体系中c(I2)越大。
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。
吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mg•L-1时对离子交换膜影响可忽略。
现将1 m3含I--1 浓度为1.47 mg•L-1 的食盐水进行处理,为达到使用标准,理论上至少..需要0.05 mol•L NaClO溶液________L。
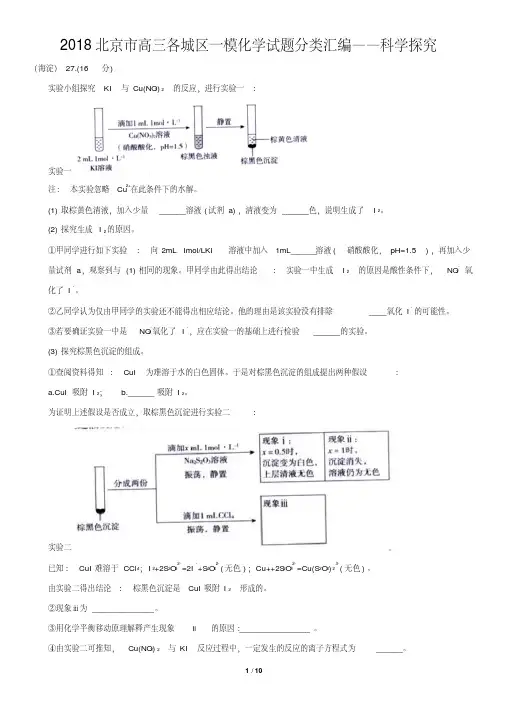
(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)28.(16分)某实验小组对FeCl 3分别与Na 2SO 3、NaHSO 3的反应进行探究。
装置(1)配制FeCl 3溶液时,先将FeCl 3溶于浓盐酸,再稀释至指定浓度。
结合化学用语说明浓盐酸的作用: 。
(2)甲同学探究实验I 的电极产物。
① 取少量Na 2SO 3溶液电极附近的混合液,加入 ,产生白色沉淀,证明产生了24SO -。
② 该同学又设计实验探究另一电极的产物,其实验方案为 。
(3)实验I 中负极的电极反应式为 。
【乙同学的实验】乙同学进一步探究FeCl 3溶液与NaHSO 3溶液能否发生反应,设计、完成实验并记录(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe 3+ + 33HSO -Fe(OH)3 + 3SO 2; ② 。
(5)查阅资料:溶液中Fe 3+、23SO -、OH -三种微粒会形成红色配合物并存在如下转化:从反应速率和化学平衡两个角度解释1~30 min 的实验现象: 。
(6)解释30 min 后上层溶液又变为浅红色的可能原因: 。
【实验反思】(7)分别对比I 和II 、II 和III ,FeCl 3能否与Na 2SO 3或NaHSO 3发生氧化还原反应和有关(写出两条)。
海淀区高三年级第二学期期中练习化学参考答案2019.4第I卷(选择题共42分)共第II卷(非选择题共58分)阅卷说明:1. 不出现0.5分,最低0分,不出现负分。
2. 简答题文字表述中划线部分为给分点。
3. 其他合理答案可酌情给分。
25.(17分)(1)醛基和溴原子(-CHO、-Br)(2分)(2)取代反应(2分)(3)ab (一个1分,错选扣1分,最低0分)(2分)(4)(2分)(5)(2分)(6)(2分)(7)H:I:J:(各1分,共3分)(8)或或(结构合理给分)(2分)26. (12分)(1)O H(1分)(2)ii.=== + O2↑ + 2H+(2分)(3)从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快(1分);但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降(1分),所以,温度从40℃上升到50℃,反应速率不基本不变。
(2分)(4)①正(2分)②O2 + 2e- + 2H+ === H2O2(2分)③Fe2+ + H2O2 + H+ === Fe3+ + H2O + ·OH (1分)(答案合理给分,如H2O2 === 2·OH )C6H6O + 28·OH === 6CO2 + 17H2O (2分)27.(13分)(1)2 NaCl + 2H2O C12↑ + H2↑+ 2NaOH (2分)(2)bcd (2分)(正选2个无错选得1分;选4个得1分;其余如选3个错选1个不得分)(3)①碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子(划线为2点,答出1点即得1分),由于碘原子半径大于氯原子(1分),碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价(2分)Fe2+②Na+ +IO3—+ Cl2 + H2O=== NaIO4↓+ 2H+ + 2Cl—(2分)(碱性环境不得分,NaIO4拆写或NaIO3未拆的给1分)(4)①ClO- + 2H+ + 2I- === I2 + Cl- + H2O(1分),10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高(1分),吸光度越大。
(2分)②c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降(1分)③0.1 (2分)28.(16分)(1)Fe3++3H23+3H+(1分),盐酸抑制氯化铁水解(1分)(2分)(2)①足量盐酸和BaCl2溶液(各1分,共2分)②取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液(1分),产生蓝色沉淀(1分),证明产生了Fe2+(2分)(3)(或)(2分)说明:SO32- —2e- + 2OH- === SO42- + H2O 不得分,题目中pH=9的溶液是由于SO32-水解,OH-来自于水的电离。
(4)②(2分)(5)生成红色配合物的反应速率快(1分),红色配合物生成橙色配合物的速率较慢;在向移动,最终溶液几乎无色(1分)(2分)HSO 电离提供SO32-,溶液中Fe3+、(6)反应后的Fe2+被空气氧化为Fe3+(1分),过量的3SO32-、OH-三种微粒会继续反应形成红色配合物(1分)(2分)(7)溶液pH不同、Na2SO3、NaHSO3溶液中SO32-浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同)、反应物是否接触形成红色配合物(任写两条,各1分,共2分)。