2016届贵州省遵义市九年级中考化学教材知识梳理练习第5章《金属的冶炼与利用》.doc
- 格式:doc
- 大小:423.44 KB
- 文档页数:11



第五章 金属的冶炼与利用第1节金属的性质和利用一、金属材料纯金属(90多种) 合金 (几千种)2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色) (3)有良好的导热性、导电性、延展性3、金属之最:(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素 (3)铁:目前世界年产量最多的金属(铁>铝>铜) (4)银:导电、导热性最好的金属(银>铜>金>铝)(5)铬:硬度最高的金属 (6)钨:熔点最高的金属 (7)汞:熔点最低的金属 (8)锇:密度最大的金属 (9)锂 :密度最小的金属4、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小优点 (2)可塑性好、易于加工、机械性能好(3)抗腐蚀性能好5. 生铁和钢(1)钢和生铁都是由铁、碳等元素形成的合金 (2)生铁特点:硬而脆,无韧性,只能铸造钢特点:硬度大、韧性好,有良好的延展性和弹性。
可铸、可锻、可轧 钢和生铁的本质差异:含碳量不同 二、金属的化学性质1、金属材料2锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑3、金属 + 盐→另一金属 + 另一盐(条件:“前换后,盐可溶”)铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。

我来学校的英语作文Title: The Importance of English Learning in School。
English learning in school plays a pivotal role in shaping one's academic and professional journey. Its significance transcends mere language acquisition; it fosters critical thinking, cultural understanding, and global communication. In this essay, we delve into the multifaceted importance of English learning in school.First and foremost, proficiency in English opens doors to a plethora of opportunities in academia and the professional realm. In today's interconnected world, English serves as the lingua franca of international communication, facilitating collaboration and knowledge exchange across borders. Mastery of English empowers individuals to access a wealth of information, academic resources, and global networks, thereby enhancing their academic and career prospects.Furthermore, English proficiency cultivates critical thinking and analytical skills. Through the study ofEnglish literature, students are exposed to diverse perspectives, complex narratives, and profound ideas. Analyzing literary works not only sharpens comprehension skills but also nurtures empathy and emotional intelligence. Moreover, engaging with English texts encourages studentsto question assumptions, challenge societal norms, and develop a nuanced understanding of human experiences.Moreover, English learning fosters cultural awareness and appreciation. Language is intricately intertwined with culture, and by studying English, students gain insightsinto various cultural nuances, traditions, and historical contexts. Exposure to diverse literary works, films, and artistic expressions broadens students' worldview and cultivates respect for cultural diversity. This cross-cultural competence is invaluable in an increasingly globalized world, where intercultural communication skills are essential for fostering mutual understanding and cooperation.Additionally, English proficiency equips individuals with practical communication skills essential for navigating the complexities of the modern world. Whether it be composing emails, delivering presentations, or participating in international conferences, effective communication in English is indispensable across various professional domains. Moreover, proficiency in English enhances one's ability to adapt to new situations, collaborate with diverse teams, and thrive in multicultural environments, thereby bolstering employability in an increasingly competitive job market.Furthermore, English learning promotes lifelong learning and personal growth. Beyond academic and professional pursuits, proficiency in English enrichesone's leisure activities, such as reading literature, watching films, or engaging with online content. Theability to consume and comprehend English media enhances entertainment options and facilitates continuous self-improvement. Moreover, learning English opens doors to travel opportunities, allowing individuals to explore new destinations, immerse themselves in different cultures, andforge meaningful connections with people from around the globe.In conclusion, English learning in school is indispensable for holistic development and success in the 21st century. Beyond its practical utility, English proficiency fosters critical thinking, cultural awareness, and global communication skills. As we navigate an increasingly interconnected world, the ability to effectively communicate and collaborate in English is essential for academic achievement, professional success, and personal fulfillment. Therefore, investing in English education in school is not only a pragmatic choice but also a transformative journey towards becoming informed global citizens.。
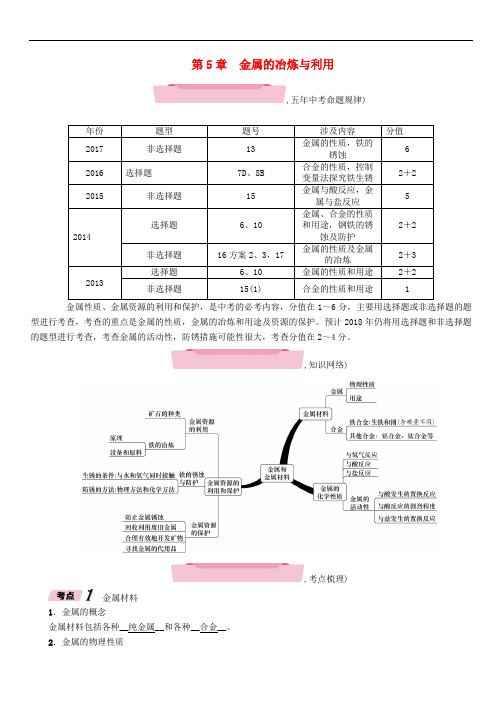
第5章金属的冶炼与利用,五年中考命题规律)年份题型题号涉及内容分值2017 非选择题13 金属的性质,铁的锈蚀62016 选择题7D、8B 合金的性质,控制变量法探究铁生锈2+22015 非选择题15 金属与酸反应,金属与盐反应52014选择题6、10金属、合金的性质和用途,钢铁的锈蚀及防护2+2 非选择题16方案2、3,17金属的性质及金属的冶炼2+32013选择题6、10 金属的性质和用途2+2 非选择题15(1) 合金的性质和用途 1金属性质、金属资源的利用和保护,是中考的必考内容,分值在1~6分,主要用选择题或非选择题的题型进行考查,考查的重点是金属的性质,金属的冶炼和用途及资源的保护。
预计2018年仍将用选择题和非选择题的题型进行考查,考查金属的活动性,防锈措施可能性很大,考查分值在2~4分。
,知识网络),考点梳理)金属材料1.金属的概念金属材料包括各种__纯金属__和各种__合金__。
2.金属的物理性质(1)颜色大多数金属呈银白色,特例:金呈__黄__色,铜呈__紫红__色。
(2)状态常温下为固体,特例:__汞__是液体。
(3)特性具有良好的导电性、导热性、延展性等。
3.合金 (1)概念由一种金属跟其他__金属__或__非金属__熔合形成的有金属特性的物质。
(2)常见的合金①青铜:人类历史上使用最早的合金,由锡和铜组成。
②生铁和钢:使用很广的钢和生铁由铁、碳组成,两者的区别是含碳量不同。
铁合金 生铁 钢 碳的含量2%~4.3%0.03%~2%③其他常见的合金:不锈钢、黄铜、铝合金。
(3)性质特点合金的硬度一般比组成它的各成分金属__大__;熔点一般比组成它的各成分金属__低__。
金属的化学性质1.金属的化学性质 (1)金属与氧气反应O 2⎪⎪⎪⎪――→与镁 2Mg +O 2=====点燃2MgO――→与铁3Fe +2O 2=====点燃Fe 3O 4――→与铜 2Cu +O 2=====△2CuO――→与铝 4Al +3O 2=====点燃2Al 2O 3(2)金属与酸溶液反应镁⎪⎪⎪⎪――→与稀盐酸 Mg +2HCl===MgCl 2+H 2↑ ――→与稀硫酸Mg +H 2SO 4===MgSO 4+H 2↑ 锌⎪⎪⎪⎪――→与稀盐酸 Zn +2HCl===ZnCl 2+H 2↑ ――→与稀硫酸Zn +H 2SO 4===ZnSO 4+H 2↑ 铁⎪⎪⎪⎪――→与稀盐酸 Fe +2HCl===FeCl 2+H 2↑ ――→与稀硫酸Fe +H 2SO 4===FeSO 4+H 2↑【特别提醒】氢气的实验室制取。

△△第五章金属的冶炼和利用第一节金属的性质与利用一、金属的物理性质大多数金属为银白色(铜为紫红色、金为黄色、铁粉为黑色)、有金属光泽、常温下为固体(汞为液体)、硬度大、熔沸点高、能导电导热、有延展性问题:黄铜和黄金外观很相似,你们可用哪些方法将它们鉴别出来?方法:测密度、硬度等(物理方法)火烧,变黑的为黄铜,不变色的为黄金。
(化学方法)二、金属的化学性质(1)金属与氧气的反应常温下,铝和氧气也能反应,在表面形成一层致密的氧化铝膜。
在加热条件下,铁、铜等很多金属都能跟氧气化合生成金属氧化物。
活动与探究:在酒精灯火焰上加热铜丝,观察现象现象:铜丝表面变黑2Cu+O2=2CuO总结:实验表明:绝大多数金属能与氧气反应,但反应的难易程度不同和剧烈程度不同。
表达式:金属+氧气→金属氧化物(化合反应)①铝在常温下能与氧气反应,那么我们用的铝制餐具不易生锈而铁制品却容易生锈呢?②为何不宜用钢刷来擦洗铝制餐具呢?(2)金属与酸(稀盐酸或稀硫酸)的反应观察与思考:在试管中分别加入少量镁带、锌、铜片、铁,再分别加少量稀盐酸或稀硫酸,观察各组物质是否反应,有没有气泡,有没有放热现象,反应速度如何,完成反应方程式。
Mg+2HCl=MgCl2+H2金属表面有气泡。
Fe+2HCl=FeCl2+H2 金属表面有气泡,溶液由无色变成浅绿色。
Zn+2HCl=ZnCl2+H2铁、镁、锌能和稀盐酸或稀硫酸反应时剧烈程度不同。
____反应最剧烈,其次是_____,然后是_____(3)由此推出,金属活动性顺序__________________小结:绝大数金属能与稀盐酸或稀硫酸反应,但反应的剧烈程度不同。
哪个反应最适合实验室制取氢气?为什么?金属+酸→盐+氢气(置换反应)(3)铁与硫酸铜的反应(金属与盐溶液的反应)活动与探究:铁与硫酸铜的反应+氧气 +酸 +盐溶液 现象:铁钉表面有红色物质生成,溶液由蓝色变成浅绿色化学方程式:Fe+CuSO 4=FeSO 4+Cu 拓展:铜与硝酸银溶液的反应、铝丝与硫酸铜溶液的反应金属+盐溶液→新金属+新盐 (置换反应)小结:金属的化学性质金属金属与酸反应条件:1、金属为活泼金属 2、酸为稀盐酸和稀硫酸金属与盐溶液的反应条件:1、(金属符合)前换后 2、反应物盐要可溶三、金属活动性顺序活泼金属不活泼金属强金属活动性顺序弱1、在金属活动顺序表中,只有排在氢前面的金属才能置换出酸中的氢2、在金属活动顺序表中,排在前面的金属能把排在后面的金属从溶液中置换出来 现学现用:工人在切割钢板时,常用硫酸铜溶液画线你知道为什么?四、置换反应Fe+CuSO 4=FeSO 4+CuMg+2HCl=MgCl 2+H 2Mg+H 2SO 4=Mg SO 4+H 2单质+化合物=单质+化合物1、概念:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应2、形式:A+BC B+AC小结:化学反应的类型化合反应:A + B + … → AB…分解反应:AB… →A + B + …置换反应:A +BC →AC + B金属氧化物 盐+氢气 新金属+新盐高温拓展:氢气的实验制法等(原料、原理、装置、收集方法、验满)五、常见的金属矿物拓展:金属与酸反应的计算1、等质量的四种金属Al 、Mg 、Fe 、Zn 与足量的稀盐酸反应,生成氢气的多少? 2Al+6HCl=2AlCl 3+3H 2 54 61 x x=6/54=2/18Mg+2HCl=MgCl 2+H 224 21 x x=2/24Fe+2HCl=FeCl 2+H 256 21 x x=2/56Zn+2HCl=ZnCl 2+H 265 21 x x=2/65生成氢气的质量为Al >Mg >Fe >Zn1、 足量的四种金属Al 、Mg 、Fe 、Zn 与等质量的稀盐酸反应生成氢气的多少? 结论:生成氢气一样多第二节 金属矿物 铁的冶炼一、 铁的冶炼使金属矿物变成金属的过程,叫做金属的冶炼1、 实验室铁的冶炼 (1)实验原理:3CO+2Fe 2O 3=4Fe+3CO 2(2)实验操作:1、按上图组装仪器,并检查其密性2、把少量研细的氧化铁粉末装进硬质玻管中,轻轻转动,使氧化铁粉末均匀地附在玻璃管内壁上3、把硬质玻管接入装置系统中,先通入一氧化碳气体排气;待排尽后,点燃出气口处的酒精灯及酒精喷灯,并观察装置中所发生的变化4、当红棕色粉末已转变成黑色后,先停止加热,再通一会儿一氧化碳,直至玻璃管冷却(3)实验现象:高温 点燃高温 高温 红棕色的氧化铁粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊(4)注意问题:1、一氧化碳还原氧化铁是在封闭的硬质玻管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸2、实验完毕先停止加热,还要继续通入一氧化碳直到玻璃管冷却为止。
第5章金属的冶炼与利用一.金属的物理性质1.金属光泽:(1)金属都具有一定的金属光泽,一般都呈银白色,而少量金属呈现特殊的颜色,如:铜(Cu)是红色(紫红色)、锌(Zn)是青白色等;Fe)在通常情况下呈银白色,铁粉是呈黑色的,这主要是由于颗粒太小,光不容易反射。
【MnO2、Fe3O4、CuO、C、Fe粉】--五大黑色固体2.金属的导电性和导热性:金属一般都是电和热的良好导体。
其中导电性的强弱次序:银(Ag)>铜(Cu)3.金属的延展性大多数的金属有延性(抽丝)及展性(压薄片)4、钨的熔点最高;汞(Hg)的熔点最低二.常见金属的化学性质1.金属与氧气反应2Mg+O2点燃===2MgO 2Cu +O2△===2CuO 现象:固体由红色变为黑色3Fe+2O2点燃===Fe3O44Al+3O2==2Al2O3 铝表面容易与空气中的氧气发生2.金属与稀盐酸或稀硫酸发生反应金属活动性顺序表:钾(K)钙(Ca)钠(Na)镁(Mg)铝(Al)锌(Zn)铁(Fe)锡(Sn)铅(Pb)[氢(H)]铜(Cu)汞(Hg)银(Ag)铂(Pt)金(Au)(1(2)排在越前面的金属就越容易与酸反应,即在相同情况下,反应速率越大。
如:2 Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑Fe+2HCl==FeCl2+H2↑Fe+ H2SO4==FeSO4+H2↑实验现象:铁丝表面出现气泡,无色溶液变成浅绿色溶液。
Zn+2HCl=ZnCl2+H2 ↑Zn+H2SO4==ZnSO4+H2↑(实验室制取H2)等量的金属与足量的相同酸反应生成氢气的质量(金属的效率)由高到低的顺序为:Al>Mg>Fe>Zn>Cu=C18 24 56 65 非常大-----2克氢气2 Al+6HCl=2AlCl3+3H2↑Mg+2HCl=MgCl2+H2↑54 6 24 2m x m yx=6m/54 y=2m/24Fe+2HCl==FeCl2+H2↑Zn+2HCl=ZnCl2+H2 ↑56 2 65 2m z m wz=2m/56 w=2m/65等量的相同的酸与足量的金属反应,生成氢气的质量相等。
第5章金属的冶炼与利用一、选择题1.(2017,苏州)下列关于金属的说法中,不正确的是( B )A.铜有良好的导电性,常用于制作导线B.所有的金属都能与稀盐酸反应C.铁制品在干燥的空气中不易生锈D.不锈钢具有较强的耐腐蚀性,可用于制作医疗器械2.下列有关金属的说法正确的是( C )A.铝元素在地壳中含量最多,使用也最早B.不锈钢的抗腐蚀性强于纯铁,硬度小于纯铁C.灯泡里的灯丝常用钨制成D.地球上金属矿物资源储量有限,可再生3.(2017,福建)下列四支试管中,铁钉锈蚀最快的是( D )4.(2017,郴州)为验证Zn、Cu、Ag三种金属的活动性顺序,下列试剂可以选用的是( D )A.ZnSO4溶液 B.稀盐酸C.AgNO3溶液 D.CuSO4溶液5.(2017,武威)自2011年我省实施找矿战略行动以来,在铜、铅、锌、金、铁、铌、钽等金属方面取得找矿新成果。
下列关于铁、锌、铜三种金属及其合金的说法不正确的是( B )A.铁在潮湿的空气中易生锈B.可以用铁桶盛放硫酸铜溶液C.可以用稀硫酸鉴别锌与铜的金属活动性强弱D.黄铜(铜与锌的合金)的硬度大于纯铜6.现有甲、乙、丙、丁四种颗粒大小相同的金属,分别投入相同的稀硫酸中,只有甲、乙表面有气泡产生,且甲产生气泡较快;再把丙和丁投入相同的硝酸银溶液中,过一会儿,丙的表面有银析出,而丁没变化。
则四种金属的活动性顺序是( C )A.丙>乙>丁>甲 B.丁>乙>丙>甲C.甲>乙>丙>丁 D.乙>甲>丁>丙7.将一定量的锌粉加入到硝酸亚铁、硝酸银的混合溶液中,溶液最终变为无色。
下列图像能表示对应变化关系的是( D )8.(2014,遵义)控制变量法是实验探究的重要方法。
下列设计方案探究目的不能实现的是( C )A .甲可探究可燃物的燃烧是否需要与氧气接触B .甲可探究可燃物的燃烧是否需要达到一定温度C .乙中①③对比可探究铁的锈蚀条件与氧气是否有关D .乙中①②③对比可探究铁的锈蚀条件与氧气和水等物质是否有关 9.下列方法中不能防止钢铁腐蚀的是( B ) A .表层镀锌 B .食盐水浸泡 C .制成合金 D .表层涂油10.下列反应中属于置换反应的是( A ) A .Fe +CuSO 4===FeSO 4+Cu B .2NO +O 2===2NO 2C .3CO +Fe 2O 3=====高温2Fe +3CO 2 D .2NaCl=====电解2Na +Cl 2↑11.(2014,遵义)如图所示,为某化工企业生产流程示意图,有关说法正确的是( C )A .③中氩气(Ar)作反应物B .钛酸亚铁(FeTiO 3)中钛元素为+3价C .②中为使原料全部转化为甲醇,理论上CO 和H 2投料的质量比为7∶1D .①中反应为2FeTiO 3+6C +7Cl 2=====一定条件2X +2TiCl 4+6CO ,则X 为FeCl 2 二、非选择题12.通过化学启蒙学习,同学们对组成万物的基本物质有了进一步了解。
第5章金属的冶炼与利用五年中考命题规律五年中考真题演练金属的性质1.(2015,遵义,15,5分)请按要求完成下列金属性质的实验。
研究一:金属与酸反应过程中的能量变化。
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应________(选填“放热”或“吸热”),反应的化学方程式为____________________;(2)实验测得反应中产生气体的速度(v)与时间(t)的关系如右图,请根据t1~t2时间段反应速率变化,说明化学反应速率受________等因素影响。
研究二:金属与盐溶液反应过程中的相关变化。
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为__________________;(2)在一定量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,下图描述相关变化曲线,一定不正确的是________。
,A,B,C ,D2.(2013,遵义,6,2分)下列有关金属的说法正确的是()A.铝有良好的抗氧化能力B.合金一定不含非金属C.生铁是化合物D.赤铁矿是金属材料3.[2012,遵义,13(3),1分]九年级化学学习的物质和化学反应在日常生活中有着实际的应用。
化学反应释放的热量常被人们所利用,如8Al+3Fe3O4高温9Fe+4Al2O3,铝热反应所放出的热量可用于焊接钢轨,该反应属于________(选填基本反应类型)反应。
金属的冶炼4.(2011,遵义,15,4分)A~H均为初中化学中常见的物质,已知A、B为黑色固体,D为紫红色固体单质,F为红棕色粉末。
它们之间的转化关系如图所示(部分物质已略去),请回答:(1)写出A+B→C+D的化学方程式:____________________,该反应属于________反应(填化学反应基本类型)。
(2)写出E→G的化学方程式:__________________________________。
(3)写出一个能实现G→D的化学方程式:______________________。
5.(2014,遵义,8,2分)如图所示,为某化工企业生产流程示意图,有关说法正确的是()A.③中氩气(Ar)作反应物B.钛酸亚铁(FeTiO3)中钛元素为+3价C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为7∶1D.①中反应为2FeTiO3+6C+7Cl2一定条件2X+2TiCl4+6CO,则X为FeCl2金属防护和废金属回收6.(2014,遵义,10,2分)控制变量法是实验探究的重要方法。
下列设计方案探究目的不能实现的是()A.甲可探究可燃物的燃烧是否需要与氧气接触B.甲可探究可燃物的燃烧是否需要达到一定温度C.乙中①③对比可探究铁的锈蚀条件与氧气是否有关D.乙中①②③对比可探究铁的锈蚀条件与氧气和水等物质是否有关中考考点清单金属材料1.金属的概念。
金属材料包括各种________和各种________。
2.金属的物理性质。
(1)颜色:大多数金属呈银白色,特例:金呈________色,铜呈________色。
(2)状态:常温下为固体,特例:________是液体。
(3)特性:具有良好的导电性、导热性、延展性等。
3.合金。
(1)概念:由一种金属跟其他______或________熔合形成的有金属特性的物质。
(2)常见的合金。
①青铜:人类历史上使用最早的合金,由锡和铜组成。
②生铁和钢:使用很广的钢和生铁由铁、碳组成,两者的区别是含碳量不同。
③其他常见的合金:不锈钢、黄铜、铝合金。
(3)性质特点:合金的硬度一般比组成它的各成分金属________;熔点一般比组各成它的成分金属________。
金属的化学性质1.金属的化学性质。
(1)金属与氧气反应。
O2与镁________________________与铁________________________与铜________________________与铝________________________(2)金属与酸溶液反应。
镁与稀盐酸________________________与稀硫酸________________________锌与稀盐酸________________________与稀硫酸________________________铁与稀盐酸________________________与稀硫酸________________________【特别提醒】氢气的实验室制取。
(1)药品:锌和稀硫酸。
(2)化学方程式:Zn+H2SO4ZnSO4+H2↑。
【难点突破】金属与酸反应的曲线。
①等质氢图。
两种金属反应产生的氢气质量相同,此图反映了两种情况:a.酸不足,金属过量,产生的氢气质量由酸的质量决定。
b.酸足量,投放的两种金属与酸反应产生氢气的质量恰好完全相同,如24 g镁和56 g 铁分别投入足量的酸中反应产生的氢气质量相同。
②等质等价金属图。
如等质量的镁、铁、锌与足量的酸反应,生成物中金属的化合价均为+2价,产生氢气的速率和质量不同。
此图反映出:a.金属越活泼,图示反应物的曲线越陡,如Mg线比Zn线陡,Zn线比Fe线陡。
b.金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高,消耗的酸越多。
(3)金属与某些盐溶液反应。
①铁与硫酸铜溶液。
现象:银白色固体表面________________,溶液颜色由________逐渐变为__________;化学方程式:____________________;结论:铁的活动性________(选填“大于”或“小于”)铜。
②铜与硝酸银溶液。
现象:铜丝表面__________________,溶液颜色由________变为________;化学方程式:________________________;结论:铜的活动性________(选填“大于”或“小于”)银。
2.置换反应。
①定义:由一种单质跟一种化合物作用生成________和________,这样的反应叫做置换反应。
置换反应中一定存在化合价变化的元素。
②表达式:A+BC→AC+B,例如:Mg+2HClMgCl2+H2↑,Fe+2HClFeCl2+H2↑。
金属矿物和铁的冶炼1.金属在自然界中的存在极少数不活泼的金属(如铂、金、银等)在自然界中以________形式存在,其他大多数以________形式存在,金属化合物以矿物的形式存在。
2.金属矿石。
(1)铁矿石。
(2)铜矿石:黄铜矿、孔雀石、斑铜矿和赤铜矿。
(3)铝矿石:铝土矿和明矾石等。
3.实验突破:金属的冶炼。
(1)实验原理:铁的冶炼原理:3CO+Fe2O3高温2Fe+3CO2(一氧化碳还原氧化铜的反应原理:CO+CuO△Cu+CO2)(2)装置。
(3)实验现象:点燃酒精喷灯后,可观察到澄清石灰水________,玻璃管中固体__________________(一氧化碳还原氧化铜现象:试管内固体________________、澄清石灰水________)。
(4)操作顺序。
(5)尾气处理:CO 有毒,应将排出的尾气________或收集起来。
金属防护和废金属回收1.钢铁的锈蚀及防护。
(1)铁锈的主要成分________。
(2)锈蚀条件:铁与________、________同时接触。
2.实验突破:金属的锈蚀。
(1)实验原理:________________________________________________________________________。
(2)实验操作。
(3)实验现象:经过一段时间后,第一支试管中铁钉表面出现________铁锈,且在空气和蒸馏水________处铁锈更多,第二支试管和第三支试管中铁钉表面________锈迹。
(4)实验结论:对比第一支试管的现象和第二支试管的现象可知铁生锈需要________;对比第一支试管的现象和第三支试管的现象可知铁生锈需要________。
铁生锈的条件是________________________。
(5)注意事项:①第二支试管所用蒸馏水是经煮沸并迅速冷却的蒸馏水,煮沸的目的是____________________,迅速冷却的目的是______________________。
②第二支试管中植物油的作用是________________,防止空气中的氧气溶解到水中。
③第三支试管加入干燥剂的目的是________________。
【温馨提示】同样暴露在空气中的金属铁比金属铝容易锈蚀的原因:铁锈疏松多孔,不能阻止铁与氧气、水继续反应;而铝与氧气反应生成的致密的氧化铝薄膜能防止铝进一步被氧化。
3.(1)除锈方法:①物理方法:砂纸打磨、冷拉。
②化学方法:用________除铁锈,反应的化学方程式为________________________________.(2)防护方法:①保持钢铁表面________;②在钢铁表面________________;③在钢铁表面镀上一层________。
4.废金属的回收利用。
(1)废金属的危害:不但造成资源浪费,还会产生镉、汞等有毒金属对环境的污染。
(2)废金属回收利用的意义:既可以节约大量的金属资源,又能减少重金属对环境的污染。
中考重难点突破金属材料的判断【例1】(2014,钦州)3D打印技术将改变人类的生活方式。
下列3D打印常用材料中,属于合金的是()A.尼龙B.陶瓷C.不锈钢D.橡胶【解析】尼龙是有机合成材料,陶瓷是无机非金属材料,不锈钢是金属材料,橡胶是有机高分子材料,其中天然橡胶属于天然高分子材料,合成橡胶属于合成高分子材料。
【答案】C1.(2015,苏州)材料是人类赖以生存和发展的重要物质。
下列材料分类中正确的是()A.铝合金属于金属材料B.有机玻璃属于无机非金属材料C.塑料属于复合材料D.陶瓷属于合成材料金属的化学性质【例2】(2014,临沂)若金属锰在金属活动性顺序中位于铝和锌之间,则下列反应不能发生的是(提示:MnSO4溶于水)()A.Mn+2HClMnCl2+H2↑B.Fe+MnSO4FeSO4+MnC.2Al+3MnSO4Al2(SO4)3+3MnD.Mg+MnSO4MgSO4+Mn【解析】金属锰在金属活动性顺序中位于铝和锌之间,则金属活动性顺序为Mg>Al>Mn>Zn>Fe>H,根据置换反应发生的规则,金属Mn分别能和稀盐酸、ZnSO4、FeSO4溶液反应,MnSO4溶液能和Mg、Al反应,而Fe和MnSO4的反应不可能发生。
故选B。
【答案】B【方法指导】金属与盐溶液反应的先后规律。
(1)当活动性较强的金属与另外多种活动性较弱的金属的盐溶液反应时,活动性最弱的金属盐溶液优先与金属反应;(2)当活动性较弱的金属的盐溶液与另外多种活动性较强的金属单质反应时,活动性最强的金属单质优先与盐溶液反应。