九年级化学海水制碱
- 格式:pdf
- 大小:368.88 KB
- 文档页数:9



海水制碱知识点一:1、氨碱法制纯碱1原料:食盐、石灰石;氨气为媒介;2生产流程:盐水→精盐水→氨盐水→碳酸氢钠→碳酸钠纯碱3、化学反应原理:NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl2 NaHCO3==△=== Na2CO3+H20+CO2↑注意:1氨盐水比食盐水更易吸收二氧化碳的原因是氨溶于水显碱性,而二氧化碳溶于水显酸性,二者能发生反应,因此氨盐水比食盐水更易吸收二氧化碳2对生成的NaHCO3和NH4Cl都能溶于水,分离的问题:从课本中溶解度曲线图上查出在室温时氯化铵比碳酸氢铵溶解度大,因此碳酸氢铵先结晶析出;3氨碱法制纯碱的优点:原料经济易得,CO2和NH3可回收利用连续生产;反应:2NH4Cl+ CaOH2===CaCl2+H2O+NH3↑缺点:氯化钠的利用率不高,得到的CaCl2用途不大,污染环境;2、侯氏制碱法联合制碱法我国化学家侯德榜改进了氨碱法的不足,创立了联合制碱法;在反应得到的氯化铵溶液中加入食盐,使氯化铵结晶析出;认知基础1、生活中据说的盐是除去粗盐中难溶性杂质的过程为、、海水“晒盐”属于变化化学上所说的盐是列举三种常见的盐、、;厨房中的纯碱----碳酸钠的化学式为,它属于类物质;2、浓氨水易挥发,挥发出的有较强的刺激性气味,其水溶液显性,能使紫色石蕊试液变 ,使无色酚酞试液变 ;3、复分解反应是指的反应;氢氧化钠在空气中变质的反应方程式为:该反应是否属于复分解反应4、分别写出盐酸、硫酸、石灰水分别与碳酸钠反应的化学方程式自学导航一、如何利用海水制碱1、我国着名的化学家侯德榜发明了先进的联合制碱法侯氏制碱法,打破了西方国家对制碱技术的垄断;2、氨碱法制纯碱的原理:2总结分析:原理分析1从元素守恒的角度来看,将NaC1转化为Na2CO3的过程,就是要向NaC1溶液中加入___、___元素,并使之于NaC1中的___元素组合的过程;3原料是_______、_________氨水利用氨水呈_____性,使得CO2更易被吸收知识点二:纯碱的性质1、向碳酸钠固体中加入稀盐酸,会发现_____________________________________的现象,将然着的木条伸进试管口,会发现________________________,这说明有_________生成,反应的化学方程式为_______________________________________________.2、向盛有少量碳酸钠溶液的试管中滴加澄清的石灰水,会发现_____________________________的现象,说明有___________生成,方程式为__________________________________________3、向盛有少量碳酸钠溶液的试管中滴加氯化钡,会看到__________________的现象;这说明有____________生成,方程式为___________________________________________________4、检验碳酸钠中含有碳酸根离子的方法:;5、酸、碱、盐之间在水溶液中发生的复分解反应实质上是 ;练习1.我国化学家侯德榜改进了一种化工产品的工业生产技术,其产品获得美国费城万国博览会金奖,这种生产技术用于A.生产烧碱B.生产纯碱C.精制粗盐D.生产尿素2.在发酵面团中加入下列某种物质的溶液揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔;这种物质是A.碳酸钠B.氢氧化钙C.氧化钙D.氯化钠3.食盐、食醋、纯碱等均是家庭厨房中常用的物质,利用这些物质你能做成的实验是①检验自来水中是否含氯离子②鉴别食盐和纯碱③检验鸡蛋壳能否溶于酸④除去热水瓶中的水垢A.①②③④B.①③C.②④D.②③④4.盛夏,在烈日下工作、出汗过多的人,所穿的深色衣服上会出现一些细小白色粉末,其主要成分为A.纯碱 B.烧碱 C.氯化钠 D.油脂5.能用无色酚酞区别开的一组溶液是A.稀盐酸和稀硫酸 B.石灰水和雨水C.纯碱溶液和稀氨水 D.食盐水和蔗糖水6.下列物质俗名与化学式不相符的是A.纯碱NaOH B.小苏打NaHCO3C.大理石CaCO3 D.食盐NaCl7.检验碳酸盐的正确方法是A.滴加盐酸,产生使木条火焰熄灭的气体B.滴加BaCl2溶液产生白色沉淀C.加热,产生使澄清石灰水变浑浊的气体D.滴加盐酸产生使澄清石灰水变浑浊的气体8、为了证明长期暴露在空气中氢氧化钠溶液已经部分变质,请分别选用两种不同物质类别的试剂完成证明,按要求填写:1选用的试剂为_____,实验现象为________,反应的化学方程式 _________ ______ 2选用的试剂为_______,实验现象为________反应的化学方程式_________ ___________ 作业:1、碳酸钠俗名_________,又称_________,是一种_____色_____体,_____溶于水,其水溶液呈_____性,我国着名科学家__________,在改进纯碱的生产方面做出了突出的贡献;2、下列有关叙述正确的是A、制纯碱需要的原料是食盐和石灰石B、海水晒得的粗盐可以直接吸氨制成氨盐水C、向氨盐水中通入二氧化碳可得到纯碱,溶液经结晶后得到纯碱固体D、因为氯化钠水溶液呈中性,所以氨盐水也呈中性3、某瓶盐溶液标签已被腐蚀,只知其可能是NaCl溶液,也可能是Na2CO3溶液;请你对这瓶溶液进行鉴定,以确定是NaCl溶液还是Na2CO3溶液;1鉴定溶液可用两种不同类别的试剂任选两种:、 ; 2为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验;2加入CaCl2溶液后,分离除去沉淀A的实验操作方法是 ; 3同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质, 请写出固体物质B的成分用化学式表示;4同学继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入;写出有关反应的化学方程式:_____ ;4.侯氏制碱法制的纯碱中通常含有少量的氯化钠,现有含氯化钠杂质的纯碱样品 g,全部溶解在350 g水中,向溶液中加入氯化钡溶液 g,恰好完全反应;过滤,干燥后称得沉淀质量为 g;求:1原样品中的碳酸钠的质量 2最后所得滤液中溶质的质量分数。

海水制碱化学反应方程式
海水中主要的盐类有氯化钠(NaCl)、硫酸镁(MgSO4)、硫酸钠(Na2SO4)、碳酸钙(CaCO3)等。
其中,氯化钠是最主要的成分。
海水制碱的方法主要有两种,一种是通过碱性物质与盐类反应产生碱性物质,另一种是通过电解海水制备氢氧化钠(NaOH)。
1.碱性物质与盐类反应:
氢氧化钠(NaOH)或氧化钙(CaO)等碱性物质与氯化钠(NaCl)反应可生成氢氧化钠或氢氧化钙。
反应方程式如下:
2NaOH+NaCl→Na2CO3+H2O+Cl2
2CaO+Na2CO3→Ca(OH)2+NaCl
其中,生成的氢氧化钠(NaOH)或氢氧化钙(Ca(OH)2)都属于碱性物质,可以用于制碱。
2.电解海水制备氢氧化钠(NaOH):
在电解槽中,将海水进行电解,产生氢氧化钠和氢气。
反应方程式如下:
2NaCl+2H2O→2NaOH+H2+Cl2
在阳极处生成氯气(Cl2),在阴极处生成氢气(H2)和氢氧化钠(NaOH)。
这两种方法都是海水制碱的常用方法,选择何种方法取决于具体的生产条件和需求。
需要注意的是,在实际操作中,还需要考虑反应条件、反应物的浓度、纯度等因素,以确保反应效率和产品质量。





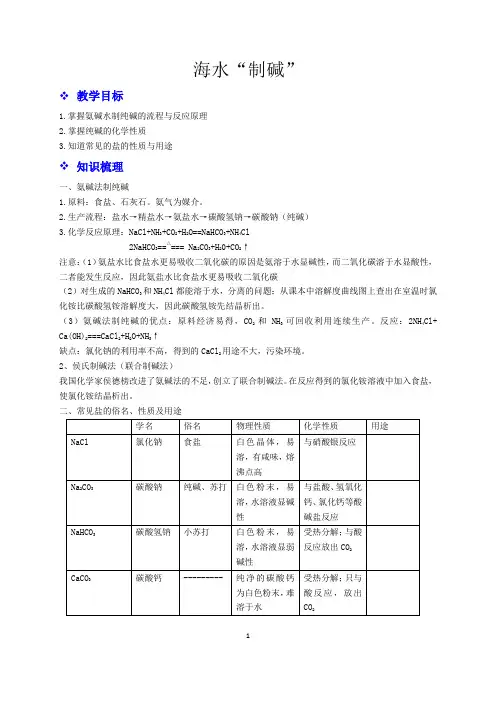
海水“制碱”❖教学目标1.掌握氨碱水制纯碱的流程与反应原理2.掌握纯碱的化学性质3.知道常见的盐的性质与用途❖知识梳理一、氨碱法制纯碱1.原料:食盐、石灰石。
氨气为媒介。
2.生产流程:盐水→精盐水→氨盐水→碳酸氢钠→碳酸钠(纯碱)3.化学反应原理:NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl2NaHCO3==△=== Na2CO3+H20+CO2↑注意:(1)氨盐水比食盐水更易吸收二氧化碳的原因是氨溶于水显碱性,而二氧化碳溶于水显酸性,二者能发生反应,因此氨盐水比食盐水更易吸收二氧化碳(2)对生成的NaHCO3和NH4Cl都能溶于水,分离的问题:从课本中溶解度曲线图上查出在室温时氯化铵比碳酸氢铵溶解度大,因此碳酸氢铵先结晶析出。
(3)氨碱法制纯碱的优点:原料经济易得,CO2和NH3可回收利用连续生产。
反应:2NH4Cl+ Ca(OH)2===CaCl2+H2O+NH3↑缺点:氯化钠的利用率不高,得到的CaCl2用途不大,污染环境。
2、侯氏制碱法(联合制碱法)我国化学家侯德榜改进了氨碱法的不足,创立了联合制碱法。
在反应得到的氯化铵溶液中加入食盐,使氯化铵结晶析出。
二、常见盐的俗名、性质及用途三、盐的通性1.盐的溶解性:钾、钠、铵盐均可溶,硝酸盐入水无踪影,硫酸盐不溶钡和铅,盐酸盐不溶银和汞;碳酸盐,磷酸盐除去钾、钠、铵盐其余均不溶。
2.彩色盐溶液:含铜离子的盐溶液为蓝色,;含铁离子的盐溶液为棕黄色,含有亚铁离子的溶液为浅绿色。
其它离子的盐溶液为无色。
(溶液的颜色)3.盐的化学性质(1)盐+金属→新盐+新金属条件:金属活动性顺序中前面的金属可将其后面的金属从它们的盐溶液中置换出来。
Fe+CuSO4===Cu+FeSO4现象:铁制品表面附着一层红色物质,溶液颜色变浅(或变为浅绿色)Cu+2AgNO3===2Ag+Cu(NO3)2现象:铜制品表面附着一层银白色物质,溶液由无色变为蓝色。
(2)盐+酸→新盐+新酸条件:盐可溶也可不溶,生成物中一定有水、气体或沉淀Na2CO3+2H2SO4==2Na2SO4+H2O+CO2↑ CaCO3+2HCl==2CaCl2+H2O+CO2↑现象:有气泡产生(3)盐+碱→新盐+新碱条件:反应物都可溶,生成物有沉淀或气体Na2CO3+Ca(OH)2==2NaOH+ CaCO3↓ 现象:产生白色沉淀。

九年级化学海水制碱笔记
海水"制碱"是化学变化。
本法以食盐和石灰石为原料
海水“制碱”主要是:在饱和的食盐水中通入氨气形成氨盐水,目的是氨盐水更容易吸收二氧化碳;再向氨盐水中加压的条件下通入二氧化碳,其中的碳酸氢钠析出,原因是碳酸氢钠的溶解度较少;最后将碳酸氢钠固体进行加热,从而得到碳酸钠固体。
反应方程式为
1.NH3+H2O+CO2=NH4HCO3
2.NH4HCO3+NaCl=NH4Cl+NaHCO3↓
3.2NaHCO3=加热=Na2CO3+H2O+CO2↑
即:
a)NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
b)2NaHCO3=加热=Na2CO3+H2O+CO2↑
侯氏制碱法
将析出的NaHCO3晶体煅烧,即可制得碳酸钠.根据氯化铵在常温时的溶解度比氯化钠大,而在低温时却比氯化钠溶解度小的原
独结晶出来.。
一、氨碱法制纯碱(一)原料及产物(二)生产流程1、具体操作:先向饱和食盐水中通入氨气,制成饱和氨盐水,在加压并不断通入二氧化碳的条件下使碳酸氢钠晶体析出。
2、氨盐水:没有化学式,其成分是一水合氨和氯化钠。
3、思考:(1)为什么要通入氨气?(2)通入氨气和二氧化碳的顺序可不可以颠倒?(3)产物中有碳酸氢钠和氯化铵,为什么碳酸氢钠先析出?4、1862年比利时化学家索尔维发明了氨碱法制纯碱,并在制碱过程中向析出NaHCO3晶体后的NH4Cl溶液中加熟石灰用以回收氨气,使之循环使用。
③NH4Cl + Ca(OH)2==CaCl2 + 2H2O+ NH3 ↑氨碱法制取纯碱的优点是:原料经济易得,CO2和NH3可回收使用,能连续生产。
缺点是产生的CaCl2 用处不大,且污染环境。
二、侯氏制碱法原理:③在5℃--10℃时,NaCl的溶解度比NH4Cl的溶解度大,向析出NaHCO3的NH4Cl溶液中加入NaCl细粉,使得NH4Cl单独结晶析出供做氮肥,NaCl溶液可循环使用。
优点:保留了氨碱法的优点。
克服了缺点,食盐的利用率提高到96%,NH4Cl可做氮肥。
题1:下列不属于氨碱法制取纯碱所需的原料是()A.石灰石B.氯化钠C.氢氧化钠D.水题2、1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:(1)侯氏制碱法所制的“碱”是指_______________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是_________晶体(填物质名称)。
(3)现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。
向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。
试回答F列问题:①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为__________(写化学式)。
海水“制碱”【知识梳理】一、氨碱法制纯碱海水中蕴含着大量氯化钠(食盐)。
工业上利用海水提纯出的食盐、石灰石、氨气为原料,采用氨碱法制得一种重要化工原料——纯碱(碳酸钠)。
1、氨碱法制纯碱(碳酸钠)步骤:先向饱和食盐水中通入氨气制成饱和氨盐水溶液,在加压并不断通入二氧化碳条件下发生化学反应,生成的碳酸氢钠(NaHCO3)将从溶液中结晶析出,过滤出碳酸氢钠并加热分解即得纯碱(碳酸钠Na2CO3)。
整个流程图:2、反应原理:CaCO3CaO+CO2↑NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO2↑思考:①为什么氨盐水比食盐水更易吸收CO2?因氨盐水显碱性,食盐水显中性,CO2气体是酸性氧化物,容易在氨盐水中与氨气发生反应而被更多吸收。
②氨盐水吸收CO2后生成NaHCO3和NH4Cl,哪种物质先析出?NaHCO3先析出,因为同温下NaHCO3溶解度比NH4Cl溶解度小。
3、识别“苏打”“小苏打”“苏打”指纯碱或碳酸钠,化学式为Na2CO3,是盐类化合物不是碱;“小苏打”指碳酸氢钠,化学式为NaHCO3,也是盐类化合物,又称酸式碳酸钠。
它们溶于水均显碱性,二者可相互转化。
Na2CO3+CO2+H2O=2NaHCO32NaHCO3Na2CO3+H2O+CO2↑4、侯氏制碱法及其贡献1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法,即侯氏制碱法。
该方法向过滤NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl再单独结晶析出,用作氮肥,NaCl溶液则可循环使用,同年就生产出“红三角”牌纯碱并获万国博览会金奖。
候氏制碱法克服了氨碱法的缺点,促进了世界制碱业技术的发展,打破了西方国家对中国制碱技术的垄断,为纯碱和氮肥工业技术的发展做出了杰出贡献。
二、纯碱(碳酸钠)的化学性质①与指示剂作用:碳酸钠易溶于水,溶液显碱性,可以使指示剂无色酚酞试液显红色。