原料药产品质量报告
- 格式:docx
- 大小:17.04 KB
- 文档页数:7

附件1:药品生产企业年度质量回顾分析报告指南1、本指南是企业撰写产品年度质量回顾分析报告的指导性文件,各企业可根据实际情况,在积极学习和充分借鉴国内外先进经验的基础上,结合新版GMP,不断完善相关内容,年度质量回顾分析报告模板(附录2、3、4)仅供参考。
2、药品生产企业应建立药品年度质量回顾分析报告制度及药品年度质量回顾分析报告撰写的管理程序和操作规程。
原则上由企业质量受权人牵头负责实施。
各药品生产企业每年向区、市、县食品药品监督局报送《药品生产企业年度药品年度质量回顾分析概要》3、药品年度质量回顾分析报告回顾周期应覆盖一年的时间,始末日期不必与日历的一年相一致,但必须保证上下年度回顾周期不出现时间空缺;4、药品年度质量回顾分析报告原则上按品种开展年度质量回顾分析,对于生产工艺和质量控制相似、生产线共用的品种,可根据企业有关制度规定开展年度药品质量回顾分析。
5、年度生产质量情况,统计范围应包括商业化大生产的所有批次。
统计内容包括总生产批次、总生产量、合格批次、不合格批次、返工批次等,并应对全年产品生产质量情况进行总体评价。
6、超过一年未生产,重新组织生产的产品,年度药品质量回顾分析报告应涵盖上一次年度质量报告至本次年度质量报告期间发生的相关变更和研究内容。
7、药品生产企业可采取合适的分析方法或软件对数据进行趋势分析。
在做趋势分析中,应参考历史数据,分析产品质量变化情况。
8、产品年度质量报告一般应在回顾周期后3个月内完成。
并应对上一年度质量报告中建议的改进措施执行情况进行跟踪报告。
9、各药品生产企业对重点品种进行年度质量回顾分析时,应全面回顾可能影响质量的各环节,进行风险排查,消除安全隐患,分析质量趋势,提出改进的措施和建议,确保药品质量。
10、2010年度药品质量回顾分析报告的首次回顾应涵盖2010年度生产的所有批次产品;企业选择2-3个重点品种进行年度产品质量回顾分析。
重点品种的选择应考虑:⑴、中标并组织生产的基本药物品种;⑵、高风险品种如生产的中药注射剂、注射剂品种;⑶、工艺较难控制的品种;⑷、生产量大的常年生产的品种或按剂型选择有代表性的品种等。

药品生产企业年度质量回顾一、分析报告撰写指南1本指南是企业撰写产品年度质量回顾分析报告的指导性文件,各企业可根据实际情况,在积极学习和充分借鉴国内外先进经验的基础上,结合2010版GMP,不断完善相关内容,年度质量回顾分析报告模板(附录2、3、4)仅供参考。
2药品生产企业应建立药品年度质量回顾分析报告制度及药品年度质量回顾分析报告撰写的管理程序和操作规程。
原则上由企业质量受权人牵头负责实施。
3各药品生产企业每年向所在地市州食品药品监督局报送《药品生产企业年度药品质量回顾分析总报告》。
4药品年度质量回顾分析报告回顾周期应覆盖一年的时间,始末日期不必与日历的一年相一致,但必须保证上下年度回顾周期不出现时间空缺。
5药品年度质量回顾分析报告原则上按品种开展年度质量回顾分析,对于生产工艺和质量控制相似、生产线共用的品种,可根据企业有关制度规定开展年度药品质量回顾分析。
6年度生产质量情况,统计范围应包括商业化大生产的所有批次。
统计内容包括总生产批次、总生产量、合格批次、不合格批次、返工批次等,并应对全年产品生产质量情况进行总体评价。
7超过一年未生产,重新组织生产的产品,年度药品质量回顾分析报告应涵盖上一次年度质量报告至本次年度质量报告期间发生的相关变更和研究内容。
8药品生产企业可采取合适的分析方法或软件对数据进行趋势分析。
在做趋势分析中,应参考历史数据,分析产品质量变化情况。
9产品年度质量报告一般应在回顾周期后1个月内完成。
并应对上一年度质量报告中建议的改进措施执行情况进行跟踪报告。
10各药品生产企业对生产品种进行年度质量回顾分析时,应全面回顾可能影响质量的各环节,进行风险排查,消除安全隐患,分析质量趋势,提出改进的措施和建议,确保药品质量。
112012年度药品质量回顾分析报告的首次回顾应涵盖2011年10月1日至2012年10月31日生产的所有批次产品。
药品生产企业年度药品质量回顾分析总报告模版一、基本情况概述1.回顾期限:XXXX年XX月XX日-XXXX年XX月XX日2.回顾年度的生产品种、批次、数量,不合格批次、数量➢生产情况➢生产品种名称➢剂型规格批次数量➢进行年度质量回顾分析的品种➢品种名称➢剂型规格3.停产品种情况➢停产品种名称➢停产原因4.委托生产情况➢委托生产的品种名称➢委托批次委托单位5.委托检验情况➢委托检验品种➢检验项目委托批次委托检验单位6.人员情况➢关键岗位人员变更情况➢关键岗位包括:企业负责人、质量受权人、生产负责人、质保部长、生产部长、工程部长、化验室主任、车间主任、车间工艺员、车间质检员、质检员、化验员、针剂灌装、针剂配液、灭菌/冻干、制水、空调等。

产品质量回顾报告一、引言药品产品质量回顾报告是对一段时间内药品生产、质量控制及市场反馈的综合性回顾,旨在评估产品质量的一致性、稳定性和安全性。
本报告将对XXXX年XX月XX日至XXXX年XX 月XX日期间的产品进行回顾。
二、产品概述本次回顾涉及的产品为XX品牌,主要生产XX类药品,共计XX个品种。
这些药品在市场上得到了广泛认可,具有较高的销售量和口碑。
三、生产质量回顾1.原料药控制:回顾期间,我们对原料药的采购、检验、储存等环节进行了严格控制,确保原料药质量稳定。
2.生产工艺:我们对生产工艺进行了持续优化,提高了产品收率和质量。
3.质量控制:每批产品都经过质量检验,符合国家及企业标准。
四、市场反馈回顾1.投诉处理:对市场反馈的投诉进行了详细分析,主要问题集中在XX方面,已对这些问题进行了整改。
2.市场抽检:配合监管部门和市场抽检,未发现不合格批次。
五、安全性回顾药物不良反应报告:根据药物不良反应监测系统,本期间未收到严重不良反应报告。
安全性更新:根据最新研究结果,我们对部分药品的安全性描述进行了更新。
六、结论回顾期间,本公司的药品产品质量稳定,未发现重大质量问题。
我们将继续加强生产质量控制和市场反馈监测,确保药品的安全性和有效性。
同时,我们将关注新的研究成果,及时更新药品安全性描述。
七、建议1.加强原料药质量控制,确保原料药的稳定供应和质量。
2.对市场反馈中涉及的问题进行深入分析,找出根本原因并采取整改措施。
3.继续关注国内外药品安全性和有效性的最新研究成果,及时调整产品配方和安全性描述。
4.加强与客户的沟通与合作,及时了解客户需求和市场动态。
八、附录本报告所涉及的数据和信息均已存档,可供查阅。
如有需要,请联系质量部门负责人。
天津市第一中心医院制剂室中药材原料检验报告单
检验人:复核人:
一、备注:
1、品名:指需要检验的中药材名称。
2、检验单号:指进货的厂家所提供的检验报告单上的编号。
3、批号:指需要检验的中药材的批号。
4、进货数量:需要检验批号的中药材的进货数量。
5、编号:201 年—XXXX号(例如:2012年—0001号,表明是2012年检验的第一批中药材原料药)。
6、供货单位:需要检验中药材的厂家名称。
7、检验标准:指被检验中药材药典所规定检验项下的要求。
8、检验结果:按照药典方法检验的送检验中药材的检验结果。
9、结论:检验结果是否与检验标准相符合,符合者,结果判定合格。
二、检验项目的选择:选择与该药材所在制剂品种中质量控制项下有关的项目。
例如:ABO颗粒中对陈皮有含量要求,就要按药典要求检验陈皮原料药材中橙皮苷的含量。

原料药稳定性试验报告 Document number:NOCG-YUNOO-BUYTT-UU986-1986UTL-腈化物稳定性试验报告一、概述L-腈化物是L-肉碱生产过程中的第一步中间体(第二步中间体:L-肉碱粗品;第三步中间体:L-肉碱潮品),由于L-肉碱生产工艺为间歇操作,即每生产一步中间体,生产完毕并出具合格检测报告后,存入中间体仓库,以备下一步生产投料所需。
根据本公司L-肉碱产品的整个生产周期,L-腈化物入库后可能存放的最长时间为4周(约28天)。
以此周期为时间依据制定了L-腈化物稳定性试验方案,用于验证L-腈化物在再试验期限内的各项质量指标数据的稳定性,并且能否符合L-腈化物的质量标准,此次稳定性试验的整个周期为28天,具体的稳定性试验方案以ICH药物稳定性指导原则为基础制定,以确保L-腈化化物稳定性试验的可操作性。
二、验证日期2010年1月13日----2010年2月10日三、验证方案1)样品储存和包装:考虑到L-腈化物今后的贮藏、使用过程,本次用于稳定性试验的样品批次与最终规模生产所用的L-腈化物的包装和放置条件相同。
2)样品批次选择:此次稳定性试验共抽取三批样品,且抽取样品的批次与最终规模生产时的合成路线和生产工艺相同3),以确保试验次数足以满足L-腈化物的稳定性试验的需要。
4)检测项目:根据L-腈化物的质量标准的规定,此次稳定性试验的检测项目共五项,分别为外观、氯含量、熔点、比旋度、干燥失重。
这些指标在L-腈化物的储存过程中可能会发生变化,且有可能影响其质量和有效性。
5)试样来源和抽样:L-腈化物由公司102车间生产,经检测合格后储存于中间体仓库,本次稳定性试验的L-腈化物均取自于该中间体仓库,其抽样方法和抽样量均按照L-腈化物抽样方案进行抽样。
抽样完毕后直接进行检测分析,并对检测结果进行登记,保存,作为稳定性数据评估的依据。
四、稳定性试验数据变化趋势分析及评估通过对三批L-腈化物的稳定性试验,对其物理、化学方面稳定性资料进行评价,旨在建立未来相似情况下,大规模生产出的L-腈化物是否适用现有的再试验期(28天)。
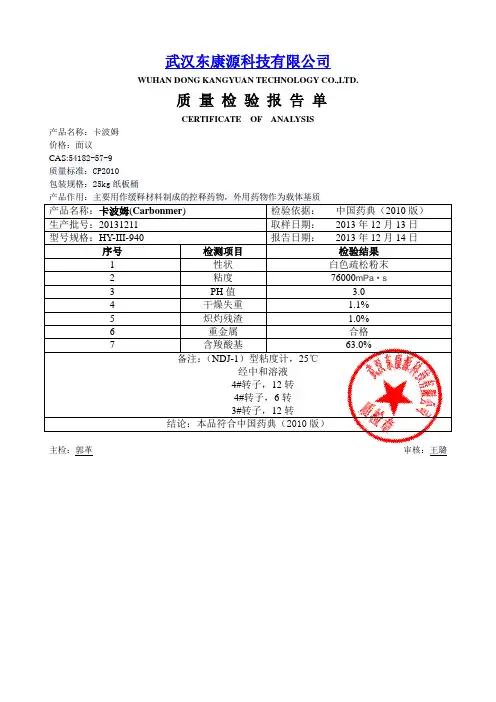
武汉东康源科技有限公司
WUHAN DONG KANGYUAN TECHNOLOGY CO.,LTD.
质量检验报告单
CERTIFICATE OF ANALYSIS
产品名称:卡波姆
价格:面议
CAS:54182-57-9
质量标准:CP2010
包装规格:25kg纸板桶
产品作用:主要用作缓释材料制成的控释药物,外用药物作为载体基质
产品名称:卡波姆(Carbonmer) 检验依据:中国药典(2010版)
生产批号:20131211 取样日期:2013年12月13日
型号规格:HY-III-940 报告日期:2013年12月14日序号检测项目检验结果
1 性状白色疏松粉末
2 粘度76000mPa·s
3 PH值 3.0
4 干燥失重 1.1%
5 炽灼残渣 1.0%
6 重金属合格
7 含羧酸基63.0%
备注:(NDJ-1)型粘度计,25℃
经中和溶液
4#转子,12转
4#转子,6转
3#转子,12转
结论:本品符合中国药典(2010版)
主检:郭革审核:王璐。

药品质量标准研究学习报告通过阅读药品质量研究方面的相关文献,就其内容和过程做了一个学习报告。
药品质量标准是药品的纯度、成分含量、组分、生物有效性、疗效、毒副作用、热原度、无菌度、物理化学性质以及杂质的综合表现。
药品质量的优劣直接影响到药品的安全性和有效性,关系到用药者的健康与生命安危。
质量标准是企业在生产、供应、使用和管理各环节保证药品质量的依据。
因此,起草科学、合理、规范的质量标准在药品研发阶段极其重要。
一、药品质量标准建立的包括以下基本过程:(一)确定药物质量研究一般的内容:(1)性状: 一般来说需根据所研制产品的特性(原料药和制剂)及采用的制备工艺,并结合稳定性研究结果进行质量研究,以使质量研究的内容能充分地反映产品的特性及质量变化的情况。
原料药和制剂从以下方面研究:原料药:外观、色泽、臭、味、结晶性、引湿性、溶解度、熔点或熔距、旋光度或比旋度、吸收系数、相对密度、折光率等制剂:外形、颜色等(2)鉴别:药物的鉴别反应通常是指用可靠的理化方法来证明己知药物的真伪,而不是对未知物进行定性分析。
常用的鉴别试验方法有化学法、色谱法(如薄层色谱法、高效液相色谱法)、光谱法(如紫外-可见分光光度法、红外分光光度法) 等。
因鉴别项的目的是能准确判定被分析物是目标化合物,而非其他物质 ,同时要满足药检所常规快速检验,因此采用的方法需要专属性强、灵敏度高、重复性好、操作简便。
检查项目通常应考虑安全性、有效性和纯度3个方面的内容。
药物按既定的工艺生产和正常贮藏过程会产生杂质,一般需要对一般杂质(如氯化物、硫酸盐、重金属、砷盐、炽灼残渣等)、有关物质(在生产过程中带入的起始原料、中间体、聚合体、副反应产物以及贮藏过程中的降解产物等)、溶液的澄清度与颜色、溶液的酸碱度、残留溶剂、水分(干燥失重)、含量(效价)等进行研究。
选择的条目不宜太多,能足以证明其真实性即可。
有关物质研究是原料药研究的重要内容,对于创新药物,一般可以参照杂质研究技术指导原则,结合药理毒理研究以及临床研究,并依据不同药物的最大日剂量,决定其报告限度、鉴定限度以及质控限度。

附件1:药品生产企业年度质量回顾分析报告撰写指南1、本指南是企业撰写产品年度质量回顾分析报告的指导性文件,各企业可根据实际情况,在积极学习和充分借鉴国内外先进经验的基础上,结合新版GMP,不断完善相关内容,年度质量回顾分析报告模板(附录2、3、4)仅供参考。
2、药品生产企业应建立药品年度质量回顾分析报告制度及药品年度质量回顾分析报告撰写的管理程序和操作规程。
原则上由企业质量受权人牵头负责实施。
各药品生产企业每年向区、市、县食品药品监督局报送《药品生产企业年度药品年度质量回顾分析概要》3、药品年度质量回顾分析报告回顾周期应覆盖一年的时间,始末日期不必与日历的一年相一致,但必须保证上下年度回顾周期不出现时间空缺;4、药品年度质量回顾分析报告原则上按品种开展年度质量回顾分析,对于生产工艺和质量控制相似、生产线共用的品种,可根据企业有关制度规定开展年度药品质量回顾分析。
5、年度生产质量情况,统计范围应包括商业化大生产的所有批次。
统计内容包括总生产批次、总生产量、合格批次、不合格批次、返工批次等,并应对全年产品生产质量情况进行总体评价。
6、超过一年未生产,重新组织生产的产品,年度药品质量回顾分析报告应涵盖上一次年度质量报告至本次年度质量报告期间发生的相关变更和研究内容。
7、药品生产企业可采取合适的分析方法或软件对数据进行趋势分析。
在做趋势分析中,应参考历史数据,分析产品质量变化情况。
8、产品年度质量报告一般应在回顾周期后3个月内完成。
并应对上一年度质量报告中建议的改进措施执行情况进行跟踪报告。
9、各药品生产企业对重点品种进行年度质量回顾分析时,应全面回顾可能影响质量的各环节,进行风险排查,消除安全隐患,分析质量趋势,提出改进的措施和建议,确保药品质量。
10、2010年度药品质量回顾分析报告的首次回顾应涵盖2010年度生产的所有批次产品;企业选择2-3个重点品种进行年度产品质量回顾分析。
重点品种的选择应考虑:⑴、中标并组织生产的基本药物品种;⑵、高风险品种如生产的中药注射剂、注射剂品种;⑶、工艺较难控制的品种;⑷、生产量大的常年生产的品种或按剂型选择有代表性的品种等。

陕西博森生物制药股份集团有限公司镇坪分公司二0一一年产品质量管理情况总结陕西博森生物制药股份集团有限公司镇坪分公司系原陕西镇坪制药厂(始建于1991年),于2009年04月始合并于陕西博森生物制药股份集团有限公司,隶属于陕西博森生物制药股份集团有限公司。
目前原料药品种主要有国家四类新药葛根素,国家四类新药甲磺酸罗哌卡因,国家六类原料药盐酸艾司洛尔、新鱼腥草素钠及绞股蓝皂甙等。
现有1220m2的标准厂房,并严格按GMP要求设计与安装,为我公司进行严格、有效的生产与质量管理提供了良好的硬件条件。
药品是一种特殊的商品,其质量不仅关系到企业的生存,也关系到人民的用药安全,我公司以《药品生产质量管理规范》为准绳,建立健全了生产与质量管理机构,根据生产质量管理的需要,及时添置了一系列先进的生产及检测设备,并坚持了定期校验,从而满足了生产和产品质量管理的需求。
坚持了自物料采购至成品销售各环节的管理制度及操作规程,坚持了对员工进行培训并考核合格后才上岗的规定,各部门、各岗位都能按岗位职责开展工作,质量管理部门对生产全过程进行了有效的质量监控。
在人员管理上,始终坚持聘用、培训、考核制度。
企业负责人及生产、质量负责人均具有大专以上学历,生产质量等部门中,关键岗位的员工均有大专以上或相应专业技术职称,并具有药品生产和质量管理的实践经验,这些都为公司的产品质量管理提供了有力的保证。
在物料管理上,我公司坚持做到了由质量部会同生产部对供应商进行审计,根据我公司所用物料的内控质量标准对供应商的质量体系及生产能力进行审计、评估,最终选定质量好、信誉高的企业与之签订较为固定的供货合同,确保了物料的质量和稳定性。
物料出库执行“先进先出、近期先出”的原则,计量称重有复核,记录完整,有发、领人双重签字。
这样,在源头上确保了产品质量的稳定性。
公司生产环境整洁,生产区周围无污染。
厂区内道路、草坪整洁,下水道畅通良好,洁净区内的地漏有可靠的液封装置,在生产期间,坚持执行了洁净生产区和一般生产区的各项清洁卫生管理制度。

甘肃莫高实业开展股份制药厂复方甘草片年度质量回忆分析年度产品质量回忆分析报告产品名称:复方甘草片规格:100片/瓶×15瓶/盒×20盒/箱50片×300瓶/箱24片×2板/盒×10盒/收缩膜×30条/箱回忆日期:2021年07月01日-2021年07月30日甘肃莫高实业开展股份制药厂复方甘草片年度质量回忆分析[目录]1概要: (1)2回忆期限 (1)3制造情况: (1)4产品描述: (1)4.1 产品工艺 (1)产品给药途径及适应症: (11)关键参数: (11)5.物料质量回忆 (12)5.1 原辅料、包装材料质量问题回忆 (12)5.2 主要原辅料购进情况回忆〔附:原辅料的质量标准〕 (13)5.3 供应商的管理情况回忆 (14)工艺用水、与药品直接接触的气体质量问题回忆 (14)6. 成品质量标准情况: (15)6.1 产品质量标准 (15)质量指标统计及趋势分析 (15)7. 生产工艺分析: (16)关键工艺参数控制情况 (16)中间体控制情况 (16)甘肃莫高实业开展股份制药厂复方甘草片年度质量回忆分析工艺变更情况 (16)7.4物料平衡〔附表2〕 (17)收率〔附表2〕 (17)返工与再加工 (17)8 偏差回忆: (17)9 超常超限回忆: (17)10产品稳定性考察: (18)11拒绝批次: (18)拒绝的物料 (18)拒绝的成品及中间产品 (19)12 变更控制回忆: (19)13 验证回忆: (19)14 环境监测情况回忆: (20)15 人员情况: (21)16 委托加工、委托检验情况回忆: (21)17 不良反响: (21)18产品召回、退货: (21)产品召回 (22)退货 (22)19 投诉: (22)甘肃莫高实业开展股份制药厂复方甘草片年度质量回忆分析20 药品注册相关变更的申报、批准及退审 (22)21 结论: (22)22 建议: (23)表一:年度产品回忆分析表 (24)表二产品各工序收率、平衡统计表 (34)甘肃莫高实业开展股份制药厂复方甘草片年度质量回忆分析1概要:复方甘草片是我厂常年生产品种,产量大,工艺成熟,质量稳定,根据?年度产品质量回忆分析管理规程?的规定,质量保证部于2021年10月对我厂生产的复方甘草片进行了年度产品质量回忆分析。

他达拉非药学研究资料(CTD)目录3.2.S原料药 (1)3.2.S。
4 原料药的质量控制 (1)3.2。
S。
4。
1质量标准 (1)3。
2。
S.4。
2分析方法 (10)3.2。
S4。
3分析方法的验证 (26)3.2。
S。
4.4批检验报告 (138)3.2。
S。
4。
5质量标准制定依据 (142)3。
2。
S原料药3.2.S.4 原料药的质量控制3。
2。
S.4.1 质量标准第1页第2页第3页他达拉非药学研究资料(CTD) 3.2.S.4原料药的质量控制3.2.S.4.1质量标准临床研究用药品质量标准草案他达拉非TadalafeiTadalafil3C22H19N3O4389.40本品为(6R,12aR)—2,3,6,7,12,12a—六氢—2-甲基—6—[3,4—(亚甲基二氧)苯基]吡嗪并[1’,2':1,6]吡啶并[3,4-b]吲哚-1,4—二酮。
按干燥品计算,含C22H19N3O4应为98。
0%~102。
0%。
【性状】本品为白色至类白色粉末;无臭无味。
在N,N—二甲基甲酰胺、二甲亚砜中易溶,略溶于四氢呋喃和乙二醇单甲醚,微溶于甲醇和乙腈,极微溶解于乙醇和异丙醇,在正己烷、正庚烷和水中不溶。
比旋度取本品,精密称定,加二甲亚砜溶解并定容稀释制成每1mL中约含10mg的溶液,依法测定(附录ⅥE),比旋度为+78°~+84°.【鉴别】(1)取本品,加0.1%三氟乙酸水溶液—乙腈(1:1)制成每1 ml中约含10 μg 的溶液,照紫外—可见分光光度法(附录Ⅳ A)测定,在221 nm、284 nm和291nm的波长处有最大吸收.(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致.(3)本品的红外光吸收图谱应与对照品的图谱一致。
【检查】有关物质取本品,精密称定,用0。
1%三氟乙酸水溶液:乙腈=1:1(v:v)溶解并定容稀释制成每1 ml中约含0。
雌酚酮原料药质检报告,雌酚酮原料药CoA 雌酚酮原料药CoA。
自查报告。
为了确保我们生产的雌酚酮原料药符合质量标准,我们进行了自查报告。
以下是我们的自查结果:
外观和颜色,我们检查了雌酚酮原料药的外观和颜色,确保其符合规定的标准。
我们发现原料药的外观为白色结晶粉末,符合要求。
纯度,我们进行了纯度测试,通过高效液相色谱法(HPLC)和质谱法(MS)对雌酚酮原料药进行了分析。
结果显示,原料药的纯度达到了要求的标准,没有发现杂质。
含量,我们对雌酚酮原料药的含量进行了测定,结果显示其含量符合要求的标准范围内。
水分含量,我们进行了水分含量测试,结果显示雌酚酮原料药
的水分含量符合规定的标准,没有超出限制。
重金属含量,我们进行了重金属含量测试,结果显示雌酚酮原料药中的重金属含量符合规定的标准,没有超出限制。
微生物限度,我们对雌酚酮原料药进行了微生物限度测试,结果显示其符合规定的微生物限度要求。
总结,根据我们的自查报告,雌酚酮原料药符合质量标准,可以用于生产高质量的药品。
我们将继续保持对原料药质量的严格把控,确保产品质量稳定可靠。
检验报告样品名称洛伐他汀送检单位送检日期2011年 3 月20 日样品数量100g×6 抽样人员检验单位检验类别委托检验检验依据《中国药典》2010版二部检验项目检验数据标准规定检验结论性状本品为白色或类白色结晶或结晶性粉末,无臭、无味,略有引湿性;本品为白色或类白色结晶或结晶性粉末,无臭、无味,略有引湿性;符合规定溶解度本品在丙酮中溶解,在乙醇、乙酸乙酯、乙腈中略溶,在水中不溶;本品在丙酮中溶解,在乙醇、乙酸乙酯、乙腈中略溶,在水中不溶;符合规定紫外吸收光谱取本品,加乙腈制成每1ml中约含10μg的溶液,紫外风光光度计进行扫描,在230nm,238nm与246nm的波长处有最大吸收;取本品,加乙腈制成每1ml中约含10μg的溶液,紫外风光光度计进行扫描,在230nm,238nm与246nm的波长处有最大吸收;符合规定红外外吸收光谱本品红外光吸收图谱应与对照品的图谱一致。
符合规定检查干燥失重0.18% 不得过0.30%符合规定炽灼残渣0.15% 不得过0.2%符合规定酸不溶性灰分0.8% 不得过1.0%符合规定重金属考察12.86 ppm不得过20ppm符合规定含量测定高效液相色谱法99.9%-100.4%≥98%符合规定结论:送检样品符合《中国药典》2010版二部洛伐他汀质量标准。
检验人:复核人:。
阿司匹林原料药与肠溶片的质量分析实验报告摘要:通过对阿司匹林原料药及肠溶片进行质量分析,并比较不同商家的同类产品,探究其质量差异。
实验结果表明,相比于采用传统合成工艺的样品,采用绿色合成工艺合成的阿司匹林样品具有更优良的质量,而不同品牌的阿司匹林肠溶片质量存在较大差异。
关键词:阿司匹林;质量分析;原料药;肠溶片;绿色合成工艺引言:阿司匹林是一种非常常用的药物,其作用是镇痛、解热、抗炎以及抗血小板凝聚,广泛用于治疗头痛、关节炎、风湿病、心脏病等疾病。
阿司匹林的原料药及肠溶片质量的好坏直接关系到其治疗效果以及安全性。
因此,本实验旨在对阿司匹林的原料药及肠溶片进行质量分析,并探究不同商家的同类产品的质量差异。
实验方法及步骤:原料药的质量分析:1)对不同商家提供的阿司匹林原料药样品进行外观与颜色的比较。
2)利用紫外可见分光光度计,测定不同商家阿司匹林原料药样品的吸收峰值,比较各样品的峰强度差异。
2)采用高效液相色谱法测定不同商家阿司匹林肠溶片样品的含量,比较各样品的含量差异。
3)采用模拟胃肠液对阿司匹林肠溶片样品进行溶出实验,比较各样品的溶出速率差异。
实验结果:1)大多数商家提供的阿司匹林原料药呈白色固体,但有的商家提供的则呈黄色固体,颜色差异较大。
2)吸收峰值分别为240~270 nm之间,各样品峰高度不尽相同。
通过峰高的比较,可以发现采用绿色合成工艺的样品其峰高度更大,具有更好的质量。
3)各样品的平均含量在98~102%之间,同时存在大幅度的梯度差异,表明不同商家提供的阿司匹林原料药样品质量存在差异。
2)各样品的平均含量在95~100%之间,但存在显著的梯度差异。
3)不同品牌阿司匹林肠溶片的溶出速率存在差异,其中A、B两品牌溶出速率较快,而C、D两品牌溶出速率较慢。
原药材检验报告1. 引言本文档是通过对原药材进行检验的报告。
原药材是制药过程中的重要原料,其质量直接影响到最终制品的质量。
通过对原药材进行检验,能够确保原药材的质量合格,以保证制药过程的安全和产品的质量。
2. 背景原药材是指用于制药的天然植物、动物或矿石等材料,它们包含着药用成分,是制药过程中的重要原材料。
原药材的质量直接影响到最终制品的药效和安全性。
因此,在制药过程中需要对原药材进行严格的检验。
3. 目的本次检验旨在评估原药材的质量,确认是否符合制药的要求。
通过对原药材进行检验,可以及时发现潜在的问题,采取相应的措施,保障制药过程的安全和制品的质量。
4. 检验方法本次原药材的检验采用以下方法:•目测检验:对原药材的外观、颜色、形状等进行观察和比较,判断是否符合制药的要求。
•化学成分检验:采用化学分析方法,针对原药材中的主要成分进行定性和定量的检验。
•微生物检验:从原药材中取样,进行微生物培养和鉴定,判断是否存在细菌、真菌等微生物污染。
5. 检验结果经过以上检验方法的检测,得到如下检验结果:•外观:原药材外观整齐,无明显的异味或颜色异常。
•化学成分:原药材中的主要成分符合制药标准,含量在规定范围内。
•微生物:原药材未检测到细菌、真菌等微生物污染。
综上所述,本次原药材的检验结果符合制药的要求,说明原药材的质量合格。
6. 结论本次原药材检验结果证明,原药材的质量符合制药的要求,可以安全地用于制药过程。
7. 建议在今后的制药过程中,仍然需要对原药材进行严格的检验,保障制品的质量和安全。
检验过程中应注意标准的选择和检验方法的准确性,以确保检验结果的可靠性和准确性。
8. 参考文献1.制药行业质量标准,制药协会,2020年。
2.《制药原料药质量标准检验方法》,化学出版社,2018年。
原研药,检验报告原研药原研药原研药定义原研药,即指原创性的新药,经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。
需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制。
在我国,“原研药”主要是指过了专利保护期的进口药。
原研药的开发过程1确定疾病靶标不少疾病通常是因细胞内或细胞表面的某一蛋白的功能异常导致的。
通过药物阻断或者增强该蛋白的活性达到治病的目的。
研发新药首先必须明确关键蛋白,判定药物研发的疾病靶标。
2活性筛选接着制造靶蛋白,筛选靶蛋白生物活性,只有0。
1%显示部分活性符合需要,建立靶蛋白科研模型,选择对靶蛋白有反应性的活性化合物进一步研究,确定活性稳定并能改造的中标化合物为先导结构。
3优化好的药品,不仅要吸收好疗效好,还要避免不良反应,再经过长达三年反复地试验将先前初筛的先导结构改造为符合科研要求的优化分子结构物。
4报告临床前先导结构的特性这些优化的先导结构还要在动物身上中进行各种毒性等试验,符合国家有关法规的,才能进入临床试验。
经过5-7年的临床观察,才能最后确定其对疾病治疗的疗效。
原研药降价的利弊首先,降价对外资企业积极的一面是,售价降低后,能够帮助他们进入三四线市场,进一步打开局面。
不利方面,则是由于售价降低而造成利润降低,不过我认为平均19%的降幅并不是一个很大的数字。
同样,对国内的企业来说,有利的方面在于,如果外资药持续降价,医院选择开外资药的积极性就会有所下降,这也刚好给了国内药业一个机会。
但从另一个角度来看,外资药品降到和国内药品差不多的价格水平,国内药品行业的竞争将会更加激烈,而消费者对于外国产品的偏好可能会在此时显现。
不过对于降价“灭虚火”的做法,郭凡礼认为,肯定不能从根本上解决目前“看病贵”窘境,“关键还是要改变国家?以药养医?的整体情况,不然医院方面热衷开高价药的现实就很难改变,需求仍会存在。
-------《每日经济新闻》原研发药与仿制药在疗效方面的差别中国是一个以生产仿制药为主的国家,随着中国加入WTO原研发药才被重视。