初三化学酸碱盐十大知识点总结
- 格式:doc
- 大小:18.00 KB
- 文档页数:4

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。
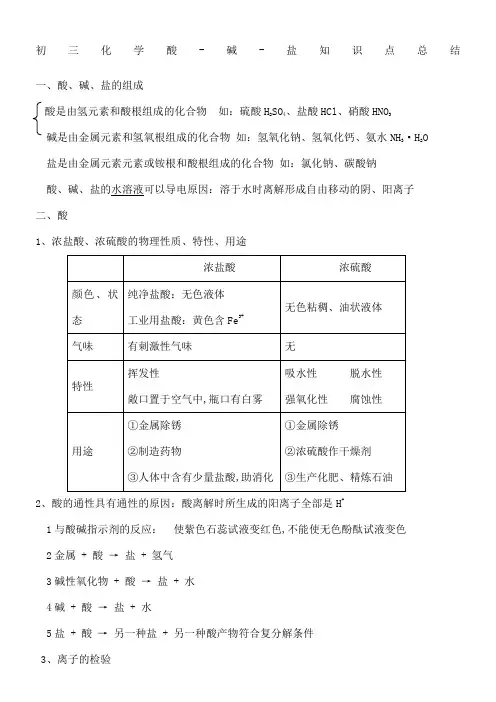
初三化学酸-碱-盐知识点总结一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸H2SO4、盐酸HCl、硝酸HNO3碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水NH3·H2O盐是由金属元素元素或铵根和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电原因:溶于水时离解形成自由移动的阴、阳离子二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性具有通性的原因:酸离解时所生成的阳离子全部是H+1与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色2金属 + 酸→盐 + 氢气3碱性氧化物 + 酸→盐 + 水4碱 + 酸→盐 + 水5盐 + 酸→另一种盐 + 另一种酸产物符合复分解条件3、离子的检验三、碱1、氢氧化钠、氢氧化钙的物理性质、用途2、碱的通性具有通性的原因:离解时所生成的阴离子全部是OH -1碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 2酸性氧化物+碱 → 盐+水 3酸+碱 → 盐+水4盐+碱 → 另一种盐+另一种碱反应物均可溶,产物符合复分解条件 注:①难溶性碱受热易分解不属于碱的通性 如CuOH 2 ΔCuO +H 2O2FeOH 3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ CuOH 2↓ F eOH 3↓ MgOH 2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生.五、酸性氧化物与碱性氧化物四、中和反应 溶液酸碱度的表示法——pH 1、定义:酸与碱作用生成盐和水的反应 2、应用:1改变土壤的酸碱性 2处理工厂的废水 3用于医药3、溶液酸碱度的表示法——pH10 7 14酸性增强 中性 碱性增强 2pH 的测定:最简单的方法是使用pH 试纸用玻璃棒或滴管蘸取待测试液少许,滴在pH 试纸上,显色后与标准比色卡对照,读出溶液的pH 读数为整数3酸雨:正常雨水的pH 约为因为溶有CO 2pH<的雨水为酸雨第十一单元盐化肥知识点+和酸根离子的化合物一、常见的盐定义:能解离出金属离子或NH4二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质.1、实验步骤:溶解、过滤、蒸发2、实验仪器三、盐的化学性质1、盐可溶+ 金属1 →金属2 + 新盐金属1比金属2活泼,K、Ca、Na除外2、盐 + 酸→新盐 + 新酸3、盐 + 碱→新盐 + 新碱反应物需都可溶,且满足复分解反应的条件4、盐 + 盐→两种新盐反应物需都可溶,且满足复分解反应的条件四、酸、碱、盐的溶解性1、 酸:大多数都可溶除硅酸H 2SiO 3不溶2、 碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀3、 盐:钾盐、钠盐、铵盐、硝酸盐都可溶;氯化物除AgCl 难溶外,其余多数均可溶;硫酸盐除BaSO 4难溶,Ag 2SO 4、CaSO 4微溶外,其余多数可溶; 碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶. 注:BaSO 4、、AgCl 不溶于水,也不溶于酸五、化学肥料1、农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构2、化学肥料 氮肥、钾肥、磷肥1氮肥 作用:促进植物茎、叶生长茂盛、叶色浓绿促苗. 缺氮:叶黄a 、常用氮肥尿素CONH 22:含氮量最高的氮肥有机物%b 、NH 4+的检验试剂:碱NaOH 、CaOH 2等、湿润的红色石蕊试纸 NH 4NO 3 + NaOH=NaNO 3 +NH 3 ↑+H 2Oc 、生物固氮:豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收2钾肥作用:促使作物生长健壮、茎杆粗硬,抗倒伏壮秆. 缺钾:叶尖发黄常用钾肥 KCl草木灰:农村最常用钾肥主要成分为K2CO3, 呈碱性K2SO4:长期使用会使土壤酸化、板结3磷肥作用:促进植物根系发达,穗粒增多,饱满催果缺磷:生长迟缓,产量降低,根系不发达常用磷肥磷矿粉 Ca3PO42钙镁磷肥钙和镁的磷酸盐过磷酸钙 CaH2PO42和CaSO4 不能与碱性物质混合施用.重过磷酸钙 CaH2PO42 如草木灰、熟石灰4、复合肥:含N、P、K中的两种或三种KNO3 NH4H2PO4 NH42HPO4 不能与碱性物质混合施用三、使用化肥、农药对环境的影响1、土壤污染:重金属元素、有毒有机物、放射性物质2、大气污染:N20、 NH3 、H2S3、引起水体污染:N、P过多,导致水体富营养化,赤潮、水华等现象四、合理使用化肥1、根据土壤情况和农作物种类选择化肥2、农家肥和化肥合理配用五、氮、磷、钾三种化肥的区别方法。
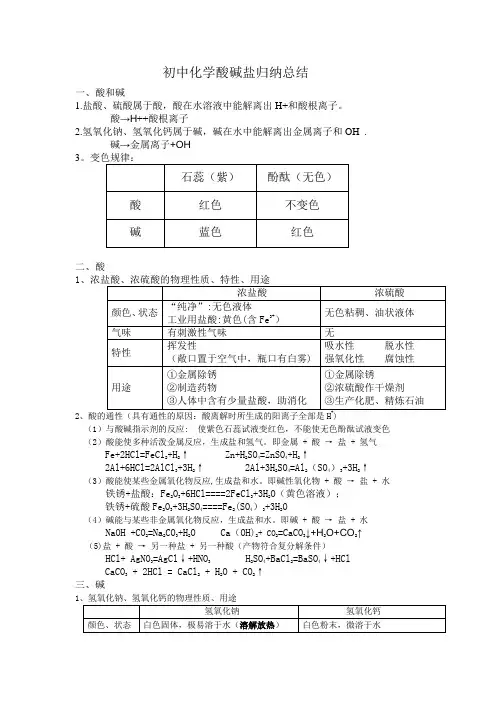
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。

1.酸和碱的定义酸是指能够产生H+离子的物质,碱是指能够产生OH-离子的物质。
2.酸碱中的离子酸产生的离子是H+离子,碱产生的离子是OH-离子。
3.酸碱反应酸和碱反应会生成水和盐。
酸和酸的反应产生的盐叫酸盐,碱和碱的反应产生的盐叫碱盐。
4.酸碱中的pH值pH值是判断溶液酸碱性的指标。
pH小于7的溶液为酸性,pH等于7的溶液为中性,pH大于7的溶液为碱性。
5.酸碱中的酸碱度酸和碱的酸碱度可以通过浓度来表示。
酸的酸碱度以酸的浓度来表示,碱的酸碱度以碱的浓度来表示。
6.盐的性质盐是由酸和碱反应所生成的化合物,具有特定的物理和化学性质。
普通盐呈无色晶体,可溶于水,常见的盐还有氯化物、硫酸盐、硝酸盐等。
7.重要的盐的制备和应用a.氯化钠:通过氯化氢和氢氧化钠的反应制备,广泛用于食盐和食品工业。
b.碳酸钠:通过氯化钠与碳酸氢铵的反应制备,广泛用于生产玻璃、洗涤剂等。
c.硝酸钠:通过硝酸和氢氧化钠的反应制备,广泛用于肥料和炸药工业。
8.酸碱中的指示剂指示剂是用于判断溶液的酸碱性的物质,根据其在酸性、中性和碱性溶液中的颜色变化来判断溶液的性质。
常见的指示剂有酚酞、酚酞红、甲基橙、甲基红等。
9.酸碱中的反应方程式酸碱反应可以用化学方程式来表示。
例如,硫酸和氢氧化钠反应的方程式是H2SO4+2NaOH->Na2SO4+2H2O。
10.酸碱溶液的中和反应酸碱溶液的中和反应是指酸和碱反应生成水和盐的反应。
中和反应通常受到温度、浓度、物质量等因素的影响。
11.酸碱盐的应用酸碱盐在生活和产业中有广泛的应用。
例如,酸可以用于清洁、消毒和金属腐蚀等方面;碱可以用于制造肥皂、玻璃和洗涤剂等方面;盐以及其它化合物还可以用于肥料、药品和生物实验等方面。
12.酸性雨的形成与影响酸性雨是指大气中含有过多的酸性物质,降水时形成的酸性降水。
酸性雨对土壤、水源、植物和动物都有不良的影响,导致环境污染和生态失衡。

初三化学酸碱盐知识点(最全整理版)酸碱盐是化学中的常见概念,涉及到酸、碱和盐的性质、命名规则以及酸碱中和反应等方面。
以下是初三化学酸碱盐的知识点整理:1. 酸的定义:酸是指能够释放出H+离子的物质,通常呈酸性溶液。
2. 酸的性质:酸有酸味,可以腐蚀金属,可以脱色某些有机物质,可以中和碱。
3. 酸的常见实验室制法:酸可以通过金属与非金属氧化物(如二氧化硫、二氧化碳)反应得到。
4. 碱的定义:碱是指能够释放出OH-离子的物质,通常呈碱性溶液。
5. 碱的性质:碱有苦味和涩味,可以腐蚀皮肤,可以中和酸。
6. 碱的常见实验室制法:碱可以通过金属与水反应得到。
7. 盐的定义:盐是由酸和碱中和反应得到的化合物。
盐的离子由酸中的阳离子和碱中的阴离子组成。
8. 索式和名命名法:化合物的化学式中,金属离子写在前面,非金属离子写在后面。
离子交换时,电荷要平衡。
9. 盐的性质:盐是晶体固体,有盐味,可溶于水,不导电的固体。
其溶液呈中性。
10. 酸碱中和反应:酸和碱反应时,酸中的H+离子和碱中的OH-离子结合形成水,同时生成盐。
酸碱中和反应是发生酸碱中和反应的一种特殊类型。
11. 盐的分类:盐可以分为氯化物、硝酸盐、硫酸盐、碳酸盐和磷酸盐。
12. 盐的应用:盐在生活中广泛应用,如食盐、食品加工、肥料、火药等。
13. 酸碱指示剂:酸碱指示剂能够根据物质的酸碱性质的变化而改变颜色,用于酸碱溶液的鉴定。
14. pH值的概念:pH值是反映溶液酸碱性的指标,pH值越小,表示酸性越强;pH值越大,表示碱性越强;pH值为7时,表示中性。
以上是初三化学酸碱盐的知识点整理,希望对你有帮助!。

初三化学酸碱盐十大知识点总结一、电离方程式H2SO4=2H++SO42-NaOH=Na++OH-Al2(SO4)3=2Al3++3SO42-二、物质的俗称和主要成分生石灰——CaO熟石灰、消石灰、石灰水的主要成分——Ca(OH)2石灰石、大理石——CaCO3食盐的主要成分——NaCl纯碱、口碱——Na2CO3烧碱、火碱、苛性钠——NaOH胆矾、蓝矾——CuSO4.5H2O碳酸钠晶体——Na2CO3.10H2O氨水——NH3.H2O三、金属活动性1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四个微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存有的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
(即有不在溶液中存有或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物六、溶液的酸碱性与酸碱度的测定1、指示剂———溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值———溶液的酸碱度pH>7溶液为酸性(越小酸性越强)pH=7溶液为中性pH<7溶液为碱性(越大碱性越强)七、离子的检验Cl-(在溶液中)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
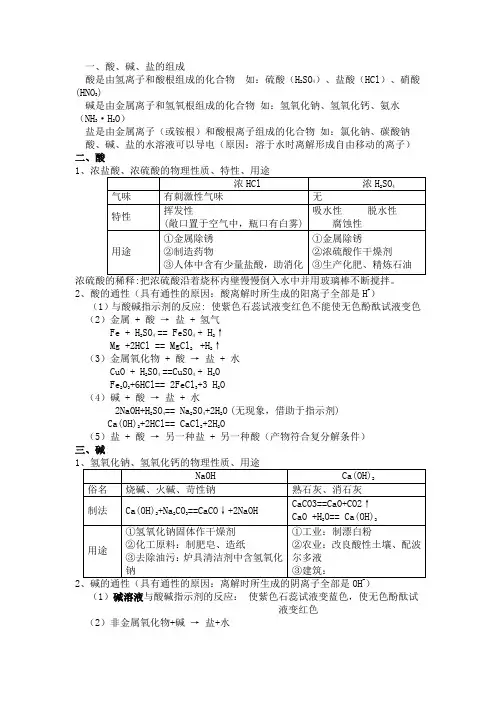
一、酸、碱、盐的组成酸是由氢离子和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属离子和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属离子(或铵根)和酸根离子组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的离子)二、酸12、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色不能使无色酚酞试液变色(2)金属 + 酸→盐 + 氢气Fe + H2SO4== FeSO4+ H2↑Mg +2HCl == MgCl2+H2↑(3)金属氧化物 + 酸→盐 + 水CuO + H2SO4==CuSO4+ H2OFe2O3+6HCl== 2FeCl3+3 H2O(4)碱 + 酸→盐 + 水2NaOH+H2SO4== Na2SO4+2H2O(无现象,借助于指示剂)Ca(OH)2+2HCl== CaCl2+2H2O(5)盐 + 酸→另一种盐 + 另一种酸(产物符合复分解条件)三、碱12(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)非金属氧化物+碱→盐+水CO2 +Ca(OH)2== CaCO3↓+H2O(检验CO2)CO2 +2NaOH== Na2CO3+H2O (吸收CO2)(3)酸+碱→盐+水H2SO4+2NaOH== Na2SO4+2H2O2HCl+ Ca(OH)2== CaCl2+2H2O(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)2NaOH+CuSO4== Cu(OH)2↓+Na2SO43Ca(OH)2+2FeCl3== 2Fe(OH)3↓+3CaCl2四、中和反应溶液酸碱度的表示法——pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(1)0 7 14酸性增强中性碱性增强(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)不能直接伸入待测溶液中,试纸不能事先用水湿润。

初三化学酸碱盐知识点(最全整理版)一、酸性溶液和碱性溶液结论:〔1〕但凡能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;〔2〕但凡能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;〔3〕不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
〔4〕如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质〔1〕酸性物质:山楂、柠檬、柑橘、西红柿等;〔2〕碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念〔1〕酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;H2SO4==2H++SO42-;〔2〕碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;〔3〕盐:电离时生成金属离子〔或铵根离子〕和酸根离子的化合物。
如:NaCl、NH4NO3等。
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;二、溶液的酸碱性的强弱1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。
溶液的pH值与酸碱性关系:pH=7,溶液呈中性;pH7,溶液呈碱性,且pH越大,碱性越强。

初中化学酸碱盐知识点归纳整理酸碱盐是化学中的基本概念,是初中化学的重点内容之一、下面是关于酸碱盐的知识点的归纳整理。
一、酸的性质:1.酸呈酸性,可用pH值来表示。
2.酸与金属产生气体。
3.酸与金属产生盐和氢氧化物。
4.酸与碱反应生成盐和水。
5.酸与碳酸盐反应产生二氧化碳。
6.酸与碱反应生成盐和水,称为酸碱反应。
7.酸与金属氧化物反应生成盐和水。
二、碱的性质:1.碱呈碱性,可用pH值来表示。
2.碱具有苦味,有强韧的腐蚀性。
3.碱与酸中和生成盐和水。
4.碱与银盐反应生成沉淀。
5.碱与铵盐反应产生氨气。
三、酸碱中和反应:1.酸和碱中和反应的产物是盐和水。
2.中和反应是氢离子和氢氧化物离子结合生成水分子的反应。
3.酸碱中和反应是可逆反应,反应正向即为酸碱反应,反应逆向为逆反应。
四、酸碱指示剂:1.酸碱指示剂是一种能够改变颜色的化合物,可用于检测酸碱溶液的性质。
2.酸性溶液中指示剂呈红色或橙黄色,碱性溶液中呈蓝色或紫色,中性溶液中呈绿色。
五、酸盐的性质:1.酸盐能够水解,生成酸和盐。
2.酸盐溶液呈酸性。
六、碱盐的性质:1.碱盐能够水解,生成碱和盐。
2.碱盐溶液呈碱性。
七、晶体水和无水盐:1.晶体水是结合在盐分子中的水分子。
2.一般晶体水可以通过加热蒸发来除去。
3.无水盐是指除去了结晶水的盐。
4.无水盐可以吸湿,重新结晶后变为含水盐。
八、酸碱中和的应用:1.酸碱中和可用于调节土壤酸碱度。
2.酸碱中和可用于制备盐。
3.酸碱中和可用于药物的制备。
4.酸碱中和可用于环境改善,如净化废水。
九、盐的应用:1.盐是化工工业和农业中的重要原料。
2.盐是日常生活中的调味品。
3.盐可用于冶炼金属。
4.盐可用于制造肥料。

酸碱盐的初三化学知识点归纳一、化学用语1、电离方程式H2SO4=2H++SO42-NaOH=Na++OH-Al2SO43=2Al3++3SO42-2、物质的俗称和主要成分生石灰——CaO熟石灰、消石灰、石灰水的主要成分——CaOH2石灰石、大理石——CaCO3食盐的主要成分——NaCl纯碱、口碱——Na2CO3烧碱、火碱、苛性钠——NaOH胆矾、蓝矾——CuSO4·5H2O碳酸钠晶体——Na2CO3·10H2O氨水——NH3·H2O二、化合物的分类三、金属活动性1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液酸溶液或盐溶液中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:1排在氢前的金属能置换出酸里的氢元素。
2排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来K、Ca、Na除外。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:如果不读出括号中的字,是不是一个较好记忆的顺口溜?钾盐、钠盐、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾盐、钠盐、铵盐。
碱类物质溶解性:只有氢氧化钾、氢氧化钠、氢氧化钙、氢氧化钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四个微溶物:CaOH2石灰水注明“澄清”的原因 CaSO4实验室制二氧化碳时不用稀硫酸的原因Ag2SO4鉴别SO42-和Cl-时,不用硝酸银的原因 MgCO3碳酸根离子不能用于在溶液中除去镁离子的原因4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
即有不在溶液中存在或在水溶液中不易电离的物质1不溶性碱只能与酸性发生中和反应2不溶性盐,只有碳酸盐能与酸反应3KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物五、溶液的酸碱性与酸碱度的测定1、指示剂———溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液特例:碳酸钠的水溶液显碱性2、pH值———溶液的酸碱度 pH>7溶液为酸性越小酸性越强 pH=7溶液为中性 pH<7溶液为碱性越大碱性越强六、离子的检验Cl-在溶液中———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。

初三化学酸碱盐十大知识点(3)初三化学酸碱盐十大知识点(3)酸、碱、盐的特性1、浓盐酸———有挥发性、有抚慰性气息、在空气中能构成酸雾。
2、浓硝酸———有挥发性、有抚慰性气息、在空气中能构成酸雾,有强氧化性。
3、浓硫酸———无挥发性。
稀薄的油状液体。
有很强的吸水性和脱水性,溶水时能放出少量的热。
有强氧化性。
4、氢氧化钙———白色粉末、微溶于水。
5、氢氧化钠———白色固体、易潮解,溶水时缩小量热。
能与空气中的二氧化碳反响而蜕变。
6、硫酸铜———白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4·5H2O)。
7、碳酸钠———白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3·10H2O)8、氨水(NH3·H2O)———属于碱的溶液十、酸与碱的通性和盐的性质1、酸的通性(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
(2)酸能与生动金属反响生成盐和氢气(3)酸能与碱性氧化物反响生成盐和水(4)酸能与碱反响生成盐和水(5)酸能与某些盐反响生成新的盐和新的酸2、碱的通性(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变白色(2)碱能与酸性氧化物反响生成盐和水(3)碱能与酸反响生成盐和水(4)某些碱能与某些盐反响生成新的盐和新的碱3、盐的性质(1)某些盐能与较生动的金属反响生成新的盐和金属(2)某些盐能与酸反响生成新的盐和新的酸(3)某些盐能与某些碱反响生成新的盐和新的碱(4)有些不同的盐之间能反响生成两种新的盐(完)。
初中化学酸碱盐知识点总结酸碱盐是化学中的一大重要概念,它在日常生活中扮演着重要的角色。
以下是初中化学中酸碱盐的相关知识点的总结。
1.酸的性质和特征-酸有酸味,可腐蚀金属。
-酸在水溶液中导电。
-酸会变红蓝石蕊试纸红。
-酸和碱反应可以产生盐和水。
2.碱的性质和特征-碱有苦味,滑腻。
-碱在水溶液中导电。
-碱会变红纸蓝。
-碱和酸反应可以产生盐和水。
3.盐的性质和特征-盐是由阳离子和阴离子组成的晶体。
-盐在水中溶解时会导电。
-盐的溶液味道咸。
-盐可以通过酸碱中和反应制备。
4.酸的酸度和碱的碱度-酸的酸度可以用pH值来表示,pH值越小,酸度越大。
-碱的碱度可以用pH值来表示,pH值越大,碱度越大。
5.酸碱中和反应-酸和碱反应,生成盐和水的反应称为酸碱中和反应。
-酸碱中和反应中,酸和碱的摩尔比是1:1-酸碱中和反应是放热反应。
6.酸碱指示剂-酸碱指示剂可以用来检测溶液是酸性、中性还是碱性。
-酸碱指示剂可根据其颜色的变化来判断溶液的酸碱性。
-常用的酸碱指示剂有酚酞、甲基橙、溴蓝等。
7.盐的命名规则-盐的命名通常以阴离子的名称来作为盐的名称。
-如果阴离子是单质元素,就用元素名来命名。
-如果阴离子是由多个原子组成的复杂离子,则用化学式来命名。
8.酸和碱的常见名称和化学式-酸常见的名称有盐酸、硫酸、硝酸等。
-碱常见的名称有氢氧化钠、氢氧化铜等。
-酸和碱的化学式的记法规则如下:-酸的化学式通常以H开头,如HCl、H2SO4-碱的化学式以氢氧化物的形式出现,如NaOH、Ca(OH)29.中和反应的计算-在酸碱中和反应中,可以根据所用的物质的量关系来计算,使用化学方程式的配平。
-配平方程式可以通过将反应式两边的化学式前添加系数来实现。
酸碱盐知识点总结一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H +。
酸是由氢离子和酸根离子构成。
12.酸的通性: 盐 酸 HCl 硫 酸 H 2SO 4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气 Zn+2HCl=ZnCl 2+H 2↑ Zn+ H 2SO 4 =ZnSO 4+H 2↑碱性氧化物+酸→盐+水 Fe 2O 3+6HCl=2FeCl 3+3H 2O Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 碱+酸→盐+水 NaOH+HCl=NaCl+ H 2O Cu(OH)2+H 2SO 4= CuSO 4+2H 2O盐+酸→另一种盐+另一种酸 AgNO 3+HCl=AgCl↓+HNO 3 BaCl 2+H 2SO 4=BaSO 4↓ +2HCl 注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性定义:电离时生成的阴离子全部是OH -离子。
碱是由金属离子(或铵根离子)和氢氧根离子构成。
1碱使紫色石蕊试液变蓝,使无色酚酞试液变红。
氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红。
初三化学酸、碱、盐九大知识点 氧化物、酸、碱和盐的知识点可以从以下十个方面掌握:【一】化学用语1、电离方程式H2SO4=2H++SO42- NaOH=Na++OH- Al2(SO4)3=2Al3++3SO42-2、物质的俗称和主要成分生石灰CaO 熟石灰、消石灰、石灰水的主要成分Ca(OH)2石灰石、大理石CaCO3 食盐的主要成分NaCl 纯碱、口碱Na2CO3烧碱、火碱、苛性钠NaOH 胆矾、蓝矾CuSO45H2O碳酸钠晶体Na2CO310H2O 氨水NH3H2O【二】化合物的分类【三】金属活动性1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
【四】酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四个微溶物:Ca(OH)2(石灰水注明澄清的原因) CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因) MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁【五】分解反应发生的条件反应后有气体、水或沉淀生成。
初三化学酸碱盐知识点最全整理版一、酸碱盐的基本概念酸碱盐是指化合物中含有酸性离子和碱性离子的化合物,它们在水溶液中能够产生酸、碱或盐的性质。
二、酸的概念与性质1. 酸的定义:酸是指能够产生H+(氢离子)的物质。
2. 酸的性质:a) 酸与金属反应产生盐和氢气;b) 酸与碱反应产生盐和水;c) 酸与金属碱式盐反应产生盐和水;d) 酸与金属氧化物反应产生盐和水。
三、碱的概念与性质1. 碱的定义:碱是指能够产生OH-(氢氧根离子)的物质。
2. 碱的性质:a) 碱溶液具有碱性;b) 碱能与酸反应产生盐和水;c) 碱与非金属氧化物反应生成盐和水。
四、酸碱反应1. 酸与金属氧化物的反应:a) 酸与金属氧化物反应生成盐和水;b) 酸和金属氧化物的反应方程式为:酸+ 金属氧化物→ 盐+ 水。
2. 酸与金属氢化物的反应:酸与金属氢化物反应生成盐和氢气,反应方程式为:酸 + 金属氢化物→ 盐 + 氢气。
3. 酸与碱的反应:酸与碱反应生成盐和水,反应方程式为:酸 + 碱→ 盐 + 水。
4. 酸与金属的反应:酸与金属反应生成盐和氢气,反应方程式为:酸 + 金属→ 盐 +氢气。
五、酸碱指示剂酸碱指示剂可用来检测溶液的酸碱性质,常用的酸碱指示剂有酚酞、甲基橙、溴酚蓝等。
六、pH值pH值用来表示溶液的酸碱性,其计算公式为pH = -log[H+],其中[H+]表示溶液中的氢离子浓度。
a) pH值小于7的溶液为酸性溶液;b) pH值大于7的溶液为碱性溶液;c) pH值等于7的溶液为中性溶液。
七、盐的性质与分类1. 盐的性质:a) 盐的固态结晶体呈现颗粒状;b) 盐可溶于水,生成电离的阳离子和阴离子;c) 盐的溶液能导电;d) 盐在高温下能产生颜色。
2. 盐的分类:a) 氯盐:含有氯离子的盐类,如氯化钠(NaCl);b) 硫盐:含有硫离子的盐类,如硫酸钙(CaSO4);c) 亚硝酸盐:含有亚硝酸根离子的盐类,如亚硝酸钠(NaNO2);d) 酸式盐:含有酸性离子的盐类,如硫酸钠(NaHSO4);e) 硼酸盐:含有硼酸根离子的盐类,如硼酸钠(Na2B4O7);f) 碳酸盐:含有碳酸根离子的盐类,如碳酸钠(Na2CO3)。
初中化学酸碱盐知识归纳一、酸、碱、盐的组成1、酸是由氢元素和酸根组成的化合物,如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)2、碱是由金属元素和氢氧根组成的化合物,如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)3、盐是由金属元素元素(或铵根)和酸根组成的化合物,如:氯化钠、碳酸钠4、酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性(1)浓盐酸具有挥发性,溶液放置一段时间后浓度会减小。
(2)浓硫酸❖吸水性,在实验室中常用它做干燥剂(干燥:O2、H2、N2、CO2、CO)(NH3不行)❖脱水性,能夺取含碳、氢、氧等元素组成的化合物里的“水分”(氢、氧元素),生成黑色的炭和水。
❖强烈的腐蚀性❖强氧化性注:稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
(酸入水)2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸→ 盐 + 氢气(3)碱性氧化物 + 酸→ 盐 + 水(4)碱 + 酸→ 盐 + 水(5)盐 + 酸→ 另一种盐 + 另一种酸(产物符合复分解条件)三、碱(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→ 盐+水(3)酸+碱→ 盐+水(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①常见沉淀:AgCl↓,BaSO4↓,Cu(OH)2↓,F e(OH)3↓,Mg(OH)2↓,BaCO3↓,CaCO3↓②复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、中和反应与溶液酸碱度的表示法--pH1、定义:酸与碱作用生成盐和水的反应2、溶液酸碱度的表示法--pH(1)(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)六、熟记常见物质的俗称和化学式:生石灰—— CaO 熟石灰——Ca(OH)2 石灰石、大理石—— CaCO3食盐——NaCl 火碱、烧碱、苛性钠—— NaOH 纯碱、苏打——Na2CO3 小苏打——NaHCO3 金刚石、石墨——C 干冰——CO2 冰——H2O 天然气(甲烷)——CH4 酒精(乙醇)—— C2H5OH 醋酸(乙酸)——CH3COOH七、熟记常见物质的颜色:(1)红色的固体——Cu、Fe2O3 、P(红磷)(2)黑色的固体——C、CuO、Fe3O4、FeO、MnO2(3)暗紫色的固体——KMnO4(4)黄色的固体—— S(5)蓝色絮状沉淀——Cu(OH)2(6)红褐色絮状沉淀——Fe(OH)3(7)蓝色的溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液(8)浅绿色的溶液——FeSO4、FeCl2等含Fe2+溶液(9)黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液八、物质的检验和鉴别:1、检验稀盐酸(或Cl-)——取少量待检液体于洁净的试管中,滴入几滴AgNO3溶液和稀HNO3,有白色沉淀产生。
九年级酸碱盐知识点归纳总结酸碱盐是初中化学中的重要内容之一,而对于九年级的学生来说,更需要全面了解酸碱盐的相关知识。
本文将对九年级酸碱盐知识点进行归纳总结,旨在帮助学生更好地掌握这一部分内容。
一、酸碱与物质性质1.酸的性质:(1)酸的味道酸酸的,有酸的气味;(2)酸可以腐蚀金属;(3)酸可以变红蓝石蕊纸;(4)酸和碱反应会产生中和反应。
2.碱的性质:(1)碱的味道苦苦的,有碱的气味;(2)碱可以腐蚀皮肤;(3)碱可以变红蓝石蕊纸;(4)碱和酸反应会产生中和反应。
3.酸碱指示剂:(1)酸性溶液红色指示剂为苏丹红;(2)中性溶液无色指示剂为水;(3)碱性溶液蓝色指示剂为甲基橙。
二、常见酸碱盐的性质1.酸:(1)盐酸(HCl):无色液体,具有刺激性气味,可以和金属反应产生氢气。
(2)硫酸(H2SO4):无色液体,具有刺激性气味,可以和金属反应产生氢气。
2.碱:(1)氢氧化钠(NaOH):固体,有腐蚀性,可溶于水,会和酸反应产生化学反应热。
(2)氢氧化钾(KOH):固体,有腐蚀性,可溶于水,会和酸反应产生化学反应热。
3.盐:(1)氯化钠(NaCl):白色结晶体,无味,可溶于水。
(2)硝酸钙(Ca(NO3)2):无色结晶体,无味,可溶于水。
三、酸碱中和反应1.酸碱反应的表达方式:酸 + 碱→ 盐 + 水2.实验条件:通常情况下,酸碱反应需要在水介质中进行,在适当的温度和压力下进行反应。
3.常见的酸碱反应:(1)盐酸与氢氧化钠的反应:HCl + NaOH → NaCl + H2O(2)硫酸与氢氧化钾的反应:H2SO4 + 2KOH → K2SO4 + 2H2O四、酸碱盐的应用1.食品酸碱度调节:食品加工中常使用果酸、醋酸等酸性物质和氢氧化钠、氢氧化钙等碱性物质进行食品酸碱度的调节,以改善食品口感和保鲜效果。
2.肥料制备:磷酸和钾肥是常见的植物肥料,可以提供植物所需的营养元素。
3.药品制备:碱性药品常用于中和胃酸,如制备抗酸药和抑酸剂等。
今天小编就为大家整理了一篇有关初三化学知识点总结:初三化学酸碱盐十大知识点总结的相关问题,以供大家阅读!
一、电离方程式
H2SO4=2H++SO42-
NaOH=Na++OH-
Al2(SO4)3=2Al3++3SO42-
二、物质的俗称和主要成分
生石灰——CaO
熟石灰、消石灰、石灰水的主要成分——Ca(OH)2
石灰石、大理石——CaCO3
食盐的主要成分——NaCl
纯碱、口碱——Na2CO3
烧碱、火碱、苛性钠——NaOH
胆矾、蓝矾——
碳酸钠晶体——
氨水——
三、金属活动性
1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:
(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、
Ca、Na除外)。
四、酸、碱、盐的溶解性
1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁
3、四个微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)
4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁
五、分解反应发生的条件反应后有气体、水或沉淀生成。
(即有不在溶液中存在或在水溶液中不易电离的物质)
(1)不溶性碱只能与酸性发生中和反应
(2)不溶性盐,只有碳酸盐能与酸反应
(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物
六、溶液的酸碱性与酸碱度的测定
1、指示剂———溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝
无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
2、pH值———溶液的酸碱度pH>7溶液为酸性(越小酸性越强)pH=7溶液为中性pH<7溶液为碱性(越大碱性越强)
七、离子的检验
Cl-(在溶液中)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(在溶液中)———在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-
(1)(固体或溶液)———在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
(2)(在溶液中)———在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
注:
1、在鉴别Cl-和SO42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显。
2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。
八、酸、碱、盐的特性
1、浓盐酸———有挥发性、有刺激性气味、在空气中能形成酸雾。
2、浓硝酸———有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
3、浓硫酸———无挥发性。
粘稠的油状液体。
有很强的吸水性和脱水性,溶水时能放出大量的热。
有强氧化性。
4、氢氧化钙———白色粉末、微溶于水。
5、氢氧化钠———白色固体、易潮解,溶水时放大量热。
能与空气中的二氧化碳反应而变质。
6、硫酸铜———白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜)。
7、碳酸钠———白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体)
8、氨水()———属于碱的溶液
九、酸与碱的通性
1、酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
(2)酸能与活泼金属反应生成盐和氢气
(3)酸能与碱性氧化物反应生成盐和水
(4)酸能与碱反应生成盐和水
(5)酸能与某些盐反应生成新的盐和新的酸
2、碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色
(2)碱能与酸性氧化物反应生成盐和水
(3)碱能与酸反应生成盐和水
(4)某些碱能与某些盐反应生成新的盐和新的碱
十、盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属
(2)某些盐能与酸反应生成新的盐和新的酸
(3)某些盐能与某些碱反应生成新的盐和新的碱
(4)有些不同的盐之间能反应生成两种新的盐。