GMP认证全套文件资料03-×××颗粒质量标准
- 格式:doc
- 大小:22.50 KB
- 文档页数:2
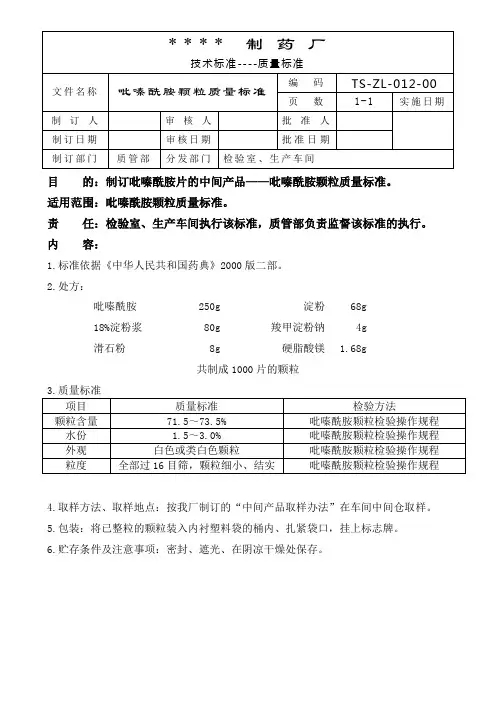
目的:制订吡嗪酰胺片的中间产品——吡嗪酰胺颗粒质量标准。
适用范围:吡嗪酰胺颗粒质量标准。
责任:检验室、生产车间执行该标准,质管部负责监督该标准的执行。
内容:
1.标准依据《中华人民共和国药典》2000版二部。
2.处方:
吡嗪酰胺250g 淀粉68g
18%淀粉浆80g 羧甲淀粉钠4g
滑石粉8g 硬脂酸镁 1.68g
共制成1000片的颗粒
3.质量标准
4.取样方法、取样地点:按我厂制订的“中间产品取样办法”在车间中间仓取样。
5.包装:将已整粒的颗粒装入内衬塑料袋的桶内、扎紧袋口,挂上标志牌。
6.贮存条件及注意事项:密封、遮光、在阴凉干燥处保存。


机构与人员药品GMP认证(原料药)检查评定标准一、药品GMP认证(原料药)检查项目共172项,其中关键项目(条款号前加“*”)47项,一般项目125项。
二、药品GMP认证(原料药)检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
- 1 –培训教材一、机构与人员*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1.有企业的组织机构图。
1.1组织机构图中体现企业各部门的设置、隶属关系及各部门之间的关系,其中生产和质量管理部门分别独立设置。
1.2组织机构图中体现质量管理部门受企业负责人直接领导。
1.3组织机构图中明确各部门名称及部门负责人。
2.岗位职责。
2.1制定了各级领导的岗位职责。
2.2制定了各部门及负责人的职责,特别是质量管理部门有独立的权限,并能对生产等部门执行《药品生产质量管理规范》进行临督和制约。
2.3制定了各岗位的岗位职责。
2.4岗位职责的制定能体现GMP的所有规定,权力、责任明确,且无交叉,无空白。
0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。

一、文件管理档案⑴现行文件目录;⑵一套完整的存档受控文件并按文件编码分类排列;⑶文件发放记录、关键文件会审记录(如:文件管理程序、变更管理、偏差管理、物料管理、供应商管理、产品召回、退货等涉及部门多和规定范围广的文件);⑷文件变更台帐和变更记录;⑸过时、作废文件回收、销毁记录(过时、作废文件原件加盖过时或作废印章并与现行文件原件分开存放,以便专家追溯)。
二、质量档案:按《质量档案管理程序》执行,包括各品种生产批件三、印刷包材档案⑴印刷包材药监部门批件;⑵供应商印刷前彩稿(或墨稿)的QA签字审核件;⑶ 标准样张:① 包材实样经QA签字的盖章件和分发记录(旧版本留档一份并有回收和销毁记录);② 现行包材实样的分发:QA、QC、采购、库房、车间各一份,作为采购、验收、检验、使用的标准;四、机构职责⑴公司组织机构图、质量管理机构图、各部门/车间的组织机构图;⑵GMP认证领导小组、自检小组、供应商审计评估小组、药品质量风险管理小组、药品召回领导小组、变更控制小组、偏差处理领导小组、验证委员会组成人员名单及公司批准证明文件;⑶各级机构职能、岗位职责;员工花名册,可再细分管理人员列表、质量管理人员列表、⑷技术人员列表;内容包括编号、岗位、姓名、性别、出生年月、学历、毕业院校、专业、从药年限、职称、入司时间、备注;五、人事健康档案⑴ 人事档案:① 个人简历(包括毕业院校、专业和工作经验、从药年限)、毕业证、职称证;② 中层以上干部的任免文件,总经理授权副总主管产品放行人员的授权委托书,取样等指定人员的专项培训记录和授权书;③ 关键岗位外部资格证:化验员、锅炉工、电工、计量员、中药购销(验收)员;④ 主管质量的企业负责人、质量部门负责人、生产部门负责人的备案表等;⑵ 健康档案:①员工健康卡、历年县级以上单位健康体检证明(体检表、健康证等);②体检结果异常处理情况证明、复岗体检合格证明③注意:包括整个生产质量系统(生产、质量、库房、采购、动力、机修、行政后勤),容易漏掉清洁工、临时工、机修、厨师等;生产质量系统每年至少体检一次,其他建议两年一次;六、培训档案⑴公司培训档案:①公司培训规划、每年度培训计划、培训实施情况(培训记录)及培训效果评估表;②每次培训签到表和培训教材(若为书本或文件可不收集) ;③培训空白考卷(考试可为培训一次考一次,也可为培训一阶段考核一次,但文件培训必须在其生效日期前完成)⑵ 个人培训档案① 员工培训卡、考核试卷或其他方式的培训效果评价记录;② 外出培训总结、证明;③ 培训合格上岗证明、不合格调整工作岗位记录;④ 每人一档,企业分层次对全员培训。
PA-04-006-00
中间站物料进站记录台帐
PA-04-009-00
中间站物料出站记录台帐
中间站名称:
PF-04-029-00
整粒生产记录
在产物品标签
工序:
在产物品标签
工序:
PF-04-022-00 一般生产区清场记录
试产品销毁记录
试产品销毁记录
试产品销毁记录
片剂工艺查证记录
日期:年月日~年月日
PF-04-025-00 批物料平衡表
PF-03-01-00
批生产计划指令单
1、印有批号的标签样张;
2、印有批号的小盒、中盒样张;
3、使用说明书样张;
4、产品合格证样张。
粘贴处:
批包装记录附件
5、印有批号的标签样张;
6、印有批号的小盒、中盒样张;
7、使用说明书样张;
8、产品合格证样张。
粘贴处:
批包装记录附件
9、印有批号的标签样张;
10、印有批号的小盒、中盒样张;
11、使用说明书样张;
12、产品合格证样张。
粘贴处:
PF-04-028-00
模具筛网使用记录表
颗粒剂工艺
查证记录
日期:年月
TF-00-004-00
胶囊剂工艺查证记录
月日
PF-04-034-00 工艺指令(一)
日期:
PF-04-035-00 工艺指令(二)
日期:
PF-04-036-00 工艺指令(三)
日期:
PA-04-008-00 工衣清洁记录
PF-04-009-00 高效包衣生产记录
工艺员:
PA-04-010-00 车间包装材料退库记录。


技术标准----质量管理文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-1 实施日期制订人审核人批准人制订日期审核日期批准日期制订部门质管部分发部门生产部、供应部、检验室、成品仓目的:制订诺氟沙星胶囊质量标准及内控标准。
适用范围:诺氟沙星胶囊质量标准及内控标准。
责任:检验室、生产车间及成品仓执行该标准,质管部负责监督该标准的执行。
标准:1.标准依据:《中华人民共和国药典》2000版二部2.批准文号:&卫药准字(1996)第507063号3.处方:3.1来源:本厂3.2依据:《中华人民共和国药典》2000版二部。
3.3处方:诺氟沙星100g 淀粉112g微晶纤维素50g 15%预胶化淀粉浆124g羧甲淀粉钠8.4g 硬脂酸镁 1.6g共制成1000粒3.4剂型:硬胶囊剂3.5包装规格:0.1g/粒10粒×800盒/箱20粒×300瓶/箱10粒×50板×40盒/箱10粒×5板×160盒/箱4.法定质量标准及内控标准4.1法定质量标准文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-2项目法定质量标准标准依据性状胶囊剂、内容物为白色至淡黄色粉末中国药典2000年版二部鉴别应符合规定中国药典2000年版二部装量差异应符合规定中国药典2000年版二部溶出度Q≥75% 中国药典2000年版二部含量测定应为标示量的90.0%~110.0%中国药典2000年版二部微生物限度检查细菌总数不得过1000个,霉菌、酵母菌数不得过100个控制菌不得检出中国药典2000年版二部4.2内控质量标准4.2.1外观质量标准及质量控制方法项目外观质量标准质量控制方法整体外观整洁、2号胶囊大小相等、长短一致、无斑点车间质管员在线监控,检验室成品抽样检查。
色泽蓝白胶囊,颜色均匀一致,无褪色、无变色粘连、发霉、变形、异臭不得有砂眼、虫眼、破裂、漏药不得有内容物结块、霉变不得有4.2.2.内在质量标准及检验方法项目质量标准检验方法性状胶囊剂,内容物为白色至淡黄色粉末诺氟沙星胶囊成品检验标准操作规程鉴别应符合规定重量差异应符合规定溶出度Q≥80%含量测定应为标示量的94.0%~107.0% 4.2.3卫生学标准及测定方法文件名称诺氟沙星胶囊质量标准及内控标准编码TS-ZL-008-00页数4-3项目卫生学标准测定方法微生物限度检查细菌总数不得过1000个霉菌、酵母菌数不得过100个控制菌不得检出微生物限度检查标准操作规程5.包装品的质量标准。

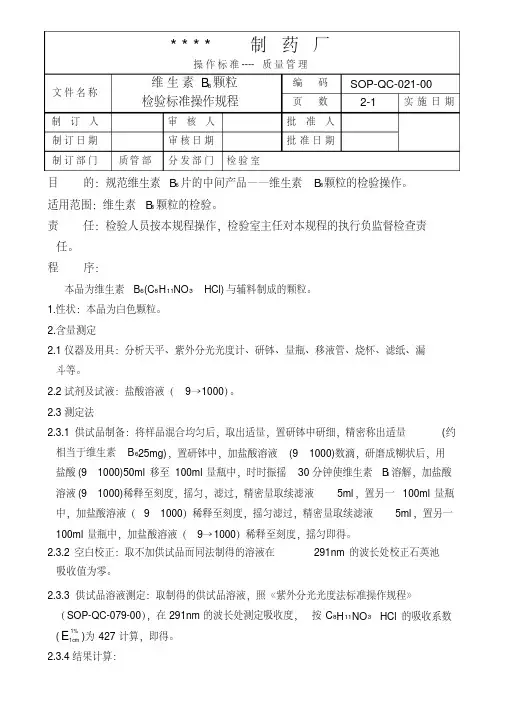
操作标准----质量管理文件名称维生素B6颗粒检验标准操作规程编码SOP-QC-021-00页数2-1 实施日期制订人审核人批准人制订日期审核日期批准日期制订部门质管部分发部门检验室目的:规范维生素B6片的中间产品——维生素B6颗粒的检验操作。
适用范围:维生素B6颗粒的检验。
责任:检验人员按本规程操作,检验室主任对本规程的执行负监督检查责任。
程序:本品为维生素B6(C8H11NO3·HCl)与辅料制成的颗粒。
1.性状:本品为白色颗粒。
2.含量测定2.1仪器及用具:分析天平、紫外分光光度计、研钵、量瓶、移液管、烧杯、滤纸、漏斗等。
2.2试剂及试液:盐酸溶液(9→1000)。
2.3测定法2.3.1供试品制备:将样品混合均匀后,取出适量,置研钵中研细,精密称出适量(约相当于维生素B625mg),置研钵中,加盐酸溶液(91000)数滴,研磨成糊状后,用盐酸(91000)50ml移至100ml量瓶中,时时振摇30分钟使维生素B6溶解,加盐酸溶液(91000)稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置另一100ml量瓶中,加盐酸溶液(91000)稀释至刻度,摇匀滤过,精密量取续滤液5ml,置另一100ml量瓶中,加盐酸溶液(9→1000)稀释至刻度,摇匀即得。
2.3.2空白校正:取不加供试品而同法制得的溶液在291nm的波长处校正石英池吸收值为零。
2.3.3供试品溶液测定:取制得的供试品溶液,照《紫外分光光度法标准操作规程》(SOP-QC-079-00),在291nm的波长处测定吸收度,按C8H11NO3·HCl的吸收系数(E cm11%)为427计算,即得。
2.3.4结果计算:操作标准-----质量管理文件名称维生素B 6颗粒检验标准操作规程编码SOP-QC-021-00页数2-22.3.5允许误差:相对偏差应<3%。
%供试品取样量供试品吸收度含量100100100550427=%。
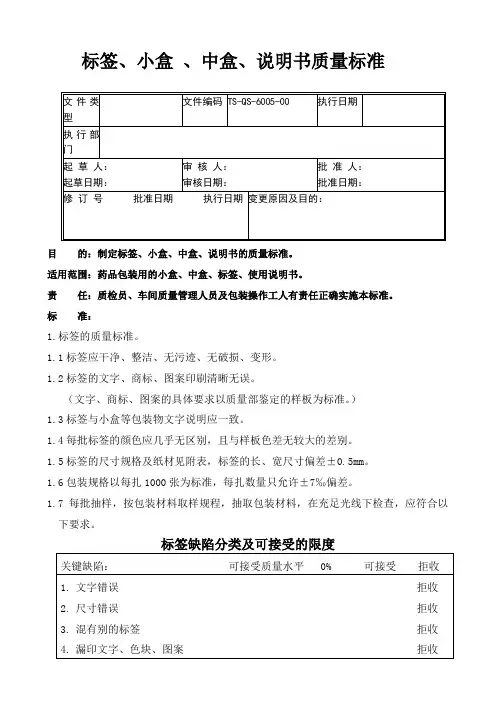
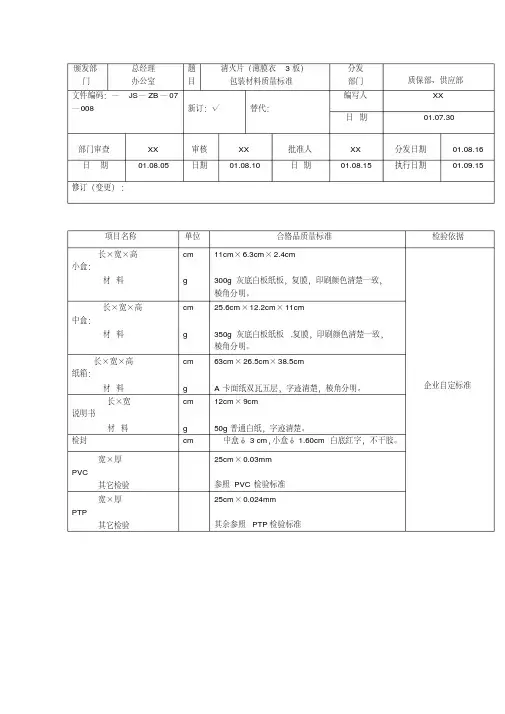
标签、小盒、中盒、说明书质量标准目的:制定标签、小盒、中盒、说明书的质量标准。
适用范围:药品包装用的小盒、中盒、标签、使用说明书。
责任:质检员、车间质量管理人员及包装操作工人有责任正确实施本标准。
标准:1.标签的质量标准。
1.1标签应干净、整洁、无污迹、无破损、变形。
1.2标签的文字、商标、图案印刷清晰无误。
(文字、商标、图案的具体要求以质量部鉴定的样板为标准。
)1.3标签与小盒等包装物文字说明应一致。
1.4每批标签的颜色应几乎无区别,且与样板色差无较大的差别。
1.5标签的尺寸规格及纸材见附表,标签的长、宽尺寸偏差±0.5mm。
1.6包装规格以每扎1000张为标准,每扎数量只允许±7‰偏差。
1.7每批抽样,按包装材料取样规程,抽取包装材料,在充足光线下检查,应符合以下要求。
标签缺陷分类及可接受的限度2.小盒、中盒的质量标准。
2.1纸盒表面平整、光滑、干净、无破损,无斑点,无雾化离层和受潮现象。
2.2纸盒文字印刷清晰无误,商标及图案清晰美观。
2.3文字、商标、图案的具体要求以质管部签定的样板为标准。
2.4每批小盒、中盒颜色深浅几乎无区别,且与样板的色差无较大的差别。
2.5尺寸规格与纸材要求见附表,长、宽、高尺寸偏差为±0.5mm。
2.6包装规格以每扎100个(小盒)或50个(中盒)为标准,每扎数量与标示数量相符,合格率不得低于99.0%。
2.7按包装材料取样规程,抽取包装材料在充足的光线下检查以上抽出样品的外观及印刷质量应符合以下要求。
小盒缺陷分类及可接受的限度中盒缺陷分类及可接受的限度3.说明书的质量标准。
3.1说明书应干净、整洁、无污染、无破损。
3.2说明书的文字、商标、图案、结构式、分子式印刷清晰无误。
(文字、商标、图案的具体要求以质管部鉴定的样板为标准)3.3说明书的文字与标签、小盒等包装材料的文字说明应一致。
3.4每批说明书颜色深浅一致,且与样板色差无较大的差别。
目的:制订盐酸雷尼替丁胶囊质量标准及内控标准。
适用范围:盐酸雷尼替丁胶囊质量标准及内控标准。
责任:检验室、生产车间及成品仓执行该标准,质管部负责监督该标准的执行。
标准:1.标准依据:《中华人民共和国药典》2000版二部2.批准文号:*卫药准字(1996)第507030号3.处方:3.1来源:本厂3.2依据:《中华人民共和国药典》2000版二部。
3.3处方:盐酸雷尼替丁150g 滑石粉51g磷酸氢钙57g 75%乙醇21g二氧化硅 2.775g共制成1000粒3.4剂型:硬胶囊剂3.5包装规格:0.15g 20粒×300瓶/箱30粒×200瓶/箱4法定质量标准及内控标准4.1法定质量标准4.2内控质量标准4.2.2内在质量标准及检验方法4.2.3卫生学标准及测定方法5包装品的质量标准。
5.1固体药用聚烯烃塑料瓶:YY0057-91《固体药用聚烯烃塑料瓶》质量标准。
5.2药用填充纸:YY0236与GB9687-84《药用填充纸》质量标准。
5.3标签:厂内控标签质量标准。
5.4空心胶囊:GB13731-92《药用明胶硬胶囊》质量标准。
6.5小盒、中盒:厂内控小盒、中盒质量标准。
5.5纸箱:厂内控纸箱质量标准。
6取样规定6.1外观质量检查6.1.1车间质管员在线监控,厂部质管员在包装线抽样及在成品仓抽样检查。
6.1.2质检员在包装线抽样应至少抽检20瓶(小盒)及已包装好两件,在成品仓抽样应不少于三件。
6.2内在质量检查6.2.1内在质量由质管部实行在包装线抽样,定期在成品仓抽样检查。
6.2.2质检员在包装线抽样20瓶,成品仓抽样20瓶,如不合格,应重新抽样,数量加倍。
6.2.3质检员在取样过程中,应按照《取样操作规程》执行。
6.3卫生学检查6.3.1卫生学检查由质管部在包装线抽样检查,定期在成品仓抽样检查。
6.3.2质检员在包装线抽样2瓶,成品仓抽样2瓶,如不合格,应重新抽样,数量加倍、同时做2个样。
GMP认证全套⽂件资料03-⽚剂⼯艺验证⽚剂⽣产⼯艺验证⽂件⽬录1、验证的⽬的与计划1.1验证的⽬的1.2验证计划2、验证机构3、验证⽅案的起草与审批3.1验证⽅案的起草3.2验证⽅案的审核3.3验证⽅案的批准4、⽚剂⽣产⼯艺验证⽅案4.1处⽅⼯艺及⼯艺流程4.1.1处⽅⼯艺4.1.2⼯艺流程4.2批⽣产记录与标准操作规程4.2.1批⽣产记录4.2.2标准操作规程4.3与⼯艺相关的验证⽂件4.4⼯艺验证4.4.1原辅料处理4.4.1.1⽬的4.4.1.2中间控制标准4.4.1.3收集验证资料4.4.1.4⼩结4.4.2配料、制粒及⼲燥4.4.2.1⽬的4.4.2.2中间控制标准4.4.2.3收集验证资料4.4.2.4⼩结4.4.3整粒4.4.3.1⽬的4.4.3.2中间控制标准4.4.3.3收集验证资料4.4.3.4⼩结4.4.4总混4.4.4.1⽬的4.4.4.2中间控制标准4.4.4.3收集验证资料4.4.4.4⼩结4.4.5压⽚4.4.5.1⽬的4.4.5.2中间控制标准4.4.5.3收集验证资料4.4.5.4⼩结4.4.6包⾐4.4.6.1⽬的4.4.6.2中间控制标准4.4.6.3收集验证资料4.4.6.4⼩结4.4.7成品质量稳定性验证4.4.7.1⽬的4.4.7.2中间控制标准4.4.7.3收集验证资料4.4.7.4⼩结5、验证⽅案的实施与记录5.1处⽅⼯艺及⼯艺流程5.1.1处⽅⼯艺5.1.1.1处⽅5.1.1.2⼯艺5.1.1.3空⽩⽚包⾐5.2批⽣产记录与标准操作规程5.2.1批⽣产记录5.2.2标准操作规程5.3与⼯艺相关的验证⽂件5.4⼯艺验证5.4.1原辅料处理5.4.1.1验证资料5.4.1.2数据分析5.4.1.3⼩结5.4.2配料制粒及⼲燥5.4.2.1验证资料5.4.2.2数据分析5.4.2.3⼩结5.4.3整粒5.4.3.1验证资料5.4.3.2数据分析5.4.3.3⼩结5.4.4总混5.4.4.1验证资料5.4.4.2数据分析5.4.4.3⼩结5.4.5压⽚5.4.5.1验证资料5.4.5.2数据分析5.4.5.3⼩结5.4.6包⾐5.4.6.1验证资料5.4.6.2数据分析5.4.6.3⼩结5.4.7成品质量稳定性验证5.4.7.1验证资料5.4.7.2数据分析5.4.7.3⼩结6、验证结果的总结及批准6.1验证结果的总结6.2验证结果的审核6.3验证结果的批准7、变更后的再验证8、附表:包⾐验证试验数据9、附录1、验证的⽬的与计划1.1验证的⽬的根据98版《药品⽣产质量管理规范》(1998年修订)的要求,为了保证⽚剂在⽣产过程中质量稳定,各中间控制符合质量要求,保证⽣产⼯艺在⽣产过程中的顺利进⾏,应该对⽣产⼯艺进⾏验证。
目的:建立板蓝根颗粒检验操作规程。
范围:板蓝根颗粒。
责任人:质保部。
内容:
1.性状
本品应棕色或棕褐色的颗粒,味甜微苦。
2.鉴别
2.1取本品0.5g,加水5ml使溶解,静置,取上清液滴滤纸上,晾干,置紫外光灯(365nm)下观察,斑点应显蓝紫色。
2.2取本品0.5g,加水10ml使溶解,滤过,取滤液1ml ,加茚三酮试液0.5ml,置水浴中加热数分钟,溶液应显蓝紫色。
3.检查:
3.1粒度
取板兰根颗粒5包,分别置1号筛和5号,过筛,取不能通过1号筛和能通过5号筛的颗粒及粉末,称定重量,计算其所占比例(%),不得过6.0%。
3.2水分≤4.0%(见联合会3,颗粒剂检查法)
3.3溶化性
取颗粒剂10g,加热水200ml,搅拌5分钟,颗粒应全部溶化或轻微浑浊,但不能有异物。
3.4装量差异
取供试品10包,除去包装,分别精密称定每包内溶物的重量,求出每包内溶物的装量与平均装量,每包装量与平均装量比较在规定的装量差异限度内。
3.5微生物限度(见附录1,微生物限度检查法)。