第十八章 其它含氮化合物
- 格式:doc
- 大小:339.51 KB
- 文档页数:5




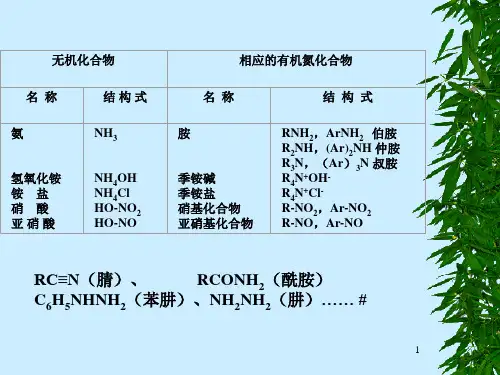
第十八章含氮化合物 (客观题 22 道,主观题 37 道) 一.客观题1. 命名下列化合物并指明分别属于伯胺、仲胺、叔胺、季铵或酰胺哪一类(1)CH 3CH 2CH 2NH 2 丙胺,伯胺 (2)CH 3CH 2CON(CH 3)2 N ,N -二甲基丙酰胺,酰胺 (3N ,N -二甲基苯胺、叔胺(4 α-呋喃甲醛 (5) 氯化三甲基乙基胺,季铵盐(6)2-丙胺,伯胺(7)(CH 3)4N +OH - 氢氧化四甲胺,季铵碱 (8)C 2H 5NHCH 3 甲乙胺,仲胺2. 写出下列化合物的构造式(9)甲基异丙基胺 (10)二苯胺(11) N-甲基丙酰胺 CH 3CH 2CONHCH 3(12)叔丁胺(CH 3)3CNH 2 (13)氯化三甲基苯基胺(14)3-溴吡啶(15)α-氨基丁酸(16)对羟基偶氮苯(17)四氢呋喃(18)甲基磺酰氯 CH 3-SO 2Cl(19)乙基亚磺酸 CH 3CH 2SO 2H(20)氯胺(21)写出分子式为C 8H 11N 的芳胺的所有同分异构体并命名H 3)2H OC H 3C H 2-N +-C H 3C l-C H 3C H 3CH 3C HCH 3NH 2C H 3N H C H C H 3C H 3CH 3CH 3N +CH 3Cl -NB rC H 3C H 2C H C O O HN H 2=H O2-al H C H 2C H 3N C H 3C H33H C H 3C H H C H 3N-乙基苯胺 N,N-二甲基苯胺 N-甲基邻甲苯胺 N-甲基间甲苯胺N-甲基对甲苯胺 邻乙苯胺 间乙苯胺 对乙苯胺2,6-二甲基苯胺 2,5-二甲基苯胺 2,4-二甲基苯胺 2,3-二甲基苯胺3,5-二甲基苯胺 3,4-二甲基苯胺(22)4.将下列化合物按碱性递增次序排列,并说明理由NH 3CH 3CH 2NH 2 CH 3CH 2CONH 2 CH 3NHCH 3解:CH 3CH 2CONH 2<C 6H 5NH 2< NH3<CH 3CH 2NH 2<CH 3NHCH 3用化学方法区别下列各组化合物 (23)二乙胺、苯胺和苄胺C 2H 5NHC 2H 5 × N 2↑C 6H 5NH 2 白色沉淀 C 6H 5CH 2NH 2 × 黄色油状液体(24)对甲基苯胺、N -甲基苯胺和N ,N -二甲基苯胺 N 2↑黄色油状液体绿色H 22C H 3H 2C H 2C H 2C H 3C H H C H 3H 3H 3H 3H 3H 3H 33H 3H 3H 3H 3H 33−−→−溴水−−−→−亚硝酸H 3H 2H -C H 3H 3H 32试以苯及其他试剂为原料,合成下列化合物 (25)对溴苯胺(26)对氨基苯甲酸(27)4-羟基-4’-硝基偶氮苯(28)间硝基乙酰苯胺混酸55~60℃2ΔN O 2N H 23N H C O C H3H O A cO C H 32H+混酸55~60℃Fe, H C l, H 2OΔ3O C H 3AlC l 3O C H 33HO C H 3H2H混酸55~60℃2Δ3O C H 3混酸55~60℃O C H 322H220~5℃l-2+弱酸, 0℃, H 2OH =O 2+H N O 32455℃95℃O 2ΔO 23O A lC l 3O 2H 3O写出对甲基盐酸重氮苯与下列试剂作用后生成的产物 (29)H 3PO 2(30)KI(31)HBr/Cu 2Br 2 (32)HBF 4,然后加热 (33)HCl/Cu 2Cl 2(34)C 6H 5OH (弱碱性溶液)(35)对甲基苯酚(36)N ,N -二甲基苯胺写出乙酐与下列胺反应生成的产物 解:(37)CH 3CH 2CH 2CH 2NH 2 (38)C 6H 5N(CH 3)2 (39)二,主观题(1) 某化合物A 分子式为C 6H 15N ,能溶于稀盐酸,在室温下与亚硝酸作用放出氮气并得到化合物B 。





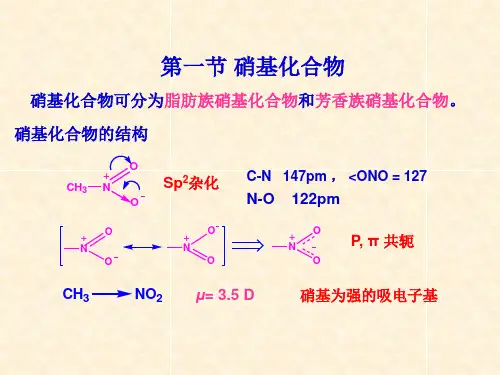
第十八章芳香族含氮化合物§1 硝基化合物概念: 含有—NO 的化合物,即烃分子中的H 被—NO 取代。
2 2命名:与卤代烃相像烷作母体,—NO 作取代基2§1 硝基化合物的制法—烃的硝化HNO +C-H SO NO3 24 2亲电取代反响H C CH 33HNO3HACCH3CH3NO2CH3CH3§2 物理性质强极性化合物芳香族化合物都有爆炸性芳香族化合物都有毒芳香族化合物蒸气压较大生产上不作溶剂§3 化学性质——NO2的构造ON4 3 ONO 2HN:1S 22S 22P 3NO 2: Rp 4OOO -N:SP 2ÓÔ ¯¸ RNRN +OO –R+NON=O, N-O 等长:1.21A 高度离域二 复原反响:最终产物为×î ÖÕ²úÎ ïÎ ªNH 2 ·¼°·NH 2选用不同的复原剂,掌握不同的条件,可得不同氧化态的不同产物。
Fe+HCLNH 2Fe+NaOHN=NNO2Zn+NaOH-NH-NH-Zn+NH Cl NHOHZn+H 2ONO制芳胺:复原剂 Sn(Fe)+HCl H 2/cat. 及多硫化物2NH 2NO 22 Fe,140°¢² ÌÑHNO 3 C-H 2SO 4¢²ÑÌ H 2SO 43NO 2 NO2(NH ) S 4 2NO 2NH 2Fe+HClNO 2NOSnCl 2C-HCLCHONO 2OHNO 2OHNa 2S NH½ú ±Ì £·NO 2C 2H 5OH, DNO 2NO 2 2NHOH三 苯环上取代反响:—NO 强拉电子基所以不能进展F-K 反响2BrBrNO 2NO 2110°SO H§2 芳胺芳胺:NH 分子中的H 被芳基取代成为芳胺3命名:和脂肪胺相像。
第18章非金属元素小结18-1 略18-2为什么氟和其他卤素不同,没有多种可变的正氧化态?解:因为F是电负性最大的元素,在形成化合物时,电子云总是偏向F,而且F处于第二周期,没有空d轨道参与成键,所以,和其他卤素不同,没有多种可变的正氧化态。
18-3 小结p区元素的原子半径、电离能、电子亲和能和电负性,在按周期性递变规律的同时,还有哪些反常之处?说明其原因。
解:p区元素的原子半径、电离能、电子亲和能和电负性,对同一周期,一般是自左向右原子半径依次减小,电离能依次增大,电子亲和能依次增大,电负性依次增大。
对于同一族,一般是从上到下原子半径依次增大,电离能依次减小,电子亲和能依次减小,电负性依次减小。
但第V A族的N、P、As等的第一电离能和电子亲和能出现反常,第一电离能比同周期VIA族的O、S、Se大,电子亲和能比同周期IV A族的C、Si、Ge小,这是由于V A族元素的外层p轨道处于半充满,结构稳定,不易失去电子,也不易接受电子。
另外,F的电子亲和能要小于Cl,O的电子亲和能小于S,N的电子亲和能小于P等,这是由于第二周期p区元素的原子半径太小,电子云密度大,电子之间排斥力很强,以致当加合一个外来电子形成负离子时,因排斥力大使放出的能量减小,导致上述反常结果。
18-4 概括非金属元素的氢化物有哪些共性?解:非金属元素的氢化物都是以共价键结合的分子型氢化物,在通常状况下为气体或挥发性液体,都能与氧、卤素、氧化态高的金属离子以及一些含氧酸盐等氧化剂作用。
18-5 已知下列数据(298K):△f G mӨ[H2S(aq)]= -27.9 kJ·mol-1;△f G mӨ[S2-(aq)]= 85.8 kJ·mol-1;△f G mӨ[H2Se(aq)] = 22.2 kJ·mol-1;△f G mӨ[Se2-(aq)] = 129.3 kJ·mol-1试计算下列反应在298K时的△r G mӨ和平衡常数K,并比较两者中哪一个酸性较强?(1) H2S(aq) -→ 2H+(aq) + S2-(aq)(2) H2Se(aq) -→2H+(aq) + Se2-(aq)解:(1) H2S(aq) -→ 2H+(aq) + S2-(aq)298K △r G1Ө= △f G mӨ[S2-(aq)]-△f G mӨ[H2S(aq)]= 85.8-(-27.9) = 113.7kJ·mol-1由△r G1Ө = - RTlnK1Ө求得:K1Ө = 1.17×10-20(2) H2Se(aq) -→2H+(aq) + Se2-(aq)298K △r G2Ө= △f G mӨ[Se2-(aq)]-△f G mӨ[H2Se(aq)]= 129.3-22.2) = 107.1kJ·mol-1由△r G2Ө = - RTlnK2Ө求得:K2Ө = 1.68×10-19通过(1)、(2)的计算结果可知:H2Se的酸性比H2S的酸性强。