(完整版)第八章稳定性研究.
- 格式:ppt
- 大小:118.73 KB
- 文档页数:12

稳定性研究一.简介多年来,系统的稳定性是每一个电力公司工程师都需考虑的问题。
小型独立电力生产商(IPPS)中和热电联产(合创)公司被视为负载的一部分,随便模仿。
今天,对公用事业行业的结构正在经历一个放松管制下的革命性的变化过程。
发电市场中的全面竞争是在地平线上。
越来越多的工业和商业设施已安装本地发电机,大型同步电动机,或两者兼而有之。
在IPP的/联合根公司和现场发电系统等植物在维护稳定中的作用是对电力系统研究的兴趣的新领域。
当热电联产厂连接到传输网,它改变了系统配置,以及电力流动格局。
这可能会导致在工厂和供应程序上的稳定性问题。
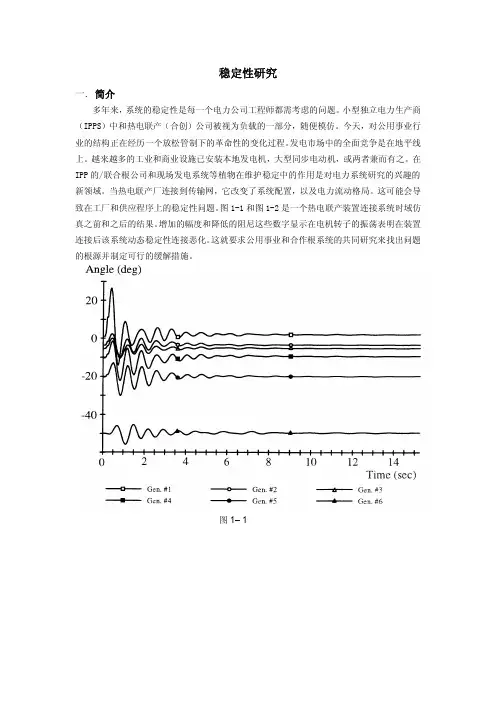
图1-1和图1-2是一个热电联产装置连接系统时域仿真之前和之后的结果。
增加的幅度和降低的阻尼这些数字显示在电机转子的振荡表明在装置连接后该系统动态稳定性连接恶化。
这就要求公用事业和合作根系统的共同研究来找出问题的根源并制定可行的缓解措施。
图1–1图1–2二.造成不稳定的问题电力系统的异步操作最直接的危害通常发生是机械的扭矩和高暂态电流。
为了防止造成机械和热损伤这些瞬变,同步电动机及发电机几乎普遍配备了及时退撤出的保护。
对于小到中等规模的电机,这种保护通常由阻尼器的保护继电器撤出在异步操作过程中的低功率因素。
同样的功能通常为大型电动机,发电机和同步冷凝器丢失中继。
在任何情况下,拉出电机断路器或接触器的继电器行程。
无论负载是由电机送达自然中断。
因此,对于一个系统,往往主要是不稳定决定系统频繁进程中断的概率。
不按步骤的操作将导致在连接的不按步骤电机的电路中有功和无功功率大的振荡流量。
阻抗或继电器,以保护这些线路、可以解释为一条线路的电源浪涌,线路断路器跳闸和系统遭到破坏。
虽然这主要是一种实用工具的问题,大型工业系统或那些本地产生的相似操作可以容易受到影响。
在上述任何情况下,工业系统可脱离实用系统。
如果工业系统中没有足够的现场发电,适当减载程序对防止电力损失是很必要的。
一旦从综合的力量分开,工业系统成为一个相当弱连接的整体,可能会遇到更多的稳定性问题。


稳定性研究标准操作规程稳定性研究实验方法,根据稳定性研究指导原则进行,具体操作如下:一、影响因素试验影响因素试验一般包括高温、高湿、强光照射试验。
将原料置适宜的容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层进行试验。
对于固体制剂产品,采用除去内包装的最小制剂单位,分散为单层置适宜的条件下进行。
如试验结果不明确,应加试2个批号的样品。
1.高温试验供试品置密封洁净容器中,在60℃条件下放置10天,于0、5、10天取样检测。
与0天比较,若供试品发生显著变化,则在40℃下同法进行试验。
如60℃无显著变化,则不必进行40℃试验。
2.高湿试验供试品置恒湿设备中,于25℃、RH92.5%±5%条件下放置10天,在0、5、10天取样检测。
检测项目应包括吸湿增重等。
若吸湿增重在5%以上,则应在25℃、RH75%±5%下同法进行试验;若吸湿增重在5%以下,且其他考察项目符合要求,则不再进行此项试验。
恒湿条件可以通过恒温恒湿箱或在密闭容器中放置饱和盐溶液来实现。
根据不同的湿度要求,选择NaCl饱和溶液(15.5-60℃,RH75%±1%)或KNO3饱和溶液(25℃,RH92.5%)。
注意:对水性的液体制剂,可不进行此项试验。
3.强光照射试验供试品置装有日光灯的光照箱或其它适宜的光照容器内,于照度为4500lx±500lx条件下放置10天,在0、5、10天取样检测。
试验中应注意控制温度,与室温保持一致,并注意观察供试品的外观变化。
此外,根据药物的性质必要时应设计其他试验,探讨pH值、氧及其他条件(如冷冻等)对药物稳定性的影响。
二、加速试验加速试验一般应在40℃±2℃、RH75%±5%条件下进行试验,在试验期间第0、1、2、3、6个月末取样检测。
若供试品经检测不符合质量标准要求或发生显著变化,则应在中间条件下,即在30℃±2℃、RH65%±5%条件下(可用Na2CrO4饱和溶液,30℃,RH64.8%)进行试验。

稳定性研究1.实时/ 效期稳定性诊断试剂的实时稳定性对于确定产品的有效期具有重要意义[4]。
实时稳定性研究应将至少三个批次的产品,按照制造商声称的条件,例如温度、湿度等,考察至预期的有效期后,按照产品技术要求进行全性能检测。
在考察过程中,应结合产品情况,合理设置考察时间点,对环境影响敏感、保存要求较高的产品,建议增加相应的时间点,以及时了解产品性能。
实时稳定性研究资料应包括研究方法的确定依据、研究所用试剂、仪器以及校准品和质控品的信息、具体的研究方法及评价指标、详细的研究数据以及结论。
2.加速稳定性对于体外诊断试剂而言,加速稳定性通常指在非试剂说明书中声称的储存条件下的稳定性考察。
加速稳定性旨在考察试剂在特定的极端环境中,试剂的技术指标是否还在可接受的合理区间,以评估试剂的性能。
通常情况下,考虑到大多数试剂中主要组成成分为蛋白类物质,在试剂实际储存温度的基础上,升高温度来考察加速稳定性是最常用的方式,即我们通常所讲的热稳定性。
需要注意的是,尽管加速稳定性试验是考察诊断试剂性能的一种常见方法,但是CFDA 仍然期望产品的稳定性结论是基于产品的实时稳定性研究数据。
在CFDA 发布的众多体外诊断试剂行业标准中,通常提供了效期稳定性和热稳定性两种方式进行验证,但是均注明了热稳定性不能用于推导产品有效期,除非是采用基于大量的稳定性研究数据建立的推导公式。
虽然加速稳定性研究结论不能直接用于声称产品有效期,但是考虑到试剂在运输和使用过程中可能遇到的不确定性,产品加速稳定性研究仍具有重要意义。
3.开瓶/ 封稳定性开瓶/ 封稳定性旨在考察试剂在正常使用条件下,外界因素对试剂性能指标的影响。
对于很多生化类试剂而言,受空气影响较明显,比如含有NaOH 的生化类试剂,吸收了空气中的CO2,导致试剂中NaOH 的浓度下降,直接影响试剂分析质量;还原型辅酶I(NADH)、邻- 硝基酚-β-D-半乳糖苷(ONPG)以及其他部分发光底物等一些稳定性较差的物质,也会因暴露于空气中而影响测定效果[5]。


研究报告:稳定性的探究标题:研究报告:稳定性的探究摘要:本研究报告旨在探究稳定性的概念、重要性以及影响因素。
通过对稳定性的深入分析,我们可以更好地理解稳定性对个人和组织的作用,以及如何提高稳定性以实现更好的结果。
本报告将按照从基础概念到实际应用的方式,为读者提供全面的知识和深入的理解。
第一部分:引言在引言部分,我们将简要介绍稳定性的背景和重要性,并明确本研究报告的目的和结构。
第二部分:概念和定义在这一部分,我们将对稳定性的概念进行深入探究,讨论不同领域中的定义和解释。
我们将包括心理学、经济学和社会学等相关领域对稳定性的观点,并对稳定性的内涵进行全面理解。
第三部分:稳定性的重要性这一部分将强调稳定性在个人和组织层面的重要性。
我们将探讨稳定性对于个人情感健康以及组织发展和成功的影响。
通过理解稳定性的重要性,我们能够将其纳入我们的个人和组织发展目标之中。
第四部分:影响稳定性的因素稳定性受多种因素的影响,包括个体特征、环境条件和外部事件等。
本节将细致分析这些影响因素,并解释它们对稳定性的具体作用。
我们将讨论个体特征如个性和情绪管理技巧,环境条件如社会支持和工作环境,以及外部事件如变革和危机对稳定性的影响。
第五部分:提高稳定性的策略本部分将提供一些实际应用的策略,以帮助个人和组织提高稳定性。
我们将探讨心理和行为层面的策略,如积极心态培养、压力管理和目标设定。
此外,我们还将介绍组织层面的策略,包括领导力支持和团队建设。
第六部分:总结与回顾在最后一节中,我们将对本研究报告的主要内容进行总结和回顾,强调稳定性的重要性以及提高稳定性的策略。
我们还将对进一步研究和应用稳定性的可能性进行展望,并总结研究报告整体观点。
个人观点与理解:稳定性在个人和组织的发展过程中起着重要作用。
在个人方面,稳定性有助于情绪管理、提高自我效能和适应变化。
在组织方面,稳定性有助于建立良好的工作氛围、增强员工士气和促进创新发展。
通过认识和提高稳定性,我们可以更好地应对挑战、实现个人和组织的全面发展。

附件2化学药物(原料药和制剂)稳定性研究技术指导原则(修订)一、概述原料药或制剂的稳定性是指其保持物理、化学、生物学和微生物学特性的能力。
稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。
稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。
本指导原则为原料药和制剂稳定性研究的一般性原则,其主要适用于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application)。
其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更申请(Variation Application)等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进行。
本指导原则是基于目前认知的考虑,其他方法如经证明合理也可采用。
二、稳定性研究的基本思路(一)稳定性研究的内容及试验设计稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计一系列的试验来揭示原料药和制剂的稳定性特征。
稳定性试验通常包括影响因素试验、加速试验和长期试验等。
影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进一步验证所用分析方法的专属性、确定加速试验的放置条件及选择合适的包装材料提供参考。
加速试验是考察原料药或制剂在高于长期贮藏温度和湿度条件下的稳定性,为处方工艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放置条件。


标准操作规程页码:1/51目的规范xxx公司质量控制部稳定性试验程序,考察药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
2范围适用于xxx公司质量控制部稳定性试验。
3职责质量保证部:负责产品稳定性试验指令的下达。
质量控制室:负责起草稳定性试验方案并按预定方案进行稳定性试验。
4定义无5安全注意事项无6程序6.1稳定性试验的基本要求6.1.1稳定性试验包括加速试验与长期试验。
6.1.2供试品的质量标准应于大生产所使用的供试品质量标准一致。
6.1.3加速试验与长期试验所用供试品的包装应与上市产品一致。
6.1.4研究药物稳定性,要采用专属性强、准确、精密、灵敏并经过验证的分析方法以保证药物稳定性试验结果的可靠性。
6.1.5在稳定性试验中,应重视降解产物的检查。
6.2稳定性试验的批次凡符合下列任意一项者,每批产品均要进行稳定性试验。
6.2.1工艺验证批。
编号版本号替代号执行日期A01 A006.2.2处方或包装材料有较大改变的前三批产品。
6.2.3改变活性成分供应商后所生产的前三批产品。
6.2.4每年各品种生产的第一批。
6.3稳定性试验样品的包装稳定性试验样品必须按该产品市售包装标准进行包装。
6.4稳定性试验的类型及储存条件6.4.1稳定性样品的储存条件与商品储存条件尽可能一致,并加以监控和记录。
稳定性条件应与药品标签上的储存条件一致。
6.4.2常温储存的产品(10~30℃),其稳定性试验条件如下(如有特殊规定,则按其规定执行):6.4.2.1长期稳定性25℃±2℃/60%RH±5%RH或30℃±2℃/65%RH±5%RH(Zone Ⅳ)6.4.2.2中间稳定性30℃±2℃/65%RH±5%RH6.4.2.3加速稳定性40℃±2℃/75%RH±5%RH6.4.3冷藏的产品(2℃~8℃),其稳定性试验条件如下(如有特殊规定,则按其规定执行):6.4.3.1长期稳定性5℃±3℃6.4.3.2加速稳定性25℃±2℃/60%RH±5%RH6.4.4冷冻储存的产品(-25℃~-10℃),其稳定性试验条件如下(如有特殊规定,则按其规定执行):6.4.4.1长期稳定性-20℃±5℃6.4.4.2加速稳定性5℃±3℃6.4.5如果在25℃±2℃/60%RH±5%RH条件下进行长期试验,而在加速放置条件下的6个月期间的任何时间点发生“显著性变化”,则增加中间放置条件下的试验,并对照显著性变化的标准进行评价。
稳定性研究资料 Revised by BLUE on the afternoon of December 12,2020.***检测试剂盒(胶体金法)稳定性研究资料模板1.研究方法确定依据本试剂盒拟定有效期为24个月,储存条件为4 ℃-30 ℃干燥阴凉处。
根据《生物制品稳定性研究技术指导原则》的要求进行稳定性研究。
稳定性研究试验设计为:实时稳定性——三个批次样品在规定储存条件下保存至有效期后3个月的研究;加速稳定性——一个批次样品在4℃、37℃和45℃条件下6个月的稳定性研究;运输稳定性——一个批次样品模拟运输过程中的稳定性研究。
研究中采用的三批样品批号为:01、01、01。
2.器材与质控品器材:实验过程中用到的设备或器材包括:游标卡尺、秒表、EP管、细胞培养箱、恒温摇床、一次性手套、口罩、专用工作服、消毒用品和办公用品。
质控品:针对不同的性能指标,试验过程中采用不同的质控品,包括最低检出量质控品、阳性质控品、阴性质控品和精密性质控品,具体的制备方法参考本公司《***产品标准》附录A。
3.方法与步骤3.1.实时稳定性研究1)选择一定数量三个批次检测试剂盒保存在4℃~30℃干燥阴凉环境中。
2)自生产日期起,,到有效期结束后6个月,共30个月,第一个月,每天检测一次;第2至12个月,每个月检测一次,第13-24个月,每半年检测一次;第25-30个月,每3个月检测一次。
3)测试过程中,根据产品标准,主要观察以下性能指标:物理性能、最低检出量、阳性符合率与阴性符合率、(批内差)。
4)记录试验结果和日期、完成实验报告。
3.2.加速稳定性研究1)取正常保存条件下的有效期内的同批试剂盒,分成三部分分别放置在4℃、37℃、45℃条件下24周(约6个月),第一周每天检测一次,第2-4周每周检测一次,第5-12周每4周检测一次,第13-24周,每周检测一次。
2)测试过程中,根据产品标准,主要观察以下性能指标:物理性能、最低检出量、阳性符合率与阴性符合率、精密度(批内差)。