(完整版)电化学曲线极化曲线阻抗谱分析
- 格式:doc
- 大小:546.01 KB
- 文档页数:3


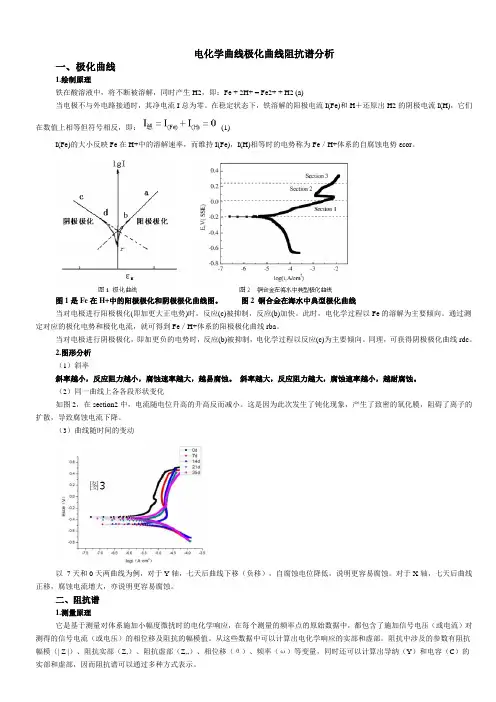
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。

电化学阻抗谱原理应用及谱图分析电化学阻抗谱原理应用及谱图分析电化学阻抗谱(Electrochemical Impedance Spectroscopy,EIS)是一种测量电化学系统的电化学行为的方法,它通过测量系统对于正弦电压或电流的响应,来研究电化学反应过程中的阻抗变化。
EIS广泛应用于材料科学、化学工程、电池研究、腐蚀研究和生物医学等领域。
EIS的原理是利用正弦电压或电流去激励待测电化学系统,并测量响应信号的振幅和相位,然后将这些数据在频率域或时间域中进行分析,从而得到电化学系统的等效电路模型,如电阻、电容、电感等等,这些参数可以反映出系统的结构、特性和电化学反应的动力学信息。
EIS的主要作用是在电化学反应的过程中研究电荷传递、离子传输、质量传递等复杂的反应机理,可以通过建立电化学反应动力学模型,分析电极表面化学反应动力学参数,优化电极材料和电解液配方,提高电化学反应效率。
以下是两个例子,说明EIS的应用及注意事项:锂离子电池的研究:EIS广泛应用于电池的研究和开发中,通过测量电池的电化学阻抗谱来评估电池的性能和寿命。
例如,在锂离子电池中,电解质的性质和电极材料的表面形貌对电池性能有很大影响。
利用EIS可以评估电池的内部电阻、扩散系数等参数,进而优化电池设计和材料配方。
注意事项是,需要确保电池在测量时处于稳态,并控制好测量温度和电压等参数。
金属腐蚀的研究:EIS也被广泛应用于金属腐蚀的研究中,通过测量金属表面的电化学阻抗谱,可以评估金属表面的保护膜的质量和稳定性,了解金属腐蚀的机制,同时也可以评估防腐涂层的性能。
注意事项是,需要确保测量条件稳定,避免干扰,同时应选择合适的电解液和电极材料。
电化学阻抗谱(EIS)的谱图是通过测量电化学系统对于正弦电压或电流的响应所得到的。
谱图提供了电化学系统的等效电路模型,这些参数可以反映出系统的结构、特性和电化学反应的动力学信息。
在谱图的分析过程中,需要注意以下几点:峰的位置和形状:电化学阻抗谱中的峰代表电化学体系中不同的特征和反应机理。

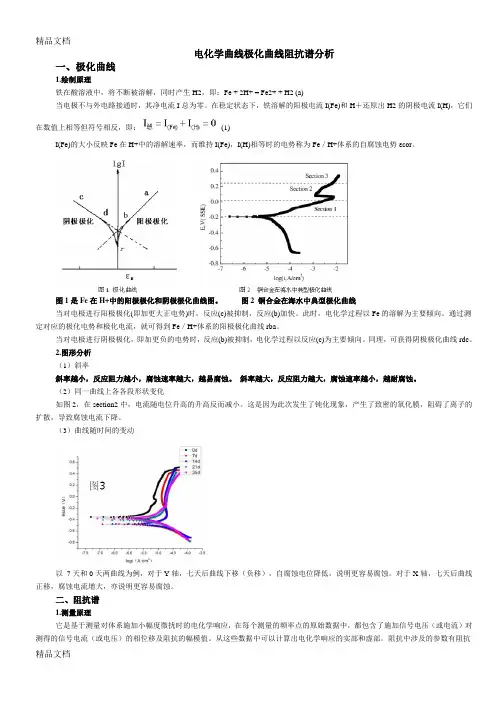
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。

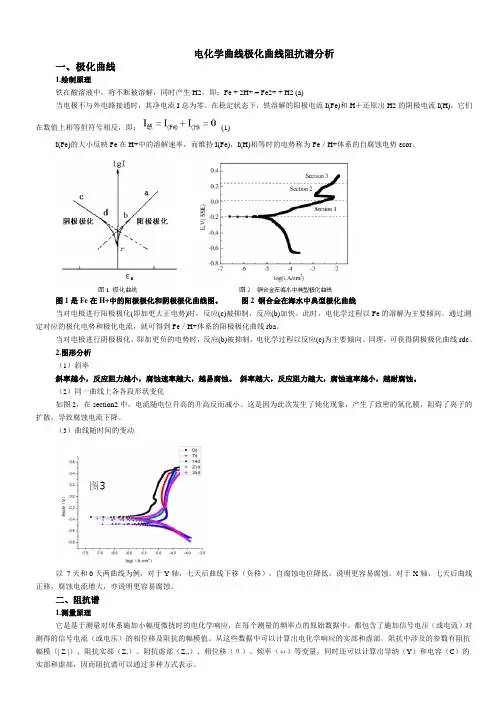
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。

化学检验工常见电化学涂层性能测试方法电化学涂层是一种常见的表面处理方法,可用于增加材料的耐腐蚀性能、改善导电性能等。
为了确保电化学涂层的质量,需要进行一系列的性能测试。
本文将介绍几种常见的电化学涂层性能测试方法。
1. 腐蚀性能测试电化学腐蚀测试是评估电化学涂层耐腐蚀性能的重要方法之一。
常用的测试方法包括极化曲线法和电化学阻抗谱法。
(1)极化曲线法极化曲线法是一种通过测量极化曲线来评估电化学涂层在腐蚀环境中的抗腐蚀性能的方法。
通过应用一定电位范围内的电流,可以观察到电流随电位的变化关系,从而评估涂层的耐腐蚀性能。
(2)电化学阻抗谱法电化学阻抗谱法是一种通过测量电化学阻抗谱曲线来评估电化学涂层耐腐蚀性能的方法。
该方法可以得到频率范围内的电阻和电容数值,通过分析这些数据可以评估涂层的耐腐蚀性能。
2. 导电性能测试导电性能是衡量电化学涂层质量的关键指标之一。
常用的测试方法有四探针法和电阻率测量法。
(1)四探针法四探针法是一种通过测量电阻来评估电化学涂层导电性能的方法。
在该方法中,四个探针被插入涂层中,通过测量电流和电阻的关系,可以计算涂层的电导率和电阻率。
(2)电阻率测量法电阻率测量法是一种通过测量涂层材料的电阻来评估导电性能的方法。
该方法使用导电传感器在涂层表面上测量电阻,通过计算电阻率可以评估涂层的导电性能。
3. 附着力测试附着力是评估电化学涂层质量的重要指标之一。
常用的测试方法包括划伤测试、拉伸测试和冲击测试。
(1)划伤测试划伤测试是一种通过使用硬度指针在涂层表面划伤,从而评估涂层与基材之间的附着力的方法。
通过观察划痕形状和痕迹深度,可以评估涂层的附着力。
(2)拉伸测试拉伸测试是一种通过施加拉伸力来评估涂层与基材之间的附着力的方法。
通过在涂层上施加力并测量力的变化,可以计算涂层与基材的附着力。
(3)冲击测试冲击测试是一种通过施加冲击力来评估涂层与基材之间的附着力的方法。
常用的冲击测试方法包括钢球落锤测试和冲击炮测试,通过观察涂层破损情况可以评估附着力。
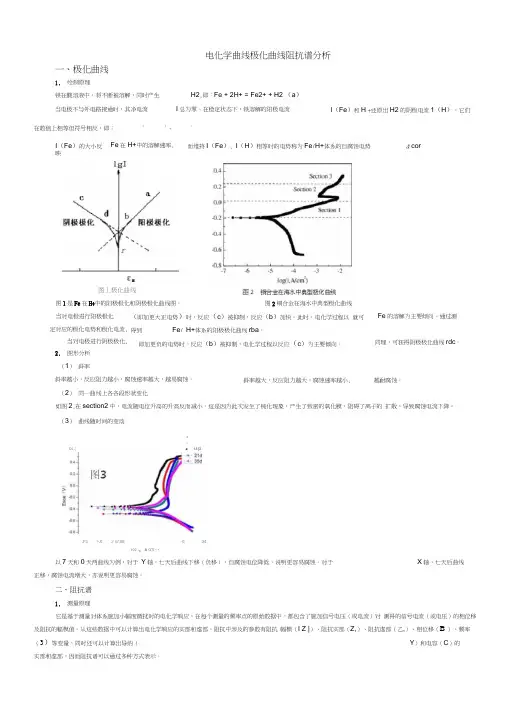
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流在数值上相等但符号相反,即: 1 1 - 12.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(I Z |)、阻抗实部(Z,)、阻抗虚部(乙,)、相位移(B )、频率(3)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
I(Fe)的大小反映而维持I(Fe), I(H)相等时的电势称为Fe/H+体系的自腐蚀电势& corFe在H+中的溶解速率,图丄极化曲线图1是Fe在H+中的阳极极化和阴极极化曲线图。
当对电极进行阳极极化定对应的极化电势和极化电流,当对电极进行阴极极化,图2铜合金在海水中典型极化曲线(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以就可得到Fe/ H+体系的阳极极化曲线rba。
即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
Fe的溶解为主要倾向。
通过测同理,可获得阴极极化曲线rdc。
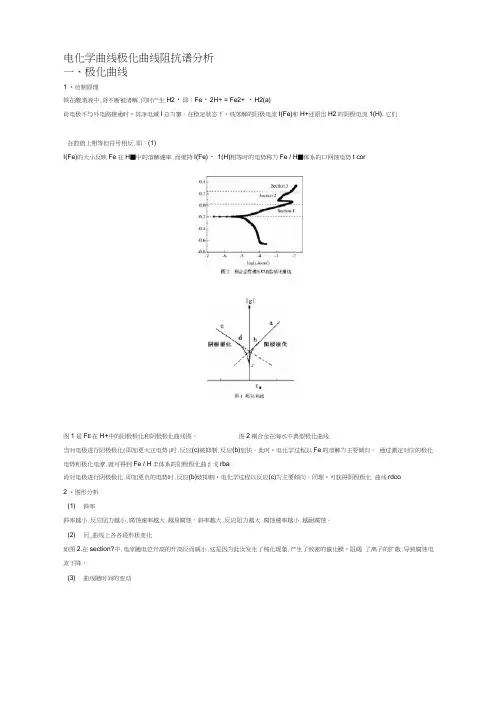
电化学曲线极化曲线阻抗谱分析一、极化曲线1 •绘制原理铁在酸渚液中.将不断被渚解.同时产生H2・即:Fe・2H+ = Fe2+ ・H2(a)肖电极不与外电路接通时•其净电滅I总为寥。
在稳定状态下•铁落解的阳极电流I(Fe)和H+还原岀H2的阴极电流1(H). 它们在数值上相等但符号相反.即:(1)I(Fe)的大小反映Fe在H■屮的溶解速率.而维持I(Fe)・ 1(H)相等时的电势称为Fe / H■体系的口网蚀电势t cor图1是F E在H+中的阳极极化和阴极极化曲线图。
图2铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时.反应(c)被抑制.反应(b)加快。
此时•电化学过程以Fe的溶解为主耍倾向。
通过测定对应的极化电势和极化电潦.就可得到Fe / H丰体系的阳极极化曲纟戈rba肖对电极进行阴极极化.即加更负的电势时.反应(b)妓抑制•电化学过程以反应(c)为主要倾向。
同理•可获得阴极极化曲线rdco2 •图形分析(1) 斜率斜率越小.反应阻力越小.腐蚀速率越大.越易腐蚀,斜率越大.反应阻力越大.腐蚀速率越小.越耐腐蚀。
(2) 冋_曲线上各各段形状变化如图2.在section?中.电涼随电位升高的升高反而戚小.这是因为此汝发生了钝化现象.产生了致密的嶽化膜•阻碣了离子的扩散.导致腐蚀电流下降,(3) 曲线随时间的变动以7天和0天两曲线为例.对于丫轴・七天启曲线下移(员移).自腐蚀电位降低.说明更容易腐蚀。
对于X轴.七天后曲线正移.腐蚀电涼增大.亦说明更容易腐蚀,二、阻抗谱1.S1S原理它堤基干测虽对体系施加小俯度微扰时的电化学响应.在每个测址的频率点的原始数据屮.都包含J'施加信号电压(或电流)对测得的信号电流(或电圧〉的相位移及阻抗的幅模值。
从这些数州中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数冇阻抗4/I幅模(|Z|X阻抗实部(Z,〉、阻抗虚部(Z,,〉、相位移(0人频率〈3〉等变瓯问时还可以计算出导纳(Y)和电容(C)的实部和虚部•因而阻抗谱可以通过多种方式表示。
电化学阻抗谱的应用及其解析方法董泽华 华中科技大学交流阻抗发式电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的重要手段。
特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高,超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱发、发展、终止以及活性物质的吸脱附过程。
1. 阻抗谱中的基本元件交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R ,纯电容C ,阻抗值为1/j ωC ,纯电感L ,其阻抗值为j ωL 。
实际测量中,将某一频率为ω的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引起的阻力均视为电阻,则等效电路如图1所示。
Element Freedom Value Error Error %Rs Free(+)2000N/A N/ACab Free(+)1E-7N/A N/A Cd Fixed(X)0N/A N/A Zf Fixed(X)0N/A N/ARt Fixed(X)0N/A N/ACd'Fixed(X)0N/A N/AZf'Fixed(X)0N/A N/ARb Free(+)10000N/A N/A Data File:Circuit Model File:C:\Sai_Demo\ZModels\12861 Dummy Cell.mdlMode:Type of Weighting:Data-Modulus图1.用大面积惰性电极为辅助电极时电解池的等效电路图中AB 分别表示电解池的研究电极和辅助电极两端,Ra,Rb 分别表示电极材料本身的电阻,Cab 表示研究电极与辅助电极之间的电容,Cd 与Cd ’表示研究电极和辅助电极的双电层电容,Zf 与Zf ’表示研究电极与辅助电极的交流阻抗。
电化学阻抗谱分析电化学阻抗谱分析是一种重要的电化学测量技术,广泛应用于材料、化学、能源和生物领域等各个科学研究和工程应用中。
在电化学阻抗谱分析中,通过在待测系统中施加交流电信号,测量系统的电流响应和电压变化,可以得到材料或电化学系统的阻抗谱。
这些阻抗谱信息可以提供有关材料的电子传输和离子传输特性、表面反应动力学、电化学界面特性以及电化学系统的动力学行为等重要信息。
电化学阻抗谱分析的基本原理是基于交流电信号在电化学系统中引起的电流响应和电压变化。
当外加电势为交流电势时,系统中的电容、电感、电解质电导等物理和化学过程对交流电信号产生响应。
根据电阻、电容和电感等元件的特性,可以得到复数形式的阻抗谱。
阻抗谱通常以Nyquist图和Bode图的形式表示,这些图形能够直观地反映材料或系统的特性。
在电化学阻抗谱分析中,常用的测量方法包括交流电压法和交流电流法。
交流电压法是将待测系统置于一个交流电压信号下,测量系统的电流响应,并通过波形分析等方法获得阻抗谱信息。
交流电流法是将待测系统置于一个交流电流信号下,测量系统的电压响应,并通过波形分析等方法获得阻抗谱信息。
这两种方法都可以适用于不同类型的电化学系统和材料的阻抗谱分析。
电化学阻抗谱分析在材料科学中具有广泛的应用。
例如,对于金属、合金和导电聚合物等材料,电化学阻抗谱可以用于研究它们的电子传输性能、电极/电解液界面特性以及电化学腐蚀行为等。
对于离子传输材料,如离子液体和电解质溶液等,电化学阻抗谱可以提供有关离子传输速率和电荷传输性能的信息。
此外,电化学阻抗谱还可以用于燃料电池、锂离子电池等能源系统、生物传感器、化学传感器等领域。
电化学阻抗谱分析的应用还包括电化学界面研究和电化学反应动力学研究。
例如,在电化学界面研究中,电化学阻抗谱可以提供有关电解质表面薄膜的阻抗特性、电解质接近电极表面的离子传输特性以及表面反应过程的信息。
在电化学反应动力学研究中,通过电化学阻抗谱分析可以获得电化学反应的速率常数、电化学反应机理以及电化学反应动力学行为等重要信息。
一、基本知识1. 概念电化学阻抗谱(Electrochemical Impedance Spectroscopy,简写为 EIS)又叫交流阻抗谱,在电化学工作站测试中叫做交流阻抗(AC Impedance)。
阻抗测量原本是电学中研究线性电路网络频率响应特性的一种方法,引用到研究电极过程,成了电化学研究中的一种实验方法,在三电极系统下,测量工作电极的阻抗。
常见的电化学阻抗谱有两种:一种叫做奈奎斯特图(Nyquist plot),一种叫作波特图(Bode plot);还有一种相位图;奈奎斯特图和波特图:是论文中经常出现的图;相位图:在电化学测试过程中会出现,类似电极反应过程中阻抗变化图,常用于分析等效电路的构成,判断阻抗、电容等元件。
2. 基本理论当电极系统受到一个正弦波形电压(电流)的交流讯号的扰动时,会产生一个相应的电流(电压)响应讯号,由这些讯号可以得到电极的阻抗或导纳。
一系列频率的正弦波讯号产生的阻抗频谱,称为电化学阻抗谱。
注释:将电化学系统抽象作一个电路模型,这个等效电路就是由电阻(R)、电感(L)、电容(C)等基本元件按照串联或并联等不同方式组合而成,利用EIS可以测定等效电路的构成以及各个元件的大小,利用这些元件的电化学含义,来分析电化学系统的构成和电极反应过程的性质等。
3. 等效电路等效电路图示例:等效电路元件符合——名称——导纳——电阻R ——电阻—— 1/R —— RC ——电容—— jwC —— 1/jwC L ——电感—— 1/jwL —— jwLW ——无限扩散阻抗——Y_{o}\sqrt{(jw)} —— 1/Y_{o}\sqrt{(jw)}O ——有限扩散阻抗——Y_{o}\sqrt{(jw)}Coth(B\sqrt{(jw)}) ——Tanh(B\sqrt{(jw)})/Y_{o}\sqrt{(jw)}Q ——常相角元件—— Y_{o}(jw)^{a} ——1/Y_{o}(jw)^{a}物理参数溶液电阻 (R_{s}) :工作电极和对电极之间的电解质之间的阻抗;电荷转移电阻 (R_{ct}) :电化学反应动力学控制;双电层电容 (C_{dl}) :工作电极于电解质之间电容;极化电阻 (R_{p}) :当电位远离开路电位时,导致电极表面电流产生,电流受到反应动力学和反应物扩散的控制;扩散阻抗 (Z_{w}) :反应物从溶液本体扩散到电极反应界面的阻抗;界面电容 (C) :通常每一个界面之间都会存在一个电容;常相角元件(CPE) (Q) 、无限扩散阻抗 (W)、有限扩散阻抗 (O)、电感 (L) 等...PS:R_{p}\approx R_{ct}+Z_{w} ,但 R_{p}\ne R_{ct}+Z_{w} ;极化电阻通过极化曲线也可以得到(腐蚀电位出切线的斜率)。
电化学曲线极化曲线阻抗谱分析
一、极化曲线
1.绘制原理
铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)
当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)
I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线
当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析
(1)斜率
斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化
如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动
以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱
1.测量原理
它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
2. Bode图
Bode图是阻抗幅模的对数log| Z |和相角θ对相同时间的横坐标频率的对数logf的图。
图4 Bode图
阻抗:如果X是角频率为ω的正弦波电流信号,则Y即为角频率也是ω的正弦电势信号。
此时Y/X既称为系统的阻抗,用Z表示。
1.溶液电阻(Rs)
2.双电层电容(Cdl)
3.极化阻抗(Rp)
4.电荷转移电阻(Rct)
5.扩散电阻(Zw)
6.界面电容(C)
7.电感(L)
图6 两个时间常数
3. Nyquist图
电极的交流阻抗由实部z’和虚部z”组成,z=z’+j z”.Nyquist图是以阻抗虚部(-z”)对阻抗实部(z’)作的图。
对纯电阻,在Nyquist图上表现为z’轴上的一点,该点到原点的距离为电阻值的大小;对纯电容体系,表现为与z”轴重合的一条直线。
图中的半圆弧就是容抗弧;后面的斜线是W扩散;感抗是低频的时候一个向下的收缩环。
圆弧半径越大,也就是极化电阻越大,耐腐蚀越好。
圆弧半径越小,也就是极化电阻越小,耐腐蚀越差。
通过控制电极电位或者电流密度的值,测定相应的电流密度或者电位的变化而得到的电极电位与电流密度的关系曲
线,被称为极化曲线。
1.典型的、用来测试电极腐蚀速度的动电位极化曲线包括线性极化区、弱极化区和强极化区。
在强极化区,极化曲线(e-logi 图)基本是条直线,这条直线可以用来得到电极的腐蚀速度,而强极化区又叫Tafel区,所以,在不严格的说法中(通常是学生之间进行交流),说“做个强极化曲线”、“做个Tafel曲线”(只在小木虫听到),意思是做个动电位极化曲线,而曲线要极化程度够大,进入Tafel区。
2.在不同体系中,动电位极化曲线的形状是不同的。
比如,某些金属的动电位极化曲线在NaCl溶液中,阳极极化80mV就可以进入Tafel区,而在碱性溶液中,却表现出随着极化电位的增加(阳极极化同样超过80mV),极化电流密度反而减少的现象,即进入了钝化区。
动电位极化曲线会有“钝化区”。
这个钝化区和tafel区一样,是动电位极化曲线上的,具有某种特性的一段区间。
极化曲线获取信息
1.腐蚀电位(E corr),腐蚀电流(icorr)
2.获得Tafel参数(阴极极化斜率ba,阳极极化斜率bk)
3.研究防腐蚀机理,可以知道是阳极机制剂、阴极抑制剂或者是混合型抑制剂。
4.通过腐蚀电流可以计算腐蚀抑制效率(IE%=1-i1.corr/i2.corr)
由于本人电化学还不是特别了解,但是最近投了一篇文章,然后收到评委的回信,其内容是:
评委意见:Authors should remove the Ba value of CrN coating in T able 3, which is 1.218 V/dec because of the reliable T afel region is not seen in related figure due to passivation process.
但是看图的话,我感觉阳极有比较明显的塔菲尔区,现在不知如何是好,恳请大家给给意见和对图的看法!非常感谢
塔菲尔的关系是beta = dE/ d(log i)。
但是不能因为E-logi是直线关系就判断塔菲尔区。
正常的塔菲尔斜率应该在0.12V / n 左右。
n是(速率控制步的)电子传递数。
也就是说,beta 最大不会远大于0.12V。
观察阳极曲线,0 ~0.5V 这个区段。
虽然看上去是直线,但是这个斜率有0.5V 那么高,显然已经不是简单的塔菲尔关系了。
而是因为表面钝化(产生氧化/氢氧化膜)而拔高了过电位。
所以,让你去掉阳极的塔菲尔斜率,是因为它不是真正的塔菲尔区。
阻抗谱半径越大说明阻抗越大,相应的腐蚀电流就应该相对较小。
做极化时可能会出现阳极钝化,EIS对电极表面影响很小,是不会产生钝化的。
从我的极化曲线结果图中看不到阳极有钝化现象。
扫描范围看需要,只是为了确定腐蚀电位,腐蚀电流这样的就可以在开路电压正负300mv就差不多了,根据实际测试效果再调整一下。
扫速一般要求比较慢,可能毫伏/秒这样吧,具体可以看看文献是多大。
上至10mV/s,下到0.1mV/s都有的。
工作电极最好能够固定裸露面积,圆形,方形都有,我觉得主要是保证每次测试的浸入面积一样
自腐蚀电流越小,耐蚀性越好,其对应的阻抗谱的弧越大
阻抗测试对样品影响不大而极化会对样品造成破坏,1、一般先测试腐蚀电位,2、做交流阻抗,电位10mv 3、再做极化曲线。