高中化学实验实操二氧化硫的性质
- 格式:docx
- 大小:305.53 KB
- 文档页数:7

中学化学二氧化硫的性质实验教案实验名称:中学化学二氧化硫的性质实验教案实验目的:通过实验观察二氧化硫的性质,探讨其化学性质和物理性质,加深对该物质的认识。
实验器材和试剂:1. 试剂:二氧化硫溶液、盐酸溶液、氢氧化钠溶液、氯化钡溶液2. 器材:试管、试管架、滴定管、酒精灯、试剂瓶实验步骤:1. 实验一:二氧化硫的溶剂性质a. 取一支试管,加入适量的二氧化硫溶液。
b. 观察试管内二氧化硫的溶解情况,并记录下来。
c. 将试管再加热,观察二氧化硫的溶解情况是否发生变化。
2. 实验二:二氧化硫与盐酸的反应a. 取一支试管,分别加入等量的二氧化硫溶液和盐酸溶液。
b. 观察两者发生反应的情况,并观察是否产生气体。
c. 进一步可以用滴定管将产生的气体收集起来,并用氢氧化钠溶液测试该气体的酸碱性质。
3. 实验三:二氧化硫与氯化钡的反应a. 取一支试管,分别加入等量的二氧化硫溶液和氯化钡溶液。
b. 观察两者发生反应的情况,并记录下来是否生成沉淀。
c. 若生成沉淀,可进一步观察沉淀的性质和溶解规律。
实验结果与讨论:1. 实验一的结果显示,二氧化硫在常温下能够溶解在水中,且在加热后溶解性更好。
2. 实验二的结果表明,二氧化硫与盐酸发生剧烈反应,产生气体。
通过进一步测试气体的酸碱性质可以得知,该气体为二氧化硫。
3. 实验三的结果发现,二氧化硫与氯化钡产生沉淀反应,生成白色沉淀。
继续加入氯化钡溶液,沉淀不溶解,说明沉淀为不溶性盐类。
实验总结:通过本次实验,我们深入了解了二氧化硫的性质。
二氧化硫是可溶于水的气体,可以与盐酸发生剧烈反应产生二氧化硫气体,并具有一定的酸性。
此外,二氧化硫还可以与氯化钡发生沉淀反应,生成不溶性盐类。
这些实验结果有助于我们对二氧化硫的性质有进一步的认识,同时也为我们后续学习相关化学知识打下坚实的基础。
延伸拓展:除了实验中所观察到的性质外,二氧化硫还有诸多其他的性质,如氧化性和还原性。
可进一步学习相关内容,并进行更深入的实验研究。


二氧化硫的性质实验报告
实验时间:
实验小组成员:
实验目的:
实验内容:
一、探究SO2在水中的溶解性:
实验用品:矿泉水瓶(充有SO2)、水槽(盛水)
实验步骤:
1、将充满SO2小矿泉水瓶倒扣在盛水的水槽中,在水面下打开瓶盖,(注意在水下边摇晃矿泉水瓶边观察现象)
实验现象:;
解释或结论:。
2、待瓶中水面高度不再变化时,在水下拧紧瓶盖,取出矿泉水瓶,所得溶液备用。
二、SO2水溶液是否显酸性:
实验用品:SO2水溶液、pH试纸、镁条、紫色石蕊试液等
实验过程:
在点穴板的凹槽中分别放上pH试纸、镁条、紫色石蕊试液,再用胶头滴管取SO2水溶液滴入凹槽中,观察现象并解释原因。
实验用品实验现象实验结论或解释
pH试纸
镁条
紫色石蕊试液
三、SO2的漂白性实验:
实验用品:充有SO2的注射器、装有鲜花的小药瓶、
品红溶液、小试管、试管夹、酒精灯、火柴
实验过程:
1、将注射器里的SO2注入装有鲜花的小药瓶中,(注意:将针头通过软塞子打进小药瓶中并振荡。
)
观察现象:
结论或解释:
2、
实验步骤现象结论
将注射器里的SO2注入装
有品红的小试管中,振荡
将上述溶液用酒精灯微
微加热.。

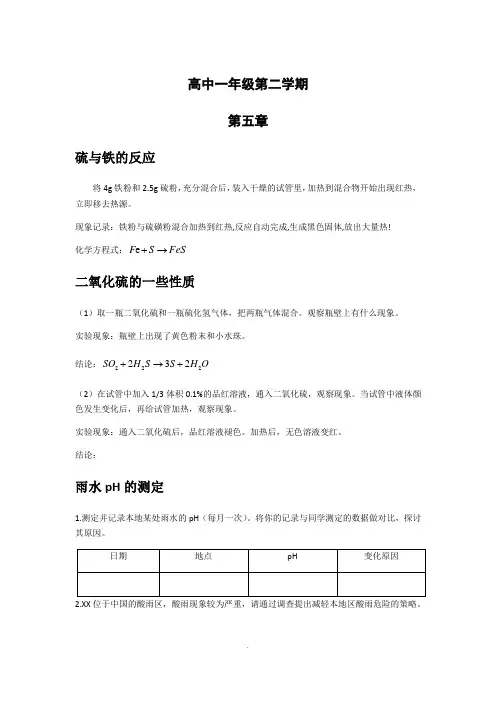
高中一年级第二学期第五章硫与铁的反应将4g 铁粉和2.5g 硫粉,充分混合后,装入干燥的试管里,加热到混合物开始出现红热,立即移去热源。
现象记录:铁粉与硫磺粉混合加热到红热,反应自动完成,生成黑色固体,放出大量热! 化学方程式:FeS S F →+e二氧化硫的一些性质(1)取一瓶二氧化硫和一瓶硫化氢气体,把两瓶气体混合。
观察瓶壁上有什么现象。
实验现象:瓶壁上出现了黄色粉末和小水珠。
结论:O H S S H SO 222232+→+(2)在试管中加入1/3体积0.1%的品红溶液,通入二氧化硫,观察现象。
当试管中液体颜色发生变化后,再给试管加热,观察现象。
实验现象:通入二氧化硫后,品红溶液褪色。
加热后,无色溶液变红。
结论:雨水pH 的测定1.测定并记录本地某处雨水的pH (每月一次)。
将你的记录与同学测定的数据做对比,探讨其原因。
2.XX 位于中国的酸雨区,酸雨现象较为严重,请通过调查提出减轻本地区酸雨危险的策略。
课堂实验:配制一定物质的量浓度的溶液配制500 mL 0.100 mol/L碳酸钠溶液。
(1)计算。
设配制500 mL 0.100 mol/L碳酸钠溶液需要碳酸钠m g。
n=c·V=0.100 mol/L×500 mL×1 L/1000 mL=0.05 molm=n·M=0.05 mol × 106 g/mol = 5.3 g(2)称量。
在天平上称取5.3 g碳酸钠固体。
(3)溶解。
将碳酸钠放入烧杯中,加入适量的蒸馏水,搅拌,使固体溶解。
冷却至室温。
(4)转移。
将溶液沿着玻璃棒小心地注入500 mL的容量瓶中。
用蒸馏水洗涤烧杯内壁两次,并将每次西堤厚的溶液都注入到容量瓶内,振荡容量瓶,使溶液均匀混合。
(5)定容。
缓慢的把蒸馏水注入容量瓶中,直到页面接近刻度2-3 cm处,改用胶头滴管加水到刻度线,使溶液的凹面底部正好跟刻度线相切。
(6)摇匀。



二氧化硫性质实验的改进实验目的:学会发现现行中学化学实验中的需要改进的问题;学会进行实验改进。
基本内容:自行发现、选择需要改进的实验;自行设计实验改进方案;实验实施与实验问题发现及记录;实验背景:二氧化硫是高一教材元素化合物体系中一种重要的物质,它的典型性质在题目中涉及广泛,成为许多题目的载体。
然而它又是一种典型的有毒大气污染物,危害人的健康.现行高中化学教材有关于二氧化硫性质的演示实验都是试管实验,且不能全面反映二氧化硫的性质,同时实验过程污染性较大,所以为了避免污染,同时使同学们对二氧化硫性质能深刻理解并培养实验的创新能力,现对SO2性质实验的装置进行了改进以创设绿色微型化化学实验。
二氧化硫的性质实验涉及二氧化硫的制取和几个独立的性质实验。
本实验把几个性质小实验组合在一起并在一个密闭空间里进行,避免了当堂制取气体的麻烦又节约了时间而且避免了造成空气污染,是一个节约、环保、微量、简便易行的实验改进。
同时可以通过对比实验的方式培养学生观察、分析问题的能力。
实验原理:二氧化硫是最常见的大气主要污染物之一。
常温下为无色有刺激性气味的有毒气体,密度比空气大。
二氧化硫的性质是高中化学教学的重要内容,它包括二氧化硫的“酸性”、漂白性、还原性与氧化性。
1.实验室通常用亚硫酸钠与浓硫酸反应制取二氧化硫:Na2SO3+H2SO4= Na2SO4+SO2+H2O。
2.二氧化硫是酸性氧化物,溶于水后,溶液显酸性,可使蓝色石蕊试纸变红。
3.二氧化硫具有漂白性,能与品红溶液中有色物质结合生成无色不稳定的物质,因此,加热后,二氧化硫重新逸出,无色溶液重新变为红色。
4.二氧化硫具有还原性,能与氧化物酸性高锰酸钾发生氧化还原反应,使高锰酸钾溶液褪色。
二氧化硫中的硫元素由+4价变为+6价。
2KMnO4+5SO2+2H2O =K2SO4+2MnSO4+2H2SO45.由于二氧化硫中的硫元素是+4,这决定了二氧化硫不仅具有还原性,同时还具有氧化性,它既可以跟强氧化剂(酸性高锰酸钾)反应,也可以跟强还原剂硫化钠反应。


二氧化硫的性质和用途二氧化硫(SO2)是一种无色的气体,具有刺激性的刺激气味。
它是一种具有重要工业和环境意义的有毒气体,但同时也被广泛应用于多种领域。
首先,让我们来了解一下二氧化硫的性质。
1.物理性质:-分子式:SO2- 分子量:64.07 g/mol-熔点:-72.7°C-沸点:-10°C- 密度:2.927 g/cm³-可溶性:易溶于水,生成亚硫酸(H2SO3)。
2.化学性质:-二氧化硫是一种酸性气体,可与碱继续反应,并形成稳定的硫酸盐。
-在空气中与氧气反应,生成硫三氧化(SO3)。
-可以与水反应,形成硫酸。
-致密的二氧化硫气体具有较强的抗氧化性质。
接下来,让我们了解一下二氧化硫的主要用途。
1.工业应用:-二氧化硫是生产硫酸的重要原料。
它可以通过燃烧硫化物矿石或硫磺来产生。
-在冶金工业中,二氧化硫用于矿石的浮选和熔炼过程,以去除杂质。
-二氧化硫还用于生产有机合成材料,如二硫化碳和合成纤维素纤维。
2.环境应用:-二氧化硫被广泛用作消毒剂和防腐剂。
例如,它可以用于处理食品和饮料,以延长其保质期。
-二氧化硫还可用于处理废水和污水,以去除有机物和杂质。
-在农业中,二氧化硫被用作杀菌剂和杀虫剂,以保护作物免受病毒和有害昆虫的侵害。
3.医疗应用:-尽管二氧化硫具有一定毒性,但它在医学中被应用于一些治疗方法中。
例如,它可用于治疗肺部感染、气管炎和哮喘等呼吸系统疾病。
4.其他应用:-二氧化硫是一种重要的工业中间体,用于合成其他化学品,如二甲基亚砜和亚磺酸。
-它还用于生产染料和颜料,如染色胺和硫酸锑。
除了以上应用外,二氧化硫还是一个重要的环境污染物。
它是燃煤、石油和天然气等燃料燃烧的副产物,也是一些工业过程和交通运输中的废气。
它的排放会对人体健康和环境造成危害,因此,减少和控制二氧化硫排放一直是环境保护的重要任务。
总结起来,尽管二氧化硫是一种有毒气体,但在工业、环境和医疗等领域中具有广泛的用途。

二氧化硫的物理性质和化学性质
二氧化硫是一种比较重要的环境污染物,它的物理性质和化学性质都决定着它成为污染的原因。
本文将介绍二氧化硫的物理性质和化学性质,以便更好地了解它的危害。
一、二氧化硫的物理性质
二氧化硫的物理性质主要有两个:熔点和沸点。
二氧化硫在常温
下是一种无色、无臭的气体,其熔点为-10℃,沸点为-10.5℃。
另外,它具有很强的挥发性,容易被空气中的温度和湿度所影响,在温度较高的地方可以更容易的挥发。
二氧化硫在室温下没有特殊的毒性及毒害,它不易溶于水,但能混溶于有机溶剂,容易与其他气态物质相混合,可以挥发到大气中,以及轻易的穿透性。
二、二氧化硫的化学性质
二氧化硫的主要化学特性是它能够与多种元素结合形成二元或
多元化合物,如硫酸、硫酰氯、硫脲、硫胺素等衍生物,这些衍生物是污染大气中比较重要的污染物,比如二氧化硫和氮氧化物可以结合形成大气污染物硫酸雾。
此外,由于二氧化硫的极性特性,它很容易与有机物结合,这种结合会产生有毒的有机氯化物,有机氯化物是一种毒性极强的有害物质,通过大气污染物的穿透能力,可以造成神经毒性和肝脏毒性,对人类健康造成很大的风险。
综上所述,二氧化硫的物理性质和化学性质是它成为污染的原因。
它具有很强的挥发性和穿透性,可以与多种元素结合形成污染物,甚至可以与有机物结合形成有助于污染的有毒有害物质。
因此,要有效控制二氧化硫排放,有必要加强对环境污染的研究,以防止环境污染的发生。
1
节约意识,从而培养良好的核心素养。
实验教学本节课是二氧化硫酸性氧化物、漂白性、还原性和氧化性四大性质的研究。
课堂上首先通过学生预习案中准备的“二氧化硫的危害”和“二氧化硫的用途”正反两个视频的展示引入新课,让学生首先树立辩证唯物主义的科学世界观。
二氧化硫的制备和四大性质的检验采用学生理论分析性质,并合作探究设计实验方案,然后不断改进方案的方式完成,充分的调动了学生学习的主动性,培养了合作探究的能力,以及分析问题、解决问题的能力。
最后通过“如何检验食品中的二氧化硫?和如何做到二氧化硫的减排?”两个问题的研究做到从化学走向社会。
下面详细介绍在课堂上通过和学生不断的探究和改进实验方案后最终确定的二氧化硫的制备和四大性质的检验装置。
一、改进后的实验操作装置图:
二、装置的基本构造及安装方法:
学生活动:分析推理,得出二氧化硫性质
设计意图:通过学生的“微观和宏观联系”、“理论和实际结合”、的分析,培养“理论源于实践,又指导生活”的辩证思想。
探究案活动:
【新课引入】:再请学生展示“十三五计划中北京二氧化硫减排需下降35%”视频和“红酒中二氧化硫的用途”两个视频以及二氧化硫的相关素材引入新课
学生活动:展示收集生活中的二氧化硫素材,总结推测二氧化硫具有漂白性、还原性和氧化性。
教师活动:指导学生认真展示及观看,引导学生总结二氧化硫可能具有的性质。
设计意图:通过导入生活情景,从众所周知的身边知识入手,熊正反两个角度入手,培养学生总结概括的能力,激发学生的学习兴趣,让学生首先树立辩证唯物主义的科学世界观。
【探究活动一】
指导学生根据预习案中推测的二氧化硫的性质,根据已给药品,设计单一性质的检验方法(药品:70%硫酸、亚硫酸钠粉末、品红试液、硫化钠溶液、氯化钡溶液、石蕊试液、高锰酸钾溶液、酚酞溶液、NaOH溶液)
教师活动:指导学生设计验证单一性质时所需要的方法,以及细节关注。
学生活动:积极思考,讨论交流,制定方案
设计意图:温故知新,理论联系实际,逐步引导学生思考、递进,得出结论,培养学生逻辑思维能力。
【展示】:传统方法制取二氧化硫及验证性质的视频
教师活动:引导学生分析这套之气装置有什么优点,又有什么缺点?
学生活动:学生思考并进行并讨论,结合该装置的缺点,提出并设计合适的改进方案。
设计意图:引导学生观察和分析问题,为创新和发展思维做铺垫。
【探究活动二】:
提出合理化的改进方案
教师活动:指导学生在画图时的思路,提醒对各种仪器的注意事项的理解
学生活动:再次讨论,设计出合理化方案,如图1
设计意图:通过对一种性质的多种装置方法的讨论,拓展学生的思路,培养学生发散思维能力。
图1
【拓展迁移】
质疑:用矿泉水瓶的收集方式的确起到了在验证时环保的作用。
但二氧化硫的
产生量很大,而且制取的过程还没有解决,如何再改进?
教师活动:对已制定方案中选择最好的实验方案,再次引导、分析、朝着微型化的方向改进,帮助确定最后的实验方案
学生活动:学生模拟原实验中的制取装置,选择从生活中寻找材料改进。
设计意图:培养学生提出问题和解决问题的能力以及综合思维能力
【探究活动三】
分组实验,合作探究,二氧化硫的还原性、氧化性、漂白性。
教师活动:结合学生设计的实验,给出合理化建议,确定改进后的装置,进行分组实验。
学生活动:小组合作,动手探究、积极主动、认真细心,学生改进后,图2 教师指导共同讨论后的全新改进最终确定方案,如图3
设计意图:将实验设计微型化,可以节约药品、充分利用生活中的器材、一套装置的多元化使用,减少环境污染,培养学生的“绿色化学”思想,理论联系实际,培养严谨的科学态度效果。
学生改进后的设计图2
教师指导共同讨论后的全新改进图3
【书写方程式】
教师活动:指导学生方程式的书写,注意细节
学生活动:动手写方程式,并加深理解,顺利完成方程式的书写。
教师活动:引导分析从实验角度证明
学生活动:设计实验方案,动手操作
设计意图:以问题为主线,层层递进,环环相扣,引导探究并给予适当的诱导点拨,可达到最佳的学习
【课堂小结】:
1、从二氧化硫的性质角度
2、从实验探究的角度
3、从化学重新走向生活的角度
教师活动:注重化学用语的准确性,给予适当的指导和鼓励、赞赏!
学生活动:总结二氧化硫的性质、实验探究的方法、以及在生活中如何检验二氧化硫。
设计意图:实验的成功、结论的得出使学生能尝试到科学探究的乐趣。
从微观到宏观,从理论到实践,从零散到系统的总结,切实感受本节课的收获,使他们学会科学研究与探究的方法。
有利于提高学生的科学素质,培养学生的创新精神,归纳总结的能力。
训练案活动
1、对应知识点习题的快速训练
教师活动:限定时间
学生活动:认真完成,快速反馈
设计意图:及时巩固,加强理解。
2、课后拓展探究:
运用已有的知识探究今天的实验方法,还可以去验证哪些气体,如何设计?。