化学反应工程原理 简单反应
- 格式:ppt
- 大小:444.50 KB
- 文档页数:23

工业制烧碱的原理化学方程式工业制烧碱,听起来高大上,其实背后藏着一些简单又有趣的化学原理。
要说烧碱,首先大家得知道它的化学名叫氢氧化钠,没错,就是那个能让你洗碗洗得特别干净的东西,嘿!在工业上,烧碱的制作可是个大工程,通常通过电解氯化钠溶液来实现。
想象一下,这就像把食盐放到水里,摇一摇,然后让它电击一下,哦哟,立马就能得到我们需要的烧碱。
说到化学反应,这可是个神奇的事情,化学方程式就像魔法咒语一样。
要是把这反应写成方程式,简单来说就是2NaCl + 2H2O → 2NaOH + Cl2 + H2。
这里,NaCl就是食盐,H2O就是水,反应后变成了烧碱、氯气和氢气。
多酷啊,光靠盐和水,就能搞出这么多有用的东西。
这个过程其实很高效。
把氯化钠溶液放到电解槽里,电流一通,反应就开始了。
氯离子在阴极处发生还原反应,氢气被释放出来,感觉就像在给水加个特效。
与此同时,钠离子在阳极处发生氧化反应,生成了氯气。
那时候,反应槽里冒出的泡泡,简直像个小型的化学派对,真是热闹。
值得一提的是,氯气可是个危险角色,别看它是个气体,处理不当可是会引发大麻烦。
搞不好就得戴上防毒面具,像个特工一样。
虽然氯气在这里是个副产品,但可别小看它,工业上可是用得着的,漂白剂、杀菌剂,都是它的“战利品”。
所以说,制烧碱的过程,既要小心又要讲究,真是“来者不善,善者不来”啊。
而烧碱本身可不是个简单的家伙。
它是一种强碱,可以和酸发生中和反应,搞出一堆盐和水。
想想看,做菜的时候,调味品要掌握好,酸碱平衡才能吃得更爽。
工业上,烧碱用得可广泛了,造纸、纺织、制药,还有那玩意儿,清洁剂,嘿,家里搞卫生的好帮手。
无论是清洗油污,还是调节pH值,烧碱都是个万能工具。
再说说这烧碱的应用场景,真是“好马不吃回头草”。
在制纸行业,烧碱用来分解木材纤维,造出一张张洁白的纸;在纺织行业,烧碱帮助去除布料上的杂质,让衣服变得更光鲜亮丽。
药品制造中,烧碱也是个重要的“幕后推手”,很多药物的合成过程中都离不开它。



科学初步认识简单的化学反应化学反应是物质之间发生的转化过程,其中涉及到原子、分子之间的重新组合、键的断裂和形成。
通过对化学反应的研究,人类能够更深入地了解物质的性质和变化规律。
本文将介绍几种常见的简单化学反应,以及它们的基本原理和实际应用。
一、酸碱中和反应酸碱中和反应是指在酸和碱之间发生的化学反应,产物为盐和水。
其反应式可以表示为:酸(H+)+碱(OH-)→盐+水。
这种反应常用于酸碱中和反应实验和各类中和药剂的制备过程。
例如,氢氧化钠(NaOH)和盐酸(HCl)反应生成氯化钠(NaCl)和水(H2O)。
二、氧化还原反应氧化还原反应是指物质在电子转移过程中发生氧化或还原的反应。
氧化是指物质失去电子,而还原是指物质获得电子。
常见的氧化还原反应有金属与非金属的反应、金属与酸的反应等。
例如,铁(Fe)与氧气(O2)反应生成氧化铁(Fe2O3),这是一种典型的氧化反应。
三、置换反应置换反应是指一种元素或原子团取代另一种元素或原子团的反应。
置换反应常见的有单一置换反应和双重置换反应。
单一置换反应是指一种元素取代了化合物中的另一种元素,其反应式可以表示为:A + BC → AC + B。
双重置换反应是指两种化合物中的正离子和负离子重新组合形成两个新的化合物,其反应式可以表示为:AB + CD → AD + CB。
置换反应广泛应用于工业生产和实验室合成中。
四、水解反应水解反应是指化合物在水中发生离解并与水反应,产生新的化合物的反应。
常见的水解反应有酸水解和盐水解两种反应。
酸水解是指酸与水反应产生酸根离子的过程,例如硫酸与水反应生成硫酸根离子(HSO4-)。
盐水解是指盐与水反应产生酸碱的过程,例如氯化钠与水反应生成氢氧化钠(NaOH)和盐酸(HCl)。
五、聚合反应聚合反应是指单体(小分子)通过共价键的形成而合成高分子化合物的过程。
这种反应也被称为缩合反应。
聚合反应是合成高分子材料的重要方法,例如合成塑料和合成纤维。



化学反应工程复习公式指导化学反应工程是化学工程的重要分支之一,主要涉及到反应速率、反应平衡、反应热力学等方面的问题。
在进行化学反应工程的设计和优化时,需要运用一系列的公式,以指导实际操作和解决问题。
以下是一些常见的化学反应工程公式,供复习和参考。
1.反应速率公式在化学反应中,反应速率是指单位时间内反应物消失或产物生成的量。
一般来说,化学反应速率与反应物浓度之间存在一定的关系。
根据实验数据,可以通过拟合得到反应速率公式。
常见的反应速率公式有:-零级反应速率:r=k-一级反应速率:r=k[A]-二级反应速率:r=k[A]²-伴随一级反应速率:r=k[A]·[B]其中,r为反应速率,k为反应速率常数,[A]和[B]为反应物浓度。
2.反应平衡公式在反应平衡条件下,反应物和生成物的浓度保持不变。
根据反应平衡常数,可以得到反应平衡公式。
常见的反应平衡公式有:-简单反应物与生成物的摩尔比例:aA+bB⇌cC+dD其中,a、b、c、d分别为反应物和生成物的系数,A、B、C、D分别为反应物和生成物的摩尔浓度。
反应物和生成物的关系可以表示为:Kc=[C]ᶜ[D]ᵈ/[A]ᵃ[B]ᵇ-简单反应物与生成物的分压比例:aA+bB⇌cC+dD其中,a、b、c、d分别为反应物和生成物的系数,A、B、C、D分别为反应物和生成物的分压。
反应物和生成物的关系可以表示为:Kp=(Pc/RT)ᶜ(Pd/RT)ᵈ/(Pa/RT)ᵃ(Pb/RT)ᵇ其中,R为理想气体常量,T为温度,Pa、Pb、Pc、Pd分别为反应物和生成物的分压。
3.反应热力学公式反应热力学研究反应热效应与反应过程的关系。
常见的反应热力学公式有:-反应焓变公式:ΔH=Σ(nᵢHᵢ)其中,ΔH为反应焓变,nᵢ为反应物或生成物的摩尔数,Hᵢ为反应物或生成物的摩尔焓。
-熵变公式:ΔS=Σ(nᵢSᵢ)其中,ΔS为反应熵变,nᵢ为反应物或生成物的摩尔数,Sᵢ为反应物或生成物的摩尔熵。


an n p n n A Ao Po P )()(--=-βAf Ao Pf C C C -=βAoPf C C =ϕ1 基本概念1.1 优化:在一定的范围内,选择一组优惠的决策变量,使系统对于确定的评价标准达到最佳的状态。
1.2 反应速率:反应系统中某一物质在单位时间、单位反应区内的反应量。
1.3 反应转化率:反应物中某一组分转化掉的量(摩尔)与其初始量(摩尔)的比值。
常用x 表示。
1.4选择率:对于复杂反应过程,同一反应原料可以生成几种不同的产物和无用的副产物。
此时,不同产物之间的分配比例对该反应过程的经济效益是一个非常重要的指标。
产物之间的这种分配比例可以用反应选择率 表示。
定义为已经转化掉的反应物量(摩尔)中,转化为目的产物的摩尔分率。
例:(主反应) (副反应)或又称为平均选择率。
瞬时选择率 β1.5反应收率:得到的产物的量与投入反应系统的原料的量的比值φ。
该指标综合了选择率和反应速率两个指标的特点。
可采用摩尔收率和质量收率来表示。
以摩尔收率为例: 总收率 1.6 单耗:产品的原料消耗若以每份产品所需的反应原料份数来表示,就称为原料单耗,也可以用摩尔分率或质量分率来表示。
单耗与收率互成倒数。
1.7 返混:使早先进入的存在于反应器内的物料有机会与刚进入的反应物料相混合,这种混合现象称为返混现象。
1.8排除了一切物理传递过程的影响,得到的化学反应动力学称为微观动力学或本征动力学。
在包含物理过程影响的条件下所测得的反应动力学称为宏观动力学(或称为表观反应动力学)。
1.9 基元反应和非基元反应:如果一个化学反应,反应物分子在碰撞中相互作用直接转化为生成物分子,这种化学反应称为基元反应(elementary reaction),否则就是非基元反应。
1.10 反应机理或反应历程:复杂反应要经过若干个基元反应才能完成,这些基元反应代表了反应所经过的途径,动力学上就称为反应机理或反应历程。
1.11 反应的级数:在化学反应速率方程中,各物浓度项的指数之代数和就称为该反应的级数,用n 表示。

化学反应原理选修4
化学反应原理是化学学科的重要内容,它研究化学变化的基本规律和机理。
通过观察和分析化学反应过程中的现象和性质变化,可以推断反应物的结构和性质,探索反应途径和反应速率的规律,揭示反应过程中的能量变化以及物质转化过程中的电荷转移与电子重排等基本原理。
在化学反应中,反应物经历物质的转化和能量的转化。
物质的转化是指反应物的原子间键的断裂和形成,进而生成新的化学物质。
这种转化可以是单一的,也可以是多种反应物之间的复杂转化。
能量的转化是指化学反应过程中能量的吸收和释放。
反应物中的化学键断裂需要吸收能量,而新的化学键形成则释放能量。
这种能量变化影响着化学反应的热效应和速率。
化学反应的速率是描述反应进行快慢的参数,它反映了反应物从初始状态到最终状态的转化速度。
反应速率受到多种因素的影响,如反应物浓度、温度、压力、催化剂等。
通过改变这些因素,可以调控反应速率达到所需的目的。
同时,通过反应速率的研究可以推断出反应途径和机理。
化学反应的机理是指反应的详细步骤和中间产物的形成和消失过程。
它通过实验数据和理论模型的分析,揭示了反应物转化的详细过程。
在探索化学反应机理的过程中,常常涉及到配位化学、光化学、电化学等多个分支学科的知识。
化学反应原理的研究不仅有助于理解物质的转化过程和能量的转化规律,还对于工业生产和环境保护等方面具有重要意义。
通过理论研究和实验验证,可以进行合成新化合物、改进反应工艺、提高反应效率等。
同时,了解反应原理也有助于节约资源、减少废弃物排放、控制环境污染等方面的应用。
化学工程原理化学工程原理是指应用化学知识和原理,结合工程技术来解决与化学过程相关的问题。
它涉及到诸多领域,如化学反应、传热传质、流体力学、传递过程、设备设计以及安全等方面。
在化学工程原理的指导下,工程师们能够设计和改进化工过程,提高生产效率和产品质量。
一、化学反应原理化学反应是化学工程中的核心过程之一。
它涉及到物质之间的转化和反应动力学。
在化学反应中,原料通过一系列的化学反应转化为产物。
化学反应速率和平衡是了解和控制化学过程的重要指标。
对于快速反应的控制,需要考虑反应温度、压力、浓度和催化剂等因素。
此外,了解反应的平衡性质和平衡条件对于工程师来说也非常重要。
二、传热传质原理传热传质是指热量和质量在化工过程中的传递。
化工过程中常常需要控制温度和浓度等参数,因此传热传质的研究对于合理设计化工设备至关重要。
传热传质过程由热传导、对流和辐射等几个方面组成。
了解传热传质的机理和各种传热传质模型可以帮助工程师优化过程,提高能效和降低成本。
三、流体力学原理流体力学是研究流动物质的力学规律的学科。
在化学工程中,流体力学原理用于研究流体在管道、槽等装置中的流动行为。
了解流体力学的基本方程和流体的特性可以帮助工程师设计流道结构,减小流体阻力,提高传递效率。
四、传递过程原理传递过程指物质在化工过程中的传递行为,如质量传递、动量传递和能量传递。
质量传递在吸收、吸附和分离等过程中起着重要作用。
动量传递涉及到粒子的运动和压力的传递,能量传递与温度、热量和功率等参数有关。
传递过程原理的研究可以帮助工程师选择合适的分离方法和设备,提高生产效率和产品纯度。
五、设备设计原理设备设计是化学工程原理的应用之一。
在化工过程中,各种设备如反应器、蒸馏塔、输送设备等被设计用于促进化学反应、分离和传递。
设备设计需要考虑流体力学、传热传质、安全和经济性等因素。
了解设备设计原理可以帮助工程师选择和设计合适的设备,确保化工过程的有效运行。
六、安全原理化学工程中的安全问题至关重要,不当的操作和设计可能导致事故和损失。
化学反应的反应物质反应物反应机理化学反应的反应物与反应机理化学反应是物质转化过程中发生的一系列变化,并涉及到反应物与反应机理。
在化学反应中,反应物是参与反应并发生化学变化的物质,而反应机理则描述了反应物之间的相互作用以及产物的形成过程。
本文将从反应物和反应机理两个方面进行论述。
一、反应物反应物是化学反应中参与并发生反应的物质,它们在反应前是独立存在的。
反应物可以是元素、化合物或离子,并且它们的化学性质会在反应中发生改变。
反应物的组成和性质直接影响着反应的进行和产物的生成。
1. 元素作为反应物:当元素参与化学反应时,它们可以相互结合形成化合物或生成化合物的组成元素。
例如,氧气和氢气在适当条件下反应,生成水分子,反应物为氧气和氢气,反应方程式为:2H₂ + O₂→ 2H₂O。
2. 化合物作为反应物:当化合物参与反应时,它们可能会分解成更简单的物质,或与其他反应物结合形成新的化合物。
例如,二氧化碳与水反应生成碳酸氢根离子,反应物为二氧化碳和水,反应方程式为:CO₂ + H₂O → HCO₃⁻。
3. 离子作为反应物:在溶液中,离子是常见的反应物。
它们可以与其他离子结合生成沉淀或溶解,或者进行酸碱中和反应。
例如,氯离子和银离子在溶液中反应,生成白色的氯化银沉淀,反应物为氯离子和银离子,反应方程式为:Ag⁺ + Cl⁻ → AgCl↓。
二、反应机理反应机理描述了化学反应中反应物之间的相互作用过程,以及产物的形成过程。
它包括多个反应步骤和中间物质,以反应物到产物的转化路径为基础。
反应机理可以通过实验数据和理论推导来确定。
1. 反应速率:反应速率是一个反应过程中反应物转化为产物的速度。
它可以通过反应物浓度、温度、催化剂等因素来调节。
反应物浓度增加、温度升高或添加催化剂都可以加快反应速率。
2. 反应机理的步骤:化学反应通常包含多个反应步骤。
在每个步骤中,反应物之间发生特定的相互作用以形成中间物质。
这些中间物质经过一系列步骤后最终转化为产物。
第三章 理想间歇反应器1 理想间歇反应器的特征: ,因此理想间歇反应器的反应结果将 。
2 在BR 反应器中,反应物料达到一定转化率所需要的反应时间,只取决于 ,而与 无关。
反应器的大小只取决于 。
3 在BR 反应器中的简单反应的反应特性:(1)达到相同的转化率或残余浓度,k 值提高,都将减少 ,与 无关;(2)达到一定的转化率, 反应时间与初始浓度无关, 反应时间与初始浓度成反比, 反应时间与初始浓度成正比。
因此,对于一级反应和二级反应, 反应物初始浓度将 生产能力。
(3)反应级数越高,要求的残余浓度越低,反应时间 ;对于二级反应,提高转化率将大幅增加 。
4 自催化反应是 。
自催化反应的反应速率最大的C A 值为( 。
5 BR 反应器中的最优反应时间的条件是: ,单位时间产物生成量 。
6 简述反应器设计的步骤?7 简述可逆反应的重要特点、反应的浓度效应和温度效应?11.如果平行反应均为一级不可逆反应,若>,提高选择性应_______。
A. 提高浓度B. 提高温度C. 降低浓度D. 降低温度12. 如果平行反应均为一级不可逆反应,若>,提高收率应_______。
A. 提高浓度B. 降低浓度C. 提高温度D. 降低温度13 BR 反应器中的简单反应计算题:13.1 反应A B 为n 级不可逆反应。
已知在300K 时要使A 的转化率达到20%需要12.6分钟,而在304K 时达到同样的转化率仅需要3.20分钟,求该反应的活化能。
AP(主)S(副)主E 副E P S AP(主)S(副)主E 副E P。
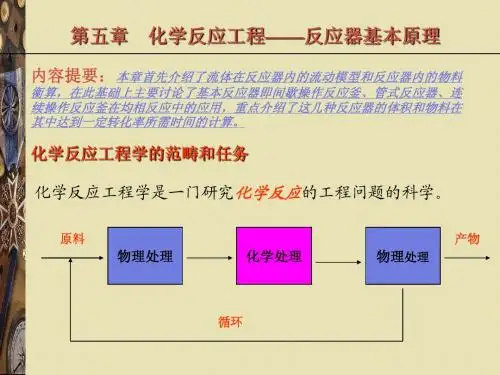
一、 绪论 1. 研究对象是工业反应过程或工业反应器 研究目的是实现工业反应过程的优化2. 决策变量:反应器结构、操作方式、工艺条件 3. 优化指标——技术指标:反应速率、选择性、能耗 掌握转化率、收率与选择性的概念、计算 4.工程思维方法,分析方法二、化学反应动力学1. 反应类型:简单反应、自催化、可逆、平行、串联反应基本特征、分析判断2. 化学反应速率的工程表示))((反应区反应时间反应量反应速率=3. 工业反应动力学规律可表示为:)()(T f C f r T i C i ⋅=a) 浓度效应——n 工程意义是:反应速率对浓度变化的敏感程度。
b) 温度效应——E 工程意义是:反应速率对温度变化的敏感程度。
已知两个温度下的反应速率常数k ,可以按下式计算活化能E :E ——cal/mol ,j/molT ——KR = 1.987cal/mol.K = 8.314 j/mol.K工程问题三、PFR 与CSTR 基本方程(物料衡算方法)1. 理想间歇:⎰⎰-=--==Af A Af A x x A AA c c A A R r dx c r dc v V t 00)()(00 2. 理想PFR : ⎰⎰-=--==Af A Af A x x A A A c c A A R p r dx c r dc v V 00)()(00τ 3. CSTR : )()(00A AA A A A R p r x c r c c v V -=--==τ 4. 图解法四、简单反应的计算n=1,0,2级反应特征 0(1)A A A c c x =-浓度、转化率、反应时间关系式 PFR →CSTR ,CSTR →PFR基本关系式 PFR (间歇) CSTR (物料衡算)00()Af A c R A pc A V dc v r τ==--⎰ 0()A AR m A c c V v r τ-==- n=00A A p c x k τ= 0A A p c x k τ=n=1 1ln 1p A k x τ=-0A Am A c c kc τ-=n=2 011p A A k c c τ=-02AA Am c c kc τ-=0 x Af x Aτ/c A0 τ五、可逆反应AP)()(02121A A A P A A C C k C k C k C k r --=-=-积分式:浓度效应:与简单反应相同 温度效应:多段绝热,段间冷却;多段绝热,段间冷激。