(整理)大气环境化学.
- 格式:doc
- 大小:137.50 KB
- 文档页数:12




大气环境化学概述一、引言大气环境化学是研究大气环境中各种化学成分与过程的相互作用和影响的一个重要学科,其研究对象包括大气中的气态和颗粒态污染物、大气化学反应过程、大气光化学和大气中的气溶胶等。
大气环境化学的研究对于理解和减少大气污染、改善空气质量、保护人类健康和生态环境具有重要意义。
二、大气环境化学的研究内容1.大气中的主要污染物:大气中的主要污染物包括臭氧(O3)、二氧化硫(SO2)、氮氧化物(NOx)、挥发性有机化合物(VOCs)等。
2.大气中的化学反应过程:大气中的化学反应过程是大气环境化学的核心内容,包括氧化反应、光解反应、光化学反应等。
3.大气中的气溶胶:气溶胶是大气中的微粒,对大气光学特性、云和降水形成、空气污染等方面具有重要影响。
4.大气污染物来源与传输:大气污染物的来源包括自然来源和人为来源,而传输过程则直接影响大气污染的空间分布和浓度水平。
三、大气环境化学的研究方法1.实地观测:通过建立大气污染源监测站和气象站,实时监测和记录大气中的污染物浓度、气象参数等数据。
2.模型模拟:利用数学模型对大气中的化学反应过程和污染物传输进行模拟和预测,为空气质量预报提供科学依据。
3.实验室研究:通过实验室模拟大气环境中的化学反应过程,探究不同污染物之间的相互作用和影响。
4.多学科交叉研究:大气环境化学是一个跨学科领域,需要与大气物理学、气象学、环境科学等学科相互交叉,并结合相关技术手段开展研究。
四、大气环境化学研究的应用与前景1.空气质量管理与控制:大气环境化学研究为改善空气质量提供科学依据,指导制定大气污染防治政策和措施。
2.气候变化研究:大气中的气溶胶和温室气体等化学成分对气候变化起着重要作用,大气环境化学研究对于气候变化机制的解析具有重要意义。
3.健康保护与风险评估:大气污染物对人类健康和生态环境产生危害,大气环境化学研究可以帮助评估大气污染对人体健康和生态系统的影响,保护人类健康。
五、结语大气环境化学作为一门交叉学科,已经成为应对大气污染和气候变化等环境问题的重要研究领域。


《大气环境化学》重点习题及参考答案1.大气中有哪些重要污染物?说明其主要来源和消除途径。
环境中的大气污染物种类很多,若按物理状态可分为气态污染物和颗粒物两大类;若按形成过程则可分为一次污染物和二次污染物。
按照化学组成还可以分为含硫化合物、含氮化合物、含碳化合物和含卤素化合物。
主要按照化学组成讨论大气中的气态污染物主要来源和消除途径如下:(1)含硫化合物大气中的含硫化合物主要包括:氧硫化碳(COS)、二硫化碳(CS2)、二甲基硫(CH3)2S、硫化氢(H2S)、二氧化硫(SO2)、三氧化硫(SO3)、硫酸(H2SO4)、亚硫酸盐(MSO3)和硫酸盐(MSO4)等。
大气中的SO2(就大城市及其周围地区来说)主要来源于含硫燃料的燃烧。
大气中的SO2约有50%会转化形成H2SO4 或SO42-,另外50%可以通过干、湿沉降从大气中消除。
H2S 主要来自动植物机体的腐烂,即主要由植物机体中的硫酸盐经微生物的厌氧活动还原产生。
大气中H2S 主要的去除反应为:HO + H2S → H2O + SH。
(2)含氮化合物大气中存在的含量比较高的氮的氧化物主要包括氧化亚氮(N2O)、一氧化氮(NO)和二氧化氮(NO2)。
主要讨论一氧化氮(NO)和二氧化氮(NO2),用通式NO x表示。
NO和NO2是大气中主要的含氮污染物,它们的人为来源主要是燃料的燃烧。
大气中的NO x 最终将转化为硝酸和硝酸盐微粒经湿沉降和干沉降从大气中去除。
其中湿沉降是最主要的消除方式。
(3)含碳化合物大气中含碳化合物主要包括:一氧化碳(CO)、二氧化碳(CO2)以及有机的碳氢化合物(HC)和含氧烃类,如醛、酮、酸等。
CO的天然来源主要包括甲烷的转化、海水中CO的挥发、植物的排放以及森林火灾和农业废弃物焚烧,其中以甲烷的转化最为重要。
CO 的人为来源主要是在燃料不完全燃烧时产生的。
大气中的CO可由以下两种途径去除:土壤吸收(土壤中生活的细菌能将CO代谢为CO2 和CH4);与HO自由基反应被氧化为CO2。

大气环境的化学组成与分析随着光污染、噪声污染、水污染等问题逐渐被重视,人们逐渐开始更加关注大气环境的化学组成与分析。
大气环境是人类生活、工作、学习等必不可少的环境之一,而了解其化学组成和分析则是控制空气污染的关键。
因此,本文将着重介绍大气环境的化学组成及相关分析方法,旨在加深大众对于大气环境污染控制的认识。
一、大气环境的化学组成大气环境主要由气体、颗粒物和气溶胶组成,其中气体和颗粒物是大气污染的主要形式。
气体分为自然气体和污染气体两种,其中自然气体主要是氮气、氧气、水蒸气、惰性气体等,在大气环境中不会对人的健康产生危害。
而污染气体则主要包括二氧化硫、氮氧化物、臭氧、一氧化碳、甲烷等,这些污染气体都会对人的健康产生不同的影响。
颗粒物则是指空气中悬浮的固体或液体细小颗粒,主要来源于交通运输、工业排放等人类活动。
颗粒物的直径越小,则对人体的危害也越大。
常见的颗粒物有可吸入颗粒物(PM10),可入肺颗粒物(PM2.5),细小颗粒物(PM1.0)等。
气溶胶则是介于气态和颗粒态之间的细小颗粒,其大小一般在0.1微米到1微米之间。
气溶胶具有极强的光学、化学等特性,能够影响大气环境的物理、化学、生态等过程。
二、大气环境的化学分析方法大气环境的化学分析方法主要包括实地采样分析和遥感分析两种。
实地采样分析方法是通过在大气环境中采集空气样本,然后对这些空气样本进行实验分析,以确定其中的污染物含量。
常用的实地采样方法包括主动式采样和被动式采样。
主动式采样是指在不同的大气污染源头设置采样点,对空气进行采样、监测和分析。
而被动式采样则是指直接在一个地点采样,观察不同污染物的变化。
遥感分析方法则是通过卫星、飞机等远距离观测设备,对大气环境进行监测和分析。
遥感分析方法具有非接触式、远距离等特点,能够对大范围的大气环境进行实时监测和分析。
遥感分析方法主要用于掌握大气环境的总体情况和污染情况,也可用于建立大气环境污染预警系统。
三、大气环境化学分析的意义了解大气环境的化学组成和分析对于人类的生命健康以及经济社会的可持续发展有着十分重要的意义。


大气环境化学绪论1.大气环境化学主要研究大气中对环境有影响的重要组分在大气中的来源、存在形式,迁移过程中的化学转化,归宿以及对大气质量的影响等。
2.大气环境化学的研究方法主要有:现场试验研究,实验室研究和模式计算。
3.一个大气即所有的污染问题都发生在同一个大气下,各种问题通过自由基化学或关键物种的化学过程而彼此相关联,应采取综合性的方法对各种相关的污染问题进行整体考虑,以避免在解决一个问题的同时又产生了新的问题。
第一章1.大气由还原性气氛向氧化性气氛转化。
2.大气分为对流层,平流层,中层,热层和外层。
3.对流层厚度随纬度季节不同而变化。
对流层集中了大气质量的3/4,90%以上的水汽集中在对流层中,大气中主要的天气现象都形成在此层内。
4.自对流层顶向上到55km左右的气层成为平流层。
平流层特点:1.空气没有垂直对流运动,平流运动占据显著优势;2.空气比下层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象;3.在高约15~35km的范围内,有厚约20km的臭氧层,因为臭氧吸收太阳辐射的紫外线,使得平流层温度升高。
5.大气组分按其停留时间长短可分为准永久性气体,可变化组分和强可变组分。
6.大气组分的浓度表示方法:1)混合比浓度:这种浓度表示法主要用于气态污染物,对于大气中的低浓度物质是适用的。
公式:p29 2)这种浓度表示方法用于比ppt还要低的浓度水平,如自由基浓度等,表示每立方厘米空气中有多少个分子、原子或自由基。
公式p29 3)质量浓度表示法:p307.自由基在其电子壳层的外层有一股不成对电子,它们对于增加第二个电子有很强的亲和力,因此能起强氧化剂的作用。
大气环境质量标准。
(2月份公布的新标准)第二章1.污染物来源:人为源有燃料燃烧,工业排放,固体废弃物的焚烧,农业活动排放,生物质。
天然源有自然尘,森林、草原火灾,火山活动,森林排放,海浪飞沫,海洋浮游植物、海洋表层。
2.大污染物的汇机制。
1)干沉降:重力沉降,与植物、建筑物或地面相碰撞而被捕获的过程;2)湿沉降:大气中的物质通过降水而落到地面的过程;3)化学反应去除:污染物在大气中通过化学反应生成其他气体或粒子而使原污染物在大气中消失;4)向平流层输送。

化学环境的知识点总结一、大气环境化学1. 大气的组成大气由氮气(约78%)、氧气(约21%)和其他气体(约1%)组成。
其他气体包括水蒸气、二氧化碳、氩气、氖气、氦气等。
这些气体在大气中起着重要的作用,例如氮气和氧气是人类呼吸的气体,二氧化碳是植物光合作用的原料。
2. 大气污染大气污染是指大气中的有害物质超出一定浓度,对人类健康和环境造成危害的现象。
主要的大气污染物包括二氧化硫、氮氧化物、颗粒物、挥发性有机化合物和臭氧。
这些污染物来自工业排放、机动车尾气、燃煤等活动。
大气污染对人类健康和环境造成严重危害,需要采取措施减少排放。
3. 大气的自净作用大气具有自净作用,通过化学反应和物理过程来清除污染物。
例如,大气中的二氧化硫可以被光化学反应氧化成硫酸雾,然后形成酸雨,从而清除大气中的有害物质。
此外,大气中的氮氧化物也可以和臭氧发生反应,形成氮氧化合物,从而减少大气污染物的浓度。
4. 温室效应温室效应是地球大气中的一种自然现象,是指大气中的某些气体(例如二氧化碳、甲烷、氟利昂等)能够吸收和释放地球表面的热量,使得地球表面温度上升。
这种现象在一定程度上维持了地球的温度,但过强的温室效应会导致全球气候变暖,对生物多样性和人类生活造成严重影响。
5. 大气成分的分析化学分析方法可以用来分析大气成分,例如质谱仪、紫外-可见分光光度计、气相色谱质谱联用仪等。
利用这些方法,可以监测大气中的污染物浓度,为环境保护提供数据支持。
二、水环境化学1. 水的组成水分子由一个氧原子和两个氢原子组成,化学式为H2O。
水是地球上最重要的化学物质之一,是生命的基础,也是许多化学反应的参与物。
2. 水的净化水的净化是指将水中的污染物去除,使其达到可以饮用或其他用途的要求。
水的净化方法包括沉淀法、过滤法、杀菌法、吸附法等。
这些方法能够去除水中的悬浮物、有机物、微生物等,保证水的洁净。
3. 水质分析水质分析是对水中的各种物质进行分析,包括水中的无机盐、有机物、微生物等。
第二章大气环境化学本章重点:1 污染物在大气中迁移过程2 光化学烟雾和硫酸型烟雾的形成过程和机理第一节大气中污染物的转移大气层简介一、大气温度层结对流层(troposphere) :(0km-17km)空气具有强烈的对流(垂直),集中了大气中90.9%天气现象,污染物排放直接进入对流层平流层(stratosphere):17-55km气体状态稳定,垂直对流很小,大气透明度高中间层(mesosphere):55-85Km气温下降达-92℃,垂直运动剧烈,发生光化学反应。
热层(thermsphere):800Km空气密度很小,温度升高到1000k,电离层逸散层:>800Km 气体分子受地球引力极小,因而大气质点会不断向星际空间逃逸。
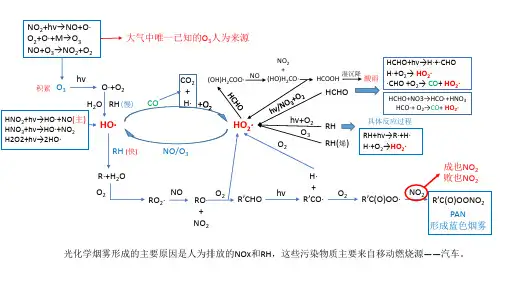
出示大图:图1 大气温度的垂直分布图2 大气密度的垂直分布大气垂直递减率二、辐射逆温层三、绝热过程与干绝热过程四、大气稳定度的判定五、影响大气污染物迁移的因素1、风和大气湍流的影响风—使污染物向下风向扩散湍流—使污染物向各风向扩散浓度梯度—使污染物发生质量扩散2、天气形势和地理地势的影响第二节大气中污染物的转化一、光化学反应基础1、光化学反应过程什么是光化学反应?分子、原子、自由基或离子吸收光子而发生的化学反应称光化学反应,大气光化学反应分为两个过程。
初级过程:A + hνA*次级过程举例:HCl + hνH + ClH + HCl H2 + ClCl + Cl Cl22、量子产率(不做介绍)3、大气中重要吸光物质的光离解(1)氧分子和氮分子的光离解O2 + hνO + ON2 + hνN + N(2)臭氧的光离解O3 + hνO + O2(3)NO2的光离解NO2 + hν N O + O(4)亚硝酸和硝酸的光离解HNO2 + hνHO + NOHNO2 + hνH + NO2HNO3 + hνHO + NO2(5)二氧化硫对光的吸收SO2 + hνSO2*(6)甲醛的光离解H2CO + hνH + HCOH2CO + hνH2 + CO(7)卤代烃的光离解CH3X + hνCH3 + X二、大气中重要自由基的来源自由基由于在其电子壳层的外层有一个不成对的电子,因而有很高的活性,具有强氧化作用。
凡是有自由基生成或由其诱发的反应叫自由基反应。
1、大气中HO和HO2自由基的浓度2、大气中HO和HO2自由基的来源清洁空气中O3 的光离解是大气中HO的主要来源:HO来源一:O3 + hνO + O2O + H2O 2HOHO来源二:HNO2 + hνHO + NOH2O2 + hν2HOHO2的来源:H2CO + hνH + HCOH + O2 + M HO2 + MHCO + O2HO2 + CO3、R、RO和RO2等自由基的来源大气中存在最多的烷基是甲基,主要来源是:CH3CHO + hνCH3 + HCOCH3COCH3 + hνCH3 + CH3CO烷基自由基:RH + O R + HORH + HO R + H2O甲氧基:CH3ONO + hνCH3O + NOCH3ONO2 + hνCH3O + NO2过氧烷基:R + O2RO2三、氮氧化物的转化1、大气中的含氮化合物2、氮氧化合物和空气混合体系中的光化学反应NO2 + hνNO + OO + O2 + M O3 + MO3 + NO NO2 +O23、氮氧化物的气相转化(1)NO 的氧化NO + O3NO2 + O2NO + RO2NO2 + RONO + HO2NO2 + HONO + HO HNO2NO + RO RONO⏹以上反应在光化学烟雾的形成过程中具有重要意义⏹由于OH基自由基引发一系列烷烃的链反应,得到RO2、HO2等,使得NO迅速氧化成NO2,同时O3得到积累,以致成为光化学烟雾的重要产物。
(2) NO 2的转化NO2活泼,是大气主要污染物之一,也是大气中O3的人为来源。
NO2在阳光下与OH•、 O3等反应。
NO 2 + HO HNO 3NO2 + O3 NO3 + O2NO2 + NO3 N2O5这是污染大气中气态HNO3的主要来源,同时也对酸雨和酸雾的形成起重要作用。
气态HNO3在大气中难以光解,湿沉降是其在大气中去除的主要过程。
(3) PAN产生:乙醛光解生成乙酰基乙酰基与空气中的氧结合形成过氧乙酰基,再与NO2 化合生成过氧乙酰基硝酸(PAN )。
CH 3CO + O 2 CH 3COOOCH 3COOO + NO 2 CH 3COOONO 24、 氮氧化物的液相转化(补充内容)NO X 可以溶于大气的水相中,构成液相平衡体系。
NO X 的液相平衡在气-液两相中存在以下平衡此体系平衡时NO2-和NO3-浓度的比值:四、碳氢化合物的转化1、 大气中主要的碳氢化合物甲烷石油烃萜类芳香烃)()()()(22aq NO g NO aq NO g NO ==--+++=3222)(2NO NO H aq NO -++=+2222)()(NO H aq NO aq NO -+--++−→←++++−→←+22223212222)(2)(2NO H O H NO g NO NO NO H O H g NO K K 21223][][K K pNO pNO NO NO =--2、 碳氢化合物在大气中的反应(1) 烷烃的反应RH + HO R + H 2ORH + O R + HO如甲烷的氧化反应:(2) 烯烃的反应A .加成反应B . 氢原子摘除反应C .与O3氧化反应 见p41页反应表示O3添加到烯烃上形成双自由基(二元自由基)它转化为环氧或臭氧化合物。
含有较大分子量的烯烃化合物在大气中参加化学反应时,会产生氧聚合物,当其蒸汽浓度仅为ppb 级时, 会凝聚成滴,形成气凝胶,大气中常存在一些颗粒物,其表面使烯烃的反应加速或预浓缩。
3、 光化学烟雾现象什么是光化学烟雾?大气中碳氢化合物(HC )、氮氧化物(NOX )等一次污染物在阳光照射下,发生光化学反应产生二次污染物,这种由参加反应的一、二次污染物的混合物(包括气体污染物和气溶胶)形成的烟雾污染现象,称为光化学烟雾。
特征:兰色烟雾,强氧化性,具有强刺激性,使大气能见度降低,在白天生成傍晚消失, 高峰在中午。
形成条件:大气中有氮氧化合物和碳氢化合物存在,大气湿度较低,有强阳光照射。
(1) 光化学烟雾的日变化曲线 HOCH O CH O H C H HO CH +→++→+34234(2)烟雾箱模拟曲线4、光化学烟雾形成的简化机制引发反应:NO2 + hνNO + OO + O2 + M O3 + MNO + O3NO2 + O2自由基传递反应:RH + HO RO2 + H2ORCHO + HO RC(O)O2 + H2ORCHO + hνRO2 + HO2 + COHO2 + NO NO2 + HORO2 + NO NO2 + R’CHO + HO2RC(O)O2 + NO NO2 + RO2 +CO2终止反应:HO + NO2HNO3RC(O)O2 + NO2RC(O)O2NO2RC(O)O2NO2 RC(O)O2 + NO2利用上述光化学烟雾形成的简化机制模式可以模拟不同情况下光化学烟雾的状况及各有害成分的变化。
5、光化学烟雾的控制对策(1)控制反应活性高的有机物的排放反应活性顺序:有内双键的烯烃> 二烷基或三烷基芳烃和有外双键的烯烃> 乙烯> 单烷基芳烃> C5以上烷烃> C2-C5大多数有机物与HO 发生反应,其反应速度常数大体上反映了碳氢化合物的反应活性。
(2)控制臭氧的浓度NO X、RH(碳氢化合物,氮氧化合物)的初始浓度大小,影响O3的生成量和生成速度。
五、硫氧化物的转化及硫酸烟雾型污染含硫矿物燃料燃烧过程中直接排入大气中的主要是二氧化硫,煤含硫0.5-0.6%,石油含硫0.5 - 3%。
天然来源主要是火山喷发。
1、二氧化硫的气相氧化(1)SO2的直接光氧化3SO2 + O2SO4SO3 + O或SO2 +SO42SO3(2)SO2被自由基氧化SO2与HO的反应HO + SO2HOSO2HOSO2 + O2HO2 + SO3SO3+ H2O H2SO4与其他自由基反应CH3CHOO + SO2 CH3CHO + SO3HO2 + SO2HO + SO3CH3O2 + SO2CH3O + SO32、二氧化硫的液相氧化3、硫酸烟雾型污染由于煤燃烧而排放出来的SO2、颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的大气污染现象⏹特点:发生在冬季,气温低,湿度高,日光弱。
52年12月伦敦烟雾SO2转化为SO3的氧化反应主要靠雾滴中锰、铁、氨的催化作用而加速,硫酸烟雾型污染属于还原性混合物,称还原性烟雾。
⏹光化学烟雾与伦敦型烟雾的比较(p64,表2-6)六、酸性降水⏹酸性降水是指通过降水将大气中的酸性物质迁移到地面的过程,最常见的就是酸雨,称湿沉降。
⏹我国70年代末期,北京,上海,南京,重庆,贵阳等地均出现过,其中以西南地区最为严重。
1、降水的pH2、降水pH的背景值未被污染的大气中,可溶于水并含量较大的酸性气体是CO2,如果只把CO2作为影响天然水pH的因素,根据CO2(全球大气浓度为330ml/m3)与纯水的平衡,可以计算出降水的pH值。
3、降水的化学组成(1)降水的组成大气中固定气体成分:O2、N2、CO2、H2和惰性气体等。
无机物:土壤衍生矿物;海洋盐类;气体转化物质;人为排放的各种金属等。
有机物:有机酸、醛、烷烃、烯、芳烃等。
光化学反应产物:H2O2、O3、PAN等。
不溶物:土壤颗粒、燃料燃烧尘粒。
(2)降水中的离子成分SO42-、NO3-、Cl-、NH4+、Ca2+、H+4、酸雨的化学组成SO2 + [O] SO3SO3 + H2O H2SO4SO2 + H2O H2SO3HSO3 + [O] H2SO4NO + [O] NO22NO2 + H2O HNO3 + HNO25、影响酸雨形成的因素(1)酸性污染物的排放及其转化条件(2)大气中的氨(3)颗粒物酸度及其缓冲能力(4)天气形势的影响七、大气颗粒物大气颗粒物处于气溶胶体系,即大气中均匀地分散着各种固体或液体微粒,沉降速度极小,常用粉尘、烟、煤烟、沉粒、轻雾、浓雾、烟气等来描述。
大气颗粒物是大气的一个组成部分,参与大气降水过程,大气中有毒物质可以是无机物也可以是有机物,主要分布在气溶胶中看作污染源。
1、 颗粒物的粒度及表面性质大气颗粒物实际上并不是球体,多为不规则的粒子,因此颗粒物的粒径不能仅指其直径,需用有效直径 来表示。
即空气动力学直径(Dp )Dp 表示所研究的粒子有相同终端降落速度的密度为1的球体。