泡利原理 洪特规则
- 格式:ppt
- 大小:1.65 MB
- 文档页数:37


一、基态与激发态原子光谱1.基态与激发态处于最低能量的原子叫做基态原子(ground state atom),基态是原子最基本的状态,是稳定的状态;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子(excited atom);激发态原子不稳定,电子又会跃迁到能量较低的能级,并释放能量;其转化关系如下:光(辐射)是电子释放能量的重要形式之一,在日常生活中,我们看到的许多可见光,如灯光、激光、焰火……都与原子核外电子发生跃迁释放能量有关;2.原子光谱atomic spectrum①原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱;②发射光谱(emission spectrum)是暗色背景的明亮谱线,吸收光谱(absorption spectrum)则是明亮背景的暗色谱线,两者谱线一一对应(因为两个能级之间电子跃迁,吸收的能量和释放的能量相同);※铯cesium,1860年发现,其光谱图中有特征的蓝光,在拉丁语里,铯的含意是天蓝色;※铷rubidium,1861年发现,其光谱图中有特征的红光,在拉丁语里,铷的含意是深红色;※氦helium,1868年分析太阳光谱发现的,来源于希腊文,原意是“太阳”;③原子光谱的应用不同元素产生不同的原子光谱,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析(spectrum analysis),历史上,利用光谱分析也曾发现了许多新元素;二、构造原理与电子排布式1.多电子原子核外电子的排布顺序在多电子原子中,电子在能级上的排布顺序是:电子最先排布在能量低的能级上,然后依次排布在能量较高的能级上;2.构造原理aufbau principle随着原子核电荷数的递增,绝大多数元素原子的核外电子是按照如图所示的能级顺序填充的,填满一个能量低的能级后,再填一个能量高的新能级,这种规律称为构造原理;3.能级交错现象energy level overlap phenomenon由构造原理可知,从第三能层开始各能级不完全遵循能层顺序,产生了能级交错排列,即产生“能级交错”现象;【产生原因:钻穿效应、屏蔽效应】【H原子由于核外只有一个电子,没有屏蔽效应,不存在能级交错,所以能级的能量高低只取决于主量子数;对于3d、4s、4p,显然3d小于4s等于4p】4.电子排布electronic configuration①根据构造原理可表示出一些元素原子的电子排布式,先按能量由低到高的顺序依次写出能级符号,再用数字在能级符号右上角表明各能级上排布的电子数,这就是原子的电子排布式;【在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写,例如钪Sc的电子排布式为:1s22s22p63s23p63d14s2,而不能按照填充顺序先写4s2后写3d1】②电子排布式的简化写法为了避免电子排布式过于繁琐,可以把内层电子达到稀有气体元素原子结构的部分以相应的稀有气体元素符号外加方括号表示,例如:K的电子排布式可表示为:[Ar]4s1,其中[Ar]叫1三、泡利原理、洪特规则、能量最低原理1.电子自旋与泡利原理spin of the electron & Pauli exclusion principle①电子自旋spin of the electron量子力学告诉我们,电子除了空间运动状态外,还有一种状态叫做自旋;电子自旋可比喻成地球的自转;电子的自旋有顺时针和逆时针两种相反的状态,常用上下箭头“↑”“↓”表示;【电子自旋(spin of the electron)是电子的基本性质之一,属于量子物理学科,电子自旋先由实验上发现,然后才由狄拉克(Dirac)方程从理论上导出的】【自旋量子数(spin quantum number)是描述电子自旋运动的量子数,自旋磁量子数用m s表示,即↑代表正方向自旋电子,↓代表逆方向自旋电子】②泡利原理Pauli exclusion principle1925年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子(通常称为电子对),而且它们的自旋状态相反,称为泡利原理(也称泡利不相容原理);Pauli,1900--1958 Dirac,1902--1984 Hund,1896--19972.电子排布图原子核外电子排布可利用电子排布图来表示,这是用方框(或圆圈)和箭头表明核外电子排布的另一种方法,也叫轨道表示式;每一个方框表示一个轨道,能量相同的轨道连在一起,与电子排布式相比,它具有轨道上自旋方向和成键时电子变化明晰的特点,但是稍微麻烦些,书写时先写元素符号,再根据能量最低原理、泡利原理、洪特规则等书写,例如:3.洪特规则Hund rule基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,称为洪特规则;洪特规则不仅适用于基态原子,也适用于基态离子;【洪特规则特例】在等价轨道(同一能级)上的电子排布为全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,具有较低的能量和较大的稳定性,可以理解为洪特规则特例;例如:铬(24Cr):[Ar]3d54s1正确,[Ar]3d44s2错误;铜(29Cu):[Ar]3d104s1正确,[Ar]3d94s2错误;4.能量最低原理lowest energy principle①基态是能量最低的状态,基态原子的电子排布式能量最低的原子轨道组合;②在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理lowest energy principle;③多电子原子的核外电子要先占据能量低的能层,在能量低的能层中又优先占据能量低的能级,然后再依次进入能量较高的能层,这样使整个原子处于最低的能量状态,原子轨道能量的高低依据构造原理来判断;5.补充:26Fe:1s2 2s2sp6 3s23p63d6 4s2①电子的运动状态=电子数;(26)②电子的空间运动状态=电子所占的轨道数;(15)③电子的运动范围=能层数;(4)④电子的能量=能级数;(7)。

泡利不相容原理洪特规则能量最低原理教学反思泡利不相容原理、洪特规则和能量最低原理是原子结构和量子力学中的基本原理,对于理解原子和分子的性质非常重要。
以下是对这三个原理的教学反思:1. 泡利不相容原理:这个原理表明,在任何一个量子力学系统中,不可能有两个或更多的粒子处于完全相同的量子态。
理解这个原理的关键是让学生明白量子态是什么以及为什么粒子不能处于相同的量子态。
可以通过对比经典物理中的状态和量子力学中的状态来帮助学生理解这个概念。
此外,可以引导学生思考这个原理与日常生活中现象的联系,例如为什么气球会粘在墙上或者为什么电视机屏幕是光滑的。
2. 洪特规则:这个规则表明,在任何一个量子力学系统中,当粒子处于同一能级时,它们的自旋方向必然是相反的。
理解这个规则的关键是让学生明白自旋是什么以及为什么粒子必须具有相反的自旋方向。
可以通过对比经典物理中的角动量和量子力学中的自旋来帮助学生理解这个概念。
此外,可以引导学生思考这个规则与日常生活中现象的联系,例如为什么磁铁可以吸附铁钉或者为什么电动机可以转动。
3. 能量最低原理:这个原理表明,在任何一个自洽的量子力学系统中,系统的能量必须处于最低可能的状态。
理解这个原理的关键是让学生明白能量是什么以及为什么系统的能量必须处于最低状态。
可以通过对比经典物理中的势能和量子力学中的能量来帮助学生理解这个概念。
此外,可以引导学生思考这个原理与日常生活中现象的联系,例如为什么水会往低处流或者为什么物体会从高处掉落到低处。
通过以上反思,可以更好地帮助学生理解泡利不相容原理、洪特规则和能量最低原理这些重要的物理概念,并能够将它们应用到实际生活中。
同时,教师也可以根据学生的反馈和表现,不断改进教学方法和手段,提高教学效果和学生的学习效果。

基态原子的电子排布的三个基本原则
1.能量最低原理
原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s→2s→2p→3s→3p→4s→3d→4p”这一顺序)。
2.泡利原理
(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这一原理被称为泡利原理。
(2)因为每个原子轨道最多只能容纳 2个电子且自旋方向相反,所以从能层、能级、原子轨道、自旋方向四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。
如氟原子的电子排布可表示为1s22s22p2p2p,由于各原子轨道中的电子自旋方向相反,所以9个电子的运动状态互不相同。
3.洪特规则
(1)在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,这就是洪特规则。
(2)通俗地说,洪特规则可以表述为电子总是尽量自旋
平行地分占不同的轨道。
如碳原子的电子排布图是,而不是。
(3)洪特规则的特例
在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较大的稳定性。

泡利原理与洪特规则泡利原理(Pauli exclusion principle)和洪特规则(Hund's rule)是两个量子力学中的重要原理,它们描述了原子中电子分布的规律。
泡利原理是由奥地利物理学家波尔玛·泡利(Wolfgang Pauli)于1925年提出的。
该原理阐述了两个或多个电子不能在完全相同的量子状态下存在。
更具体地说,泡利原理可以总结为以下两个要点:1.单个电子的量子态由四个量子数(n,l,m,s)确定,但不同电子的任意两个量子数不能完全相同。
其中,n表示主量子数,l表示角量子数,m表示磁量子数,s表示自旋量子数。
2.根据泡利原理,每个量子态最多能容纳两个电子,它们的自旋方向相反。
即电子自旋可以为+1/2或-1/2洪特规则是由德国物理学家弗里德里希·奥古斯特·洪特(Friedrich Hund)于1927年提出的。
该规则解释了电子在原子中的分布方式,主要包括以下要点:1.在填充电子态时,应首先填充能量最低的电子态。
这是因为高能量态的电子更加不稳定,倾向于填满能量较低的态。
2.如果有多个具有相同能量的电子状态(也称为简并态)可供填充,那么应该确保电子尽可能地分布在不同的态上,且自旋方向相同。
这是为了最小化原子的总能量,从而确保更稳定的电子配置。
3.只有当一个状态已经填满时,才能开始填充下一个具有相同能量的电子状态。
事实上,洪特规则和泡利原理共同确定了电子在原子中的轨道填充顺序和自旋排布。
例如,按照洪特规则,当填充能量最低级别的s轨道时,电子会尽可能地均匀地占据不同的状态,并使它们的自旋方向相同。
这一规则可以解释为什么自旋相同的电子会在同一个原子轨道上存在,而不是全部分布在一个轨道上。
总之,泡利原理和洪特规则是描述电子在原子中分布的重要原理。
它们不仅有助于我们理解原子的电子结构,还为解释和预测原子间化学反应的机理提供了基础。

泡利原理和洪特规则
泡利原理和洪特规则是两个物理学中的重要原理,它们分别用于描述原子和分子间的行为。
泡利原理,即泡利不相容原理,是描述原子中电子的排布原则。
根据泡利原理,一个原子中的电子是不能全部处于相同的量子态的。
简单来说,一个原子中的每个电子都要占据不同的电子轨道和自旋态。
洪特规则,又称为洪特近似规则,是描述多电子原子的电子排布规则。
洪特规则是在考虑到库伦排斥力和自旋相互作用的情况下,确定多电子原子各个电子轨道占据的顺序。
根据洪特规则,多电子原子中的电子会首先填充能量最低的轨道,然后按一定顺序填充其他轨道,直到填满所有的电子。
泡利原理和洪特规则在确定电子排布时起到了重要的作用。
它们的目的都是确保电子的排布稳定和最低能量状态。
需要注意的是,泡利原理和洪特规则并不是标题相同的文字。
标题通常是指文章或段落的主题或概括,而泡利原理和洪特规则是物理学中的科学概念和理论,采用不同的术语和表述。
在文章中使用适当的段落来描述这两个原理,并避免使用有标题相同的文字来重复表述。



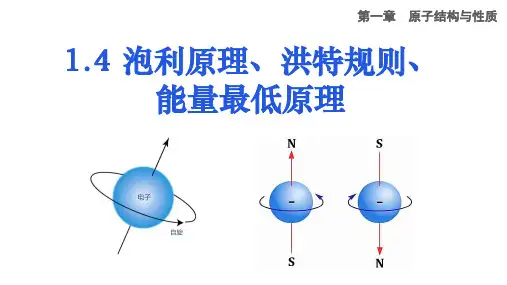
泡利原理、洪特规则、能量最低原理1 电子自旋与泡利原理温故核外电子围绕原子核做高速运动,根据电子能量高低及运动区域的不同,将电子在核外空间的运动状态分别用能层、能级及原子轨道来描述。
(1)电子自旋核外电子除绕核高速运动外,还像地球一样绕自己的轴自旋。
电子自旋在空间有两种相反的取向——顺时针方向和逆时针方向,分别用“↑”和“↓”表示。
名师提醒(1)自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
(2)能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态,电子能量与能层、能级有关,电子运动的空间范围与原子轨道有关。
(3)一个原子中不可能存在运动状态完全相同的2个电子。
(2)泡利原理(又称泡利不相容原理)在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理。
如He:1s2,1s轨道里的2个电子自旋相反,即一个电子顺时针运动,而另一个电子逆时针运动。
2 电子排布的轨道表示式轨道表示式(又称电子排布图)是表述电子排布的一种图式,如氢和氧的基态原子的轨道表示式:。
名师提醒(1)在轨道表示式中,用方框(也可用圆圈)表示原子轨道,1个方框代表1个原子轨道,通常在方框的下方或上方标记能级符号。
(2)不同能层及能级的原子轨道的方框必须分开表示,同一能层相同能级(能量相同)的原子轨道(简并轨道)的方框相连书写。
(3)箭头表示一种自旋状态的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子);箭头同向的单电子称自旋平行,如基态氧原子有2个自旋平行的2p电子。
(4)轨道表示式的排列顺序与电子排布式顺序一致,即按能层顺序排列。
有时画出的能级上下错落,以表达能量高低不同。
(5)轨道表示式中能级符号右上方不能标记电子数。
以Si原子为例,说明轨道表示式中各部分的含义:3 洪特规则基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,这一规则是洪特根据原子光谱得出的经验规则,称为洪特规则。

第3课时泡利原理、洪特规则、能量最低原理学习目标1. 知道原子核外电子排布的“两原理一规则”。
2. 会正确书写原子的电子排布式和电子排布图。
知识梳理一、泡利原理、洪特规则和能量最低原理1.泡利原理在一个原子轨道里,最多只能容纳个电子,而且它们的自定状态(用“↑↓”表示),这个原理称为泡利原理。
电子自旋可以比喻成地球的自转,自旋只有两种方向:方向和方向。
2.电子排布图叫做电子排布图。
如锂的电子排布图:3.洪特规则。
这个规则是由洪特首先提出的,称为洪特规则。
注意:等价轨道处于、或的状态一般比较稳定,也就是说,具有下列电子层结构的原子是比较稳定的。
:p6、d10、f14,:p3、d5、f7,:p0、d0、f0。
因此,铬和铜的基态原子的电子排布图如下:总之,基态原子的电子排布遵循能量最低原理、泡利原理和洪特规则。
用构造原理得到的电子排布给出了基态原子核外电子在能层和能级中的排布,而电子排布图还给出了电子在原子轨道中的排布。
4.能量最低原理原子的电子排布遵循原理能使整个原子的能量处于状态。
即在原子里,电子优先排布在能量的能级里,然后排布在能量逐渐的能级里。
二、描述核外电子排布的化学用语1.电子排布式(1)定义:用核外电子分布的及来表示电子排布的式子。
如1s22s22p4、1s22s22p63s23p1、1s22s22p63s23p64s2、1s22s22p63s23p63d64s2分别是O、Al、Ca、Fe 原子的电子排布式。
(2)以铝原子为例,电子排布式中各符号、数字的意义为:(3)简化的电子排布式电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式。
以稀有气体的元素符号外加方括号表示的部分称为“原子实”。
如钙的电子排布式为1s22s22p63s23p64s2,其简化的电子排布式可以表示为。
(4)外围电子排布式在原子的核外电子排布式中,省去“原子实”后剩下的部分称为外围电子排布式,也叫价电子排布。
《泡利原理、洪特规则、能量最低原理》教学设计一、课标解读“泡利原理、洪特规则、能量最低原理”是《普通高中化学课程标准(版修订)》中模块2物质结构与性质的主题1原子结构与元素的性质中的内容。
1.内容要求认识基态原子中核外电子的排布遵循能量最低原理、泡利原理、洪特规则。
知道1~36号元素基态原子核外电子的排布。
2.学业要求能结合能量最低原理、泡利原理、洪特规则书写1~36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。
二、教材分析本节内容的功能价值是提高学生的宏观辨识与微观探析、证据推理与模型认知素养,以原子光谱学事实与依据,理解原子核外电子排布的规律和规则的提出背景,并以此为模型,学会利用轨道表示式表示基态原子核外电子的排布。
本课时是人教版选择性必修2第一章第一节《原子结构》第4课时内容,是在学习了能层和能级及电子排布式、价电子排布式、电子云等等概念的基础上,更加深入、直观地走进物质的微观世界—原子轨道,并进一步探索核外电子运动的特点和规律。
因此,本课时内容是核外电子排布规律的延续,虽内容仍然有些抽象,学生学起来有困难,但教科书在内容编排上注重了由易到难层层深入,形式上图文并茂帮助其理解,这样能够激发和保持学生的学习兴趣。
同时。
课标要求是“认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等”,起点高,落点低。
三、学情分析学生具备接受能力较强、好奇心强、探究的意识强等特点,在该阶段学生对原子结构以及核外电子排布等已有一定的理解,为这节课的学习也奠定了一定的基础。
但对核外电子的运动规律以及原子轨道非常陌生,因此本课时教学的重点是如何让学生利用已有的探究必备相关知识,如原子的组成,物质的远动是有规律的等,将泡利原理和洪特规则熟练地运用于原子轨道的理解中。
四、素养目标【教学目标】1.通过对“电子自旋”概念的认识,理解基态原子中核外电子排布规律的泡利不相容原理;2.能利用轨道表示式书写1~36号元素基态原子的核外电子排布的轨道表示式,并通过书写逐步认识洪特规则及其特例;3.能结合能量最低原理理解基态原子核外电子排布的构造原理、洪特规则及其特例等其它具有特殊价电子排布的现象。