混凝澄清法word版本
- 格式:pdf
- 大小:331.58 KB
- 文档页数:8

混凝澄清法目录简介概述基本原理工艺主要作用工艺的特点工艺影响因素简介概述基本原理工艺主要作用工艺的特点工艺影响因素展开编辑本段简介混凝澄清在给水和废水处理中的应用非常广泛,它既可以降低原水的浊度、色度等水质的感观指标,又可以去除多种有毒有害污染物。
废水处理的混凝剂有无机金属盐类和有机高分子聚合物两大类,前者主要有混凝澄清池铁系和铝系等高价金属盐,可分为普通铁、铝盐和碱化聚合盐;后者则分为人工合成的和天然的两类。
混凝澄清法的主要设备有完成混凝剂与原水混合反应过程的混合槽和反应池,以及完成水与絮凝体分离的沉降池等。
编辑本段概述混凝澄清是对废水处理中用于除去悬浮物质和胶体的分离技术,一般用于预处理和一级处理。
圆形混凝澄清池结构图1混凝就是在废水中预先投加化学药剂(混凝剂)来破坏胶体的稳定性,使废水中的胶体和细小悬浮物聚集成具有可分离性的絮凝体;澄清则是对絮凝体进行沉降分离,加以去除的过程。
常与生化法连用。
促使混凝剂迅速向水中扩散,并与全部水混合均匀的过程称为混合。
胶粒与混凝剂作用,通过压缩双电层圆形混凝澄清池结构图2和电中和等机理,失去或降低稳定性,生成微粒或微絮粒的过程称位凝聚。
凝聚生成的微粒或微絮粒在架桥物质和水流搅动下,通过吸附架桥和沉淀网捕等机理成长为大絮体的过程称为絮凝。
混合、凝聚和絮凝合起来称为混凝。
凝聚和絮凝在反应池中完成。
编辑本段基本原理1.压缩双电层2.吸附架桥3.网布卷扫4.电中和编辑本段工艺主要作用①有效地去除原水中的悬浮物和胶体物质,粒度:1nm~100µm絮凝剂②有效地去除水中微生物、病原菌和病毒;③去除污水中的乳化油、色度、重金属离子及其他一些污染物;④可去除污水中90~95﹪的磷,是最便宜和高效的除磷方法⑤投加混凝剂可改善水质,有利于后续处理。
如用石灰作混凝剂,同时提高了污水的pH值,有利于吹脱除氮;⑥二级处理出水经混凝沉淀处理后,可获得以下水质:SS≤7mg/L; BOD5≤10 mg/L; NH3-N≤15~30 mg/L; TP-P≤0.5 mg/L编辑本段工艺的特点优点处理效果好、生产效率高、药剂用量节约、占地面积少。

■%■■§ 1微涡流混凝给水处理技术§2过滤技术§ 1微涡流混凝给水处理技术在给水净化的混凝、沉淀、过滤诸工艺中,混凝是其中的关键。
天然水体中的分散相大部分由无机胶粒组成,如: 黏土、金属氧化物、金属氢氧化物和金属碳酸盐,还有来自腐殖质的有机胶体物质以及有生命的微生物(藻类或细菌)。
絮凝效果的好坏,直接决定着后续单元过程的运行工况、处理费用及最终出水水质。
设计时混凝工艺选定的合理,不仅可提高出水水质,还能达到节能节约降低运行费用的目的。
因此搞清絮凝动力致因是提高絮凝效率的关键4§ 1微涡流混凝给水处理技术一、絮凝的动力学过程二、絮凝动力机理三、絮凝的动力学致因紊流涡旋在混凝处理中的作用五、微涡流混凝工艺特点六、湍流凝聚接触絮凝沉淀给水处理技术•、絮凝的动力学过程要使颗粒产生絮凝需要有两个基本前提,颗粒间的接触(即碰撞)以及接触后的聚集。
两个保持一定距离作相对运动的颗粒,如无其他力的作用是无法接触的,因为它们之间将始终维持原来的间距。
当然,颗粒的接触并不等于聚集,如果颗粒不具备彼此结合的能力,接触后的颗粒仍然处于分散状态,它取决于混凝剂的性质。
总之使颗粒产生絮凝的首要条件是接触碰撞,而颗粒在水中的接触碰撞,主要有三种途径:(1) 颗粒的布朗运动;(2) 颗粒间的沉速差异;(3) 流动水体的水力作用。
由布朗运动所造成的颗粒碰撞速率与水温成正比, 与颗粒浓度平方成正比,而与颗粒尺度无关,实际上 只有小颗粒才有布朗运动,随着颗粒粒径增大,布朗运动将逐渐减弱,当颗粒粒径大于1pm 时,布朗运动 基本消失。
至毫米级以上,因此由布朗运动产生的颗粒接触碰撞 可忽略不计。
因沉速差异而造成的颗粒接触碰撞,在沉淀池中 有一定的作用,然而在反应池中,由于水流的强烈紊絮体颗粒一般从微米级增动,相对来说沉速差异的作用将是微小的。
特别是在絮凝的初始阶段,颗粒细小,本身的沉速就不大,不同颗粒间的沉速差异也就更小,因此对于因沉速差异而产生的接触,在反应池中一般可以忽略不计。

沉淀、澄清及污泥浓缩的技术和方法作为环保工程师必须掌握沉淀、澄清及污泥浓缩的技术和方法,下面是为大家带来的关于沉淀、澄清及浓缩的知识,欢送阅读。
⑴沉淀原理:利用某些悬浮颗粒的密度大于水的特性,将其从水中去除。
⑵沉淀分类①自由沉淀②絮凝沉淀③拥挤沉淀④压缩沉淀在城市污水处理流程中,在沉砂池中砂粒的沉淀一般为自由沉淀,活性污泥在二沉池中为絮凝沉淀,二沉池下部污泥的沉淀为拥挤沉淀,活性污泥在污泥浓缩池中的浓缩过程为压缩沉淀⑶沉淀颗粒的沉速低流速的离散性颗粒,在水中受到重力、浮力和水的阻力三个力的作用,其合力决定颗粒在水中的加速度和沉速。
⑷沉淀试验①自由沉淀试验②絮凝沉淀(干扰沉淀)试验③拥挤沉淀试验⑴沉淀池的分类按池内水流方向的不同,可以分为平流式沉淀池、辐流式沉淀池和竖流式沉淀池按在工艺流程中位置不同,可分为初沉池和二沉池按截除颗粒沉降距离不同,可分为一般沉淀池和浅层沉淀池⑵平流式沉淀池:①构造:进水区、出水区、沉淀区、缓冲层、污泥区及排泥装置②平流式沉淀池的工作原理掌握沉淀池的设计计算:根据静置沉淀试验所求得的沉速和外表负荷等数据来计算。
(P41~P42的公式)掌握污泥区的计算公式缓冲水层(位于污泥区和澄清区之间)的深度可取0.3~0.5m沉淀池的个数宜在2个以上。
③掌握平流式沉淀池的进出水装置和排泥斗形式以及平流式沉淀池的设计技术参数的选择(见第三章内容)④平流沉淀池的优缺点⑶辐流式沉淀池可作为初沉池或二沉池①构造②优缺点③设计要求和参数选择(掌握设计参数)⑷竖流式沉淀池掌握设计要求和参数选择:例如设计中心管流速不大于30mm/s 等⑸斜板(管)沉淀池①分类:侧向流、同向流、异向流斜板(管)沉淀池②掌握设计要求和参数的选择③掌握其应用条件:例如其不宜作为二沉池使用,主要原因是活性污泥的黏度大,易因污泥的黏附而影响沉淀效果。
⑴原理是利用高浓度的活性泥渣层的接触絮凝作用,将水中杂质阻留,使水得到澄清。

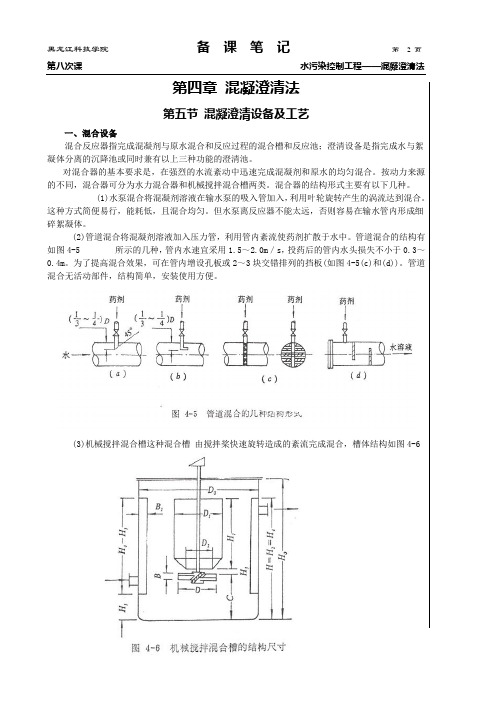
第四章混凝澄清法第五节混凝澄清设备及工艺一、混合设备混合反应器指完成混凝剂与原水混合和反应过程的混合槽和反应池;澄清设备是指完成水与絮凝体分离的沉降池或同时兼有以上三种功能的澄清池。
对混合器的基本要求是,在强烈的水流紊动中迅速完成混凝剂和原水的均匀混合。
按动力来源的不同,混合器可分为水力混合器和机械搅拌混合槽两类。
混合器的结构形式主要有以下几种。
(1)水泵混合将混凝剂溶液在输水泵的吸入管加入,利用叶轮旋转产生的涡流达到混合。
这种方式简便易行,能耗低,且混合均匀。
但水泵离反应器不能太远,否则容易在输水管内形成细碎絮凝体。
(2)管道混合将混凝剂溶液加入压力管,利用管内紊流使药剂扩散于水中。
管道混合的结构有如图4-5 所示的几种,管内水速宜采用1.5~2.0m/s,投药后的管内水头损失不小于0.3~0.4m。
为了提高混合效果,可在管内增设孔板或2~3块交错排列的挡板(如图4-5(c)和(d))。
管道混合无活动部件,结构简单,安装使用方便。
(3)机械搅拌混合槽这种混合槽由搅拌桨快速旋转造成的紊流完成混合,槽体结构如图4-6槽体与搅拌桨的比例尺寸如表4-2。
为了提高混合效果,槽内宜设壁挡板。
当混合与反应在同一槽内完成时,为了控制物料流向和一定的回流比,还应增设导流筒。
壁挡板和导流筒的比例尺寸如表4-3。
槽体有效容积按水力停留时间为10~30s计算,有时还乘以l.2的放大系数。
桨叶外缘线速度,若为桨式取1.5~3.0m/s,推进式取5~15m/s。
机械传动功率的计算可查有关设计手册。
二、反应设备混凝反应设备也有机械搅拌和水力搅拌两类。
机械搅拌反应池多为长方形,用隔板分为数格,每格装一搅拌叶轮,叶轮半径中点线速由第一格的0.5~ 0.6m / s 依次递减到最后一格的0.1~ 0.2m / s 15~2075%有效池容按水力停留时间为15~30min计算;池体分2~4格,每格长宽比为1.0~1.2,留有0.4m的超高。

实验报告实验项目名称:混凝沉淀实验(所属课程:水污染控制工程)院系:专业班级:姓名:学号:实验日期:实验地点:合作者:指导教师:本实验项目成绩:教师签字:日期:一、实验目的(1)观察混凝现象及过程,了解混凝的净水机理及影响混凝的重要因素。
(2)确认某水样的最佳投药量及其相应的pH值。
(3)测定计算反应过程的G值和GT值,是否在适宜的范围内。
二、实验原理水中的胶体颗粒,主要是带负电的黏土颗粒。
胶体间的静电斥力,胶粒的布朗运动及胶粒表面的水化作用,使得胶粒具有分散稳定性,三者中以静电斥力影响最大。
因此,胶体颗粒靠自然沉淀是不能除去的。
向水中投加混凝剂能提供大量的正离子,压缩胶团的扩散层,使ξ电位降低,静电斥力减小。
此时,布朗运动由稳定因素转变为不稳定因素,也有利于胶粒的吸附凝聚、水化胶中的水分子与胶粒有固定联系,具有弹性和较高的黏度,把这些分子排挤除去需要克服特殊的阻力,阻碍胶粒直接接触。
有些水化膜的存在决定于双电层状态,投加混凝剂降低ξ电位,有可能是水化作用减弱,混凝剂水解后形成的高分子物质或直接加入水中的高分子物质一般具有链状结构,在胶粒与胶粒间起吸附架桥作用。
即使ξ电位没有降低或减低不多,胶粒不能相互接触,通过高分子连状物媳妇叫李,也能形成絮凝体。
投加了混凝剂的水中,胶体颗粒脱稳后相互聚结,逐渐变成大的絮凝体。
这时,水流速度梯度G值的大小起着主要的作用,具体计算见有关教材。
三、实验设备与试剂(1)无极调速六联搅拌机1台。
(4)秒表1块。
(5)1000mL量筒1个。
(6)1mL,2mL,5ml,10mL移液管各1支。
(7)200mL烧杯1个,吸耳球等。
(8)1000mL烧杯6个。
页共页第实验报告(9)10%Al(SO)溶液500mL。
342(10)实验用原水(配制)。
(11)注射针筒。
(12)10%的NaOH溶液和10%HCl溶液500mL各一瓶。
四、实验步骤(2)1000mL量筒量取6份水样至6个1000mL烧杯中,另量取200mL水样放在200mL的烧杯中。
混凝沉淀实验一、实验目的1、要求认识几种混凝剂,掌握其配制方法;2、观察混凝现象,从而加深对混凝理论的理解。
二、实验原理水中粒径小的悬浮物以及胶体物质,由于微粒的布朗运动,胶体颗粒间的静电斥力和胶体表面的水化作用,致使水中这种含浊状态稳定。
向水中投加混凝剂后,由于如下原因:①能降低颗粒间的排斥能峰,降低胶粒的δ电位,实现胶粒“脱稳”;②发生高聚物式高分子混凝剂的吸附架桥作用;③网捕作用,从而达到颗粒的凝聚。
三、实验设备及药品按每4人一组配置数量如下:1、设备⑴ 1000mL量筒,2个;⑵ 1000mL烧杯,6个;⑶ 100mL烧杯,2个;⑷ l0mL移液管,2个;⑸ 2mL移液管,1个;⑹医用针筒,1个;⑺洗耳球,1个;⑻2100P浊度仪,1台;⑼ ZR4-6混凝搅拌器,1台;⑽ pH计,1台。
⑾温度计,1根。
2、药品⑴Al2(SO4)3⑵FeCl3四、实验方法1、方法一混凝搅拌器变速混凝实验实验步骤如下:(1)认真了解ZR4--6型混凝搅拌器的使用方法。
(2)用1000ml量筒取6个水样至6个1000mL烧杯中.注意:所取水样要搅拌均匀,要一次量取,以尽量减少取样浓度上的误差。
(3)按10、20、30、40、50、60、70、80mg/L的量将 Al2(SO4)3或FeCl3依次加入各水样中。
(4)将第一组水样置于ZR4——6型混凝搅拌器下.(搅拌时间和程序已按说明书预先设定好)与此同时,按计算好的投药量,用移液管分别移取不同体积的混凝剂逐个加到加药试管中.(5)开动机器,在搅拌器第一次自动加药后,用蒸馏水冲洗加药试管2次。
(6)搅拌器以500r/min的速度搅拌30s,150r/min的速度搅拌5min,80r/min的速度搅拌10min。
(7)搅拌过程中,注意观察并记录“矾花”形成的过程,“矾花”形成的快慢、外观、大小、密实程度、下沉快慢等。
(8)搅拌过程完成后,搅拌器自动停机,水样静沉15min,继续观察并记录“矾花”沉淀的过程,记入表1—1—2内。
第四节沉淀的基本理论一、分类根据悬浮物质的性质、浓度及絮凝性能,范围:1.自由沉淀:悬浮物质浓度不高,在沉淀过程中颗粒之间互不碰撞,呈离散状态,各自独立地完成沉淀过程。
颗粒形状、尺寸、质量不变。
如沉砂池中砂粒、浓度低的污水在初沉池。
2.絮凝沉淀(干扰沉淀):悬浮物浓度在50~500mg/l,颗粒间可能互相碰撞产生絮凝作用,使粒径与质量加大,沉速不断加快。
如活性污泥在二沉池。
3.拥挤沉淀(分层沉淀):浓度>500mg/l,沉淀中相邻颗粒互相妨碍、干扰,沉速大的颗粒无法超越沉速小的颗粒,各自保持相对位置不变,并在聚合力的作用下,颗粒群结合成一个整体向下沉淀,清水与浑水间形成明显的交界面,沉淀显示为界面下沉。
如二沉池下部的沉淀过程及浓缩池开始阶段。
4.压缩沉淀:浓度大。
颗粒间互相支承,上层颗粒在重力作用下,挤出下层颗粒的间隙水,使污泥得到浓缩。
如活性污泥在二沉池的污泥斗中及浓缩池中的浓缩过程。
活性污泥在二沉池中沉淀实际是依次进行,只是各类沉淀出现时间不同。
二、各种沉淀类型分析(一)自由沉淀低浓度离散性颗粒在水中沉淀,开始时加速下沉,水流阻力不断增加,短暂时间后达到与重力平衡,颗粒开始匀速下沉。
1.公式根据牛顿第二定律,得出d y C g u yg D ρρρ-=34 粒径有关阻力系数,与液体密度颗粒密度----d C D y g Re ρρ 下面表示沉速公式及适用条件2.应用(1)已知d ,推求u=?(2)已知u ,反推d=?3.结论4.沉淀规律(去除率)(二)絮凝沉淀(三)拥挤沉淀1.外观现象和沉淀过程分析基本特征:水沉降过程中出现清浑交界面,整个过程就是界面下沉过程2.界面沉降的重要特性-相似性3.肯奇沉淀理论及应用(压缩沉降的计算)(四)压缩沉淀三、理想沉淀池(一)工作过程分析1.什么是理想沉淀池?符合三个假定:(1)颗粒处于自由沉淀状态。
(2)水流沿水平方向作等速流动。
(3)颗粒沉到池底即认为被去除,不再返回水流中。
第四章混凝澄清法第一节概述混凝澄清法,是指在混凝剂的作用下,使废水中的胶体和细微悬浮物凝聚为絮凝体,然后予以分离除去的水处理法。
胶体粒子和细微悬浮物的粒径分别为1~l00nm和100~l0000nm。
由于布朗运动、水合作用,尤其是微粒间的静电斥力等原因,胶体和细微悬浮物能在水中长期保持悬浮状态,静置而不沉。
因此,胶体和细微悬浮物不能直接用重力沉降法分离,而必须首先投加混凝剂来破坏它们的稳定性,使其相互聚集为数百微米以至数毫米的絮凝体,才能用沉降、过滤和气浮等常规因液分离法予以去除。
混凝就是在混凝剂的离解和水解产物作用下,使水中的胶体沼染物和细微悬浮物脱稳并聚集为具有可分离性的絮凝体的过程,其中包括凝聚和絮凝两个过程,统称为混凝。
混凝澄清法,是给水和废水处理中应用得非常广泛的方法。
它既可以降低原水的沏度、色度等感观指标,又可以去除多种有毒有害污染物;既可以自成独立的处理系统,又可以与其它单元过程组合,作为预处理、中间处理和最终处理过程,还经常用于污泥脱水前的浓缩过程。
第二节胶体结构及其脱稳凝聚机理一、腔体结构及其电位图4-l是胶体粒子的双电层结构及其电位分布示意图。
粒子的中心,是由数百以至数千个分教相固体物质分子组成的胶核。
在胶核表面,有一层带同号电荷的离子,称为电位离子层。
电位离子层构成了双电层的内层。
电位离子所带的电荷称为胶体粒子的表面电荷,其电性正负和数量多少决定了双电层总电位的符号和大小。
胶体粒子就整体而言是呈电中性的。
为了平衡电位离子所带的表面电荷,液相一侧必然存在众多电荷数与表面电荷相等而电性与电位离子相反的离子,称为反离子。
反离子层构成了双电层的外层,其中紧靠电位离子的反离子被电位离子牢固吸引着,并随胶核一起运动,称为反离子吸附层。
吸附层的厚度一般为几纳米,它和电位离子层一起构成胶体粒子的固定层。
固定层外围的反离子由于受电位离子的引力较弱,受热运动和水合作用的影响较大,因而不随胶核一起运动,并趋于向溶液主体扩散,称为反离子扩散层。
扩散层中,反离子浓度呈内浓外稀的递减分布,直至与溶液中的平均浓度相等。
固定层与扩散层之间的交界面称为滑动面。
当胶核与溶液发生相对运动时,肢体粒子就沿滑动面一分为二,滑动面以内的部分是一个作整体运动的动力单元,称为胶粒。
由于其中的反离子所带电荷数少于表面电荷总数,所以胶粒总是带有剩余电荷。
剩余电荷的电性与电位离子的电性相同,其数量等于表面电荷总数与吸附层反离子所带电荷之差。
胶粒和扩散层一起构成电中性的胶体粒子(即胶团)。
胶核表面电荷的存在,使胶核与溶液主体之间产生电位,称为总电位或ψ电位。
胶粒表面剩余电荷,使滑动面与溶液主体之间也产生电位,称为电动电位或ζ电位。
图4-1中的曲线AC和BC 段分别表示出ψ电位和ζ电位随与胶核距离的不同而变化的情况。
ψ电位和ζ电位的区别是:对于特定的胶体,ψ电位是固定不变的,而ζ电位则随温度、pH值及溶液中的反离子强度等外部条件而变化,是表征胶体稳定性强弱和研究胶体凝聚条件的重要参数。
根据电学的基本定律,可导出ζ电位(SV)的表达式为:(4-1)式中 q--胶体粒子的电动电荷密度,即胶粒表面与溶液主体间的电荷差(SC);δ--扩散层厚度,cm;ε--水的介电常数,其值随水温升高而减小。
可见,在电荷密度和水温一定时,ζ电位取决于扩散层厚度δ,δ值愈大,ζ电位也愈高,胶粒间的静电斥力就愈大,胶体的稳定性愈强。
二、胶体的脱稳和凝聚胶体因ζ电位降低或消除,从而失去稳定性的过程称为脱稳。
脱稳的胶粒相互聚集为微絮粒的过程称为凝聚。
不同的化学药剂能使胶体以不同的方式脱稳和凝聚。
按机理,脱稳和凝聚可分为压缩双电层、电性中和、吸附桥连和网罗卷带4种。
(一) 压缩双电层压缩双电层是指在胶体分散系中投加能产生高价反离子的活性电解质,通过增大溶液中的反离子强度来减小扩散层厚度,从而使ζ电位降低的过程。
谈过程的实质是新增的反离子与扩散层内原有反离子之间的静电斥力把原有反离子程度不同地挤压到吸附层中,从而使扩散层减簿。
如果从胶粒间相互作用势能的角度进行分析,那末在胶粒间存在静电斥力的同时,总是存在着范德华引力,两种力的作用强度可分别用排斥势能和吸引势能来表述。
肢体的视在稳定性就取决于上述两种势能中何者占主导地位。
理论分析说明,排斥势能和吸引势能都随与胶粒中心距的缩小而增大,不同的是吸引势能的变化幅度要比排斥势能陡峭,而且与溶液中的反离子强度无关,而排斥势能则与反商子强度紧密相关。
因此,对一种特定胶体只有一种吸引势能曲线,但随反离子强度的不网而布多种排斥势能曲线。
将排斥势能WR和吸引势能W A叠加,可得作用于粒子上的总势能W。
胶粒间作用势能与中心眨的关系可用图4-2 所示的势能曲线表述。
图中,W R(1)表示低反离子强度下的高排斥势能曲线,W R(2)为高反离子强度下的低排斥势能曲线。
如果对W R和W A进行几何叠加,可绘出相应的综合势能曲线 W(1)=W R(1)+W A和W(2)=W R(2)+W A。
由图可见,在d=(1~4)δ范围内,W(1)曲线位于横轴上方,并在d=d1处出现一个极大值Wmax;随着d值的增大,W(1)又逐渐变为负位,并在d=d2处出现一个极小值Wmin,最后趋近于零。
W(2)曲线则随d值由大变小而连续增大,并始终处于横轴下方。
上述W(1)曲线上的极大值Wmax称为势能峰或势能垒,可看作胶粒接触碰撞所必须克服的“活化能”,只有将它降低到小于胶粒的动能时,胶粒之间才能发生碰撞和凝聚。
在稳定的胶体分散系中,胶粒的动能主要来自布朗运动,其值不过 1.5kT(k为波尔兹曼常数,k=1.38×10-23J/K,T为绝对温度,K),而势能峰却高达数百以至数千kT,因而胶粒始终不能超越势能峰的阻碍而发生凝聚。
但是,如果向体系中投加电解质来压缩双电层,使ζ电位由ζ1降低至ζ2,W R曲线由W R(1)降低至W R(2)。
此时W曲线上的Wmax值依次减小并向左移动。
当W由W(1)降低至Wc时,胶粒开始脱稳;当ζ=0时,势能峰消失,W曲线进一步降低至在所有d值范围内W A都占主导的W(2),胶粒的每次碰撞都促成聚集,胶体分散系便达到了快速凝聚状态。
(二)电性中和当投加的电解质为铁盐、铝盐时,它们能在一定条件下离解和水解,皮成各种络离子,如[Al(H2O)6]3+、[A1(OH)(H2O)5]2+、[A12(OH)2(H2O)8]4+和[A13(OH)5(H2O)9]4+等。
这些络离子不但能压绍双电层,甭且能够通过胶核外围的反离子层进入因液界面,并中和电位离子所带电荷,使ψ电位降低,ζ电位也随之减小,达到胶粒的脱稳和凝聚,这就是电性中和。
显然,其结果与压缩双电层相同,但作用机理是不同的。
(三)吸附桥联如果投加的药剂是水溶性链状高分子聚合物并具有能与胶粒和细微悬浮物发生吸附的活性部位,那末它就能通过静电引力、范德华引力和氢键力等,将微粒搭桥联结为一个个絮凝体(俗称矾花)。
这种作用就称为吸附桥联。
聚合物的链状分子在其中起了桥梁和纽带的作用。
吸附桥联的凝聚模式如图4-3。
显然,在吸附桥联形成絮凝体的过程中,胶粒和细微悬浮物并不一定要脱稳,也无需直接接触,ζ电位的大小也不起决定作用。
但聚合物的加入量及搅拌强度和搅拌时间必须严格控制,如果加入量过多,一开始微粒就被若干个高分子链包围,微粒再没有空白部位去吸附其它的高分子链,结果形成无吸附部位的稳定颗粒。
如呆搅拌强度过大或时间过长,桥联就会断裂,絮凝体破碎,并形成二次吸附再稳颗粒。
(四)网罗卷带网罗卷带也称网捕。
当用铁、铝盐等高价金属盐类作混凝剂,而且其投加量和介质条件足以使它们迅速生成难溶性氢氧化物时,沉淀就能把胶粒或细微悬浮物作为晶核或吸附质而将其一起除去。
在水实际处理少,上述各种机理往往同时或交叉发挥作用,只是依条件的不同而以其中的某一种起主导作用而已。
第三节混凝剂、助凝剂及其作用机理在混凝处理中,主要是通过压缩双电层和电性中和机理起作用的,所用添加剂常称为凝聚剂;主要通过吸附桥联机理起作用的则称为絮凝剂;同时兼有以上功能的统称为混凝剂。
一、常用混凝剂及其性能目前常用的混凝剂有无机金属盐类和有机高分子聚合物两大类。
前者主要有铁系和铝系等高价金属盐,可分为普通铁、铝盐和碱化聚合盐;后者则分为人工合成的和天然的两类。
表4-1中列出了常用铁、铝盐混凝剂的品种和主要性能,可供选用时参考。
表4-1 常用铁、铝混凝剂的品种和主要性能名称代号分子式主要性能三氯化铁FC FeCl.6H2O混凝效果不受水温影响,最佳PH 为6.0~8.4,但在4.0~11范围内仍可使用。
易溶解,絮体大而密实,沉降快,但腐蚀性大,在酸性水中易生成HCl气体而污染空气聚合硫酸铁PFS[Fe2(OH)n(SO4)3-n/2]m用量小,絮体生成快,大而密实。
腐蚀性比FeCl3小,所需碱性助剂量小于PAC以外的铁铝盐。
适宜水温10~50o C,PH5.0~8.5,但在4.0~11范围内仍可使用精制硫酸铝AS Al2(SO4).18H2O含Al2(SO4)250~60%。
适宜水温20~40o C,PH6.0~8.5。
水解缓慢,使用时需加碱性助剂,卫生条件好,但在废水处理中应用较少,在循环水中易生成坚硬的铝垢聚合氯化铝PAC[Al2(OH)n Cl6-n]m对水温、PH值和碱度的适应性强,絮体生成快且密实,使用时无需加碱性助剂,腐蚀性小。
最佳PH值为 6.0~8.5,使用时一般无需加碱性助剂聚合硫酸铝PAS[Al2(OH)n(SO4)3-n/2]m使用条件与硫酸铝基本相同,但用量小,性能好。
最佳PH值为6.0~8.5,使用时一般无需加碱性助剂聚硫氯化铝PACS[Al4(OH)2n Cl1-2n(SO4)]m系新型品种,絮体生成快,大而密实。
对水质的适应性强,脱色效果优良。
最佳PH为5.0~9.0,消耗水中碱度小于其他铁铝盐,无需加碱性助剂铁和铝的聚合盐,是具有一定碱化度的无机高分子聚合物,与普通铁、铝盐相比,具有投加剂量小、絮体生成快、对水质的适应范围广以及水解时消耗水中碱度少等一系列优点,因而应用日益广泛。
它们的混凝效果除与水质有关外.主要取决于产品的盐基度(也称碱化度)和有效成分。
盐基度是指产品分子中OH与金属原子的当量百分比,可用下式表示。
(4-2)式中B--盐基度%;n--单体分子中的OH个数;R m--单体分子中Fe或A1的原子个数;x--Fe和A1的化合价。
盐基度的大小,直接决定着产品的化学组成、混凝效果及诸如聚合度、分子量、分子电荷数、凝聚值、稳定性和溶液的pH值镕许多重要性质。
一殷说来,原水的浊度愈高,pH值愈保,对月值的要求也相应增大;在原水水质一定时,B值愈大,则混凝效果也相应提高。