化学选修5有机化学方程式汇总
- 格式:doc
- 大小:75.50 KB
- 文档页数:4

一.甲烷的反响1、〔氧化反响〕2、〔取代反响〕〔取代反响〕〔取代反响〕〔取代反响〕3、〔分解反响〕二.乙烯的实验室制法〔消去反响〕三.乙烯的反响1、〔加成反响〕2、〔加成反响〕3、〔加成反响〕4、〔氧化反响〕5、〔加成反响〕6*、〔氧化反响〕7、〔聚乙烯〕〔加聚反响〕四.烯烃的反响2、〔1,2加成〕3、〔1,4加成〕五.乙炔的实验室制法〔水解反响〕乙炔的反响1、〔氧化反响〕2、〔加成反响〕3、〔加成反响〕4、〔加成反响〕5、〔加成反响〕6*、〔加成反响〕六.苯及其同系物的反响1、〔取代反响〕2、〔硝基苯〕〔取代反响〕3*、〔苯磺酸〕〔取代反响〕1、〔聚丙烯〕〔加聚反响〕4、〔环己烷〕〔加成反响〕5、〔取代反响〕七.卤代烃的反响1、〔取代反响〕2、〔取代反响〕3、〔消去反响〕4、〔加成反响〕5、〔聚氯乙烯〕〔加聚反响〕八.乙醇的反响1、〔氧化反响〕2、〔置换反响〕3、〔氧化反响〕4、〔氧化反响〕5、〔取代反响〕6、〔消去反响〕7、〔取代反响〕8、〔酯化反响〕九.苯酚的反响1、〔置换反响〕2、〔复分解反响〕3、〔复分解反响〕4、〔取代反响〕5、〔取代反响〕6、〔酚醛树脂〕〔缩聚反响〕详解:,苯酚钠与二氧化碳水溶液反响,无论二氧化碳是否过量,都生成苯酚和碳酸氢钠。
十.乙醛的反响1、〔加成反响、复原反响〕2、〔氧化反响〕3、+++〔银镜反响〕〔++++++〕4、++++〔氧化反响〕详解:十一.甲醛的反响1、〔复原反响〕2、++++〔氧化反响〕3、++++〔氧化反应〕4、++++〔氧化反响〕5、++++〔氧化反响〕十二.乙酸的反响1、+2Na=+2、+=++;3、〔乙酸乙酯〕〔酯化反响〕4、〔乙酸甲酯〕〔酯化反响〕5、〔酯化反响〕6、〔酯化反响〕十三.甲酸的反响1、〔〕2、++3、++++4、++++5、6、++〔酯化反响〕十四.高级脂肪酸的反响1、〔酯化反响〕2、〔酯化反响〕3、〔酯化反响〕十五.乙酸乙酯的反响1、〔取代反响〕2、++〔取代反响〕十六.糖类1、〔氧化反响〕2、〔分解反响〕3、++ ++〔银镜反响〕4、+++〔氧化反响〕5、+〔加成反响〕6、〔氧化反响〕7、++〔水解反响〕8、、+〔水解反响〕9、〔淀粉或纤维素〕(葡萄糖)〔水解反响〕1、2、〔加成反响〕〔水解反响〕十八.氨基酸1、++〔中和反响〕2、+〔中和反响〕3、〔两个α-氨基酸分子脱水形成二肽〕十七.油脂。

1. 2. 3.+Br 2(液溴)FeCl3■NO 2+H 2O有机化学方程式(选修五)烷烃(甲烷为例)1. CH 4+C12光照「CH 3cl +HCl.2. CH ,+(3n +1)/2O,点燃-nCO.+(n +1)HO n2n+2222烯烃(乙烯为例)1. CH 2=CH 2+Br 2-CH 2Br —CH 2Br2. CH 2=CH 2+H 2O 催化剂.CH 3CH 2OH3. CH 2=CH 2+HCl 催化剂qCH 3cH 2cl5. nCH 2=CH 2催化剂.KH 2—CH 2t6.C n H2n+3n/2O2n CO 2+n H 2O炔烃(乙炔为例)2. CH 三CH +HCl 催化剂=CH 2=CHCl △3. CH 三CH +Br 2-CHBr=CHBr4. CH 三CH +2Br 2-CHBr 2—CHBr 25. nCH 2=CHCl 催化剂.[CH 2—fHi n 催化剂Cl6. C 4H 104t 一小二C 9H ,十CH410加热、加压2426苯4. CH 2=CH 2+H 2 催化剂A△CH 3—CH 31.CH 三CH +2H 2催化剂-*CH 3—CH+HNO 3浓硫酸 55〜60℃—Br +HBr2催化剂A△1. CH 3cH 2Br +NaOH H ‘O「CH 3cH 20H +NaBr△醇2. CHCHBr +NaOH 7~~^CHRH 9f+NaBr +HO32△22醇1.2CH 3cH 20H +2Na -2CH 3cH 2ONa +H 2T2. CH 3cH 2OH +HBr —△--CH 3CH 2Br +H 20浓硫酸3. CH 3CH 2OH 丁CH 2=CH 2T+H 2O170催化剂2CHCHOH +O 。
x2CHCHO +2HO322△32催化剂2CHCH(OH)CH +O,■2CHCOCH +HO332y^3327.C (CH 3)3OH +O 2催化剂.很难被氧化△酚(苯酚为例) +2Na -2ONa+H 2TfONa3.2+凡。

选修五有机反应方程式的整理归纳一.甲烷的反应1、(氧化反应)2、(取代反应)(取代反应)(取代反应)(取代反应)3、(分解反应)二.乙烯的实验室制法(消去反应)三.乙烯的反应1、(加成反应)2、(加成反应)3、(加成反应)4、(氧化反应)5、(加成反应)6*、(氧化反应)7、(聚乙烯)(加聚反应)四.烯烃的反应1、(聚丙烯)(加聚反应)2、(1,2加成)3、(1,4加成)五.乙炔的实验室制法(水解反应)乙炔的反应1、(氧化反应)2、(加成反应)3、(加成反应)4、(加成反应)5、(加成反应)6*、(加成反应)六.苯及其同系物的反应1、(取代反应)2、(硝基苯)(取代反应)3*、(苯磺酸)(取代反应)4、(环己烷)(加成反应)5、(取代反应)七.卤代烃的反应1、(取代反应)2、(取代反应)3、(消去反应)4、(加成反应)5、(聚氯乙烯)(加聚反应)八.乙醇的反应1、(氧化反应)2、(置换反应)3、(氧化反应)4、(氧化反应)5、(取代反应)6、(消去反应)7、(取代反应)8、(酯化反应)九.苯酚的反应1、(置换反应)2、(复分解反应)3、(复分解反应)4、(取代反应)5、(取代反应)6、(酚醛树脂)(缩聚反应)详解:,苯酚钠与二氧化碳水溶液反应,无论二氧化碳是否过量,都生成苯酚和碳酸氢钠。
十.乙醛的反应1、(加成反应、还原反应)2、(氧化反应)3、+++(银镜反应)(++++++)4、++++(氧化反应)详解:十一.甲醛的反应1、(还原反应)2、++++(氧化反应)3、++++(氧化)4、++++(氧化反应)5、++++(氧化反应)十二.乙酸的反应1、+2Na=+2、+=++;3、(乙酸乙酯)(酯化反应)4、(乙酸甲酯)(酯化反应)5、(酯化反应)6、(酯化反应)十三.甲酸的反应1、()2、++3、++++4、++++5、6、++(酯化反应)十四.高级脂肪酸的反应1、(酯化反应)2、(酯化反应)3、(酯化反应)十五.乙酸乙酯的反应1、(取代反应)2、++(取代反应)十六.糖类1、(氧化反应)2、(分解反应)3、++++(银镜反应)4、++++(氧化反应)5、+(加成反应)6、(氧化反应)7、++(水解反应)8、、+(水解反应)9、(淀粉或纤维素)(葡萄糖)(水解反应)十七.油脂1、2、(加成反应)(水解反应)十八.氨基酸1、++(中和反应)2、+(中和反应)3、(两个α-氨基酸分子脱水形成二肽)十八.常见的缩聚反应。
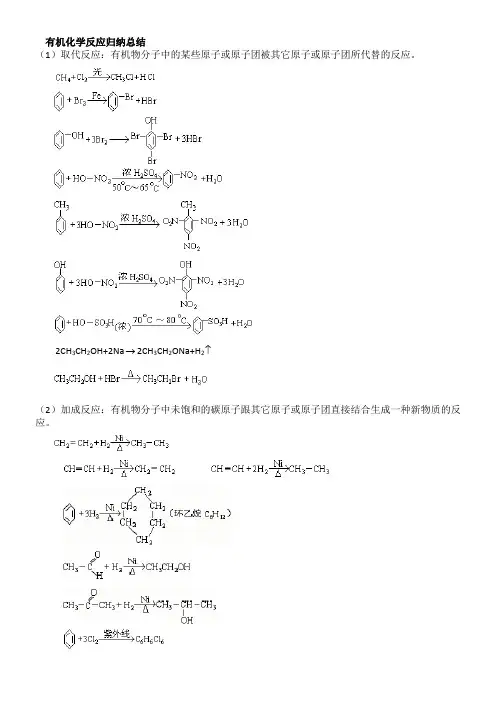
有机化学反应归纳总结
(1)取代反应:有机物分子中的某些原子或原子团被其它原子或原子团所代替的反应。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(2)加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成一种新物质的反应。
(3)加聚反应:由不饱和的单体聚合生成高分子化合物的反应
(聚乙烯)
(聚丙烯)
(聚丙烯腈)
(4)氧化反应:有机物燃烧或得氧失氢的反应。
①烃和含碳、氢、氧元素的化合物的燃烧(完全燃烧生成水和二氧化碳,不完全燃烧还会有CO 或碳单质和水生成。
)
②烯烃、炔烃、二烯烃等不饱和烃及苯的同系物与酸性KMnO4溶液的反应。
③苯酚在空气中变色反应。
④乙烯的催化氧化
⑤醇的催化氧化
⑥醇的催化氧化
⑦醛的银镜反应和菲林反应
(5)还原反应:有机物失氧得氢的反应。
(与H2加成反应均为还原反应)
(6)消去反应:有机物在一定条件下从一个分子中脱去一个小分子(如H2O、HX、NH3等)生成不饱和化合物的反应。
CH3Cl、CH3OH、、这些物质不能发生消去反应。
(7)裂化反应:在一定温度下把分子量大、沸点高的长链烃断裂为分子量小,沸点低的短链烃的反应。

一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
*⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、氟代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(CH3Cl,沸点为—24.2℃)氟里昂(CCl2F2,沸点为—29。
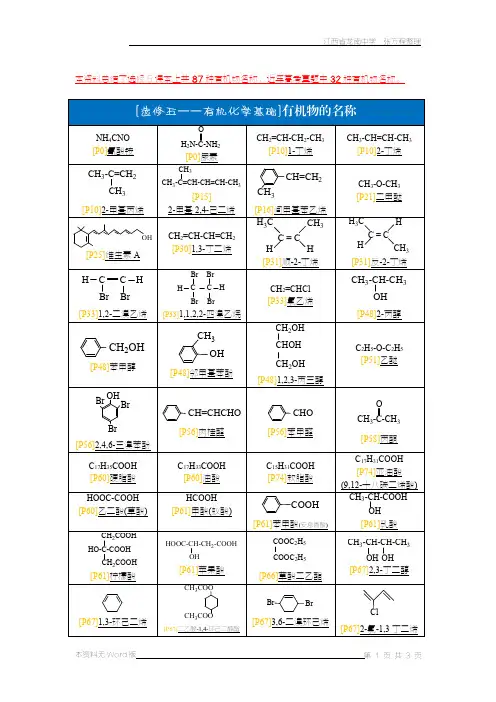

高中有机化学方程式归纳不饱和度:1、定义——不饱和度又称缺氢指数或者环加双键指数,在有机化学中常用来衡量有机物分子不饱和程度,用希腊字母Ω表示,在推断有机化合物结构时很有用。
H2、(1)定量计算公式:Ω=C- 2+1(该公式适用于只含碳、氢、氧、以及卤素的计算)注意:①在进行不饱和度计算时,氧原子对不饱和度没有贡献;②有机物分子中的卤素原子,可视作氢原子计算不饱和度Ω。
(2)含N 有机物直接数氢原子,易出错。
最好不要去算不饱和度,将卤原子视为H 原子)3、定性理解:单键对不饱和度不产生影响,因此烷烃的不饱和度是0(所有原子均已饱和)。
①一个双键(包括碳碳双键和碳氧双键)贡献1个不饱和度,即Ω=1;②一个叁键(炔烃:碳碳三键)贡献2个不饱和度,即Ω=2;;③一个环(如环烷烃)贡献1个不饱和度,即Ω=1;④一个苯环贡献4个不饱和度,即Ω=4。
4、根据结构计算:Ω=双键数+ 叁键数×2 +环数注意:一般不饱和度Ω ≥4时,要考虑可能含有苯环。
例如,某烃分子结构中含有一个苯环,两个碳碳双键和一个碳碳三键,它的分子式可能是()A、C9H12B、C17H20C、C20H30D、C12H20一、烷烃的主要化学性质【烷烃通式为:(C n H2n+2)】,不饱和度为()。
1、氧化反应(1)燃烧:CH4(g)+2O2(g)燃→CO2(g)+2H2O(l)(2)★烷烃不能使酸性高锰酸钾溶液和溴水(或溴的四氯化碳溶液)因反应而褪色2、取代反应一氯甲烷:CH +Cl 光CH Cl+HCl(★甲烷的四种氯代产物中只有一氯甲烷:CH Cl4 2 3 3是气体,其他均为液体)光二氯甲烷:CH3Cl+Cl2CH2Cl2+HCl光三氯甲烷:CH2Cl2+Cl2光CHCl3+HCl(CHCl3又叫氯仿)四氯化碳:CHCl3+Cl2CCl4+HCl (CCl4可用于灭火)二、烯烃的主要化学性质★单烯烃通式为:(C n H2n );单烯烃最简式(CH2);与(环烷烃)互为同分异构体,不饱和度为()。

高中化学高二化学选修五有机化学方程式总汇【完整版】本文为高中化学选修五的有机化学方程式总汇,包括各种有机化合物的实验室制法和反应。
下面将对每个部分进行简要介绍。
一、乙烯的实验室制法(已删除消去反应)二、乙烯的反应1、加成反应2、加成反应3、加成反应4、氧化反应5、加成反应6、氧化反应7、聚乙烯(加聚反应)三、甲烷的反应1、氧化反应2、取代反应取代反应取代反应取代反应3、分解反应四、烯烃的反应1、聚丙烯(加聚反应)2、1,2加成3、1,4加成五、乙炔的实验室制法(已删除水解反应)六、苯及其同系物的反应1、取代反应2、硝基苯(取代反应)3、苯磺酸(取代反应)4、环己烷(加成反应)5、取代反应七、卤代烃的反应1、取代反应2、取代反应3、消去反应4、加成反应5、聚氯乙烯(加聚反应)八、乙醇的反应1、氧化反应2、置换反应3、氧化反应4、氧化反应5、取代反应6、消去反应7、取代反应8、酯化反应九、苯酚的反应1、置换反应2、复分解反应3、复分解反应4、取代反应5、取代反应6、酚醛树脂(缩聚反应)十、乙酸的反应已删除部分十一、甲醛的反应1、氧化反应2、氧化反应3、还原反应4、氧化反应5、氧化反应6、氧化反应十二、乙酸乙酯的反应已删除部分十三、甲酸的反应1、酯化反应2、酯化反应3、酯化反应4、氧化反应5、酯化反应十四、高级脂肪酸的反应1、酯化反应2、酯化反应3、酯化反应十五、乙酸乙酯的反应十六。
糖类1.糖类可以进行氧化反应。
2.糖类可以发生分解反应。
3.糖类可以进行银镜反应,产生银镜反应物。
4.糖类可以进行氧化反应,产生氧化产物。
5.糖类可以进行加成反应,形成加成产物。
6.糖类可以进行氧化反应,产生氧化产物。
7.糖类可以进行水解反应,分解成水和其他化合物。
8.糖类可以进行水解反应,分解成水和其他化合物。
9.淀粉或纤维素可以通过水解反应分解成葡萄糖。
十七。
油脂1.油脂可以进行某种反应,但具体未说明。
2.油脂可以进行加成反应,形成加成产物。

光照光照光照光照催化剂△催化剂△△催化剂催化剂△溴化铁浓硫酸△CH 3NO 2NO 2 O 2N CH 3 H 2O醇△铜或银△浓硫酸170℃ OHBr催化剂△催化剂△△△浓硫酸△催化剂O催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压Br OHBr 催化剂△△催化剂△催化剂△催化剂△浓硫酸 140℃Ni △高中化学选修5有机化学方程式1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br6. CH 2 = CH 2 + H 2O CH 3CH 2OH7. CH 2 = CH 2 + HBr CH 3—CH 2Br8. CH 2 = CH 2 + H 2 CH 3—CH 39. nCH 2 = CH 2 [ CH 2—CH 2 ] n10. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n11. CH ≡CH + Br 2 CHBr = CHBr 12. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 13. CH ≡CH + HCl H 2C = CHCl14. nCH 2 = CH [ CH 2-CH ] nCl Cl15. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH216. + Br 2 Br + HBr17. + HO -NO 2 NO 2 +H 2O18. + 3H 2 19. +3HO -NO 2 +3H 2O 20. 21. 22. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 23. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O24. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑25. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O26. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 27.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O28. OH+NaOH ONa+H 2O 29. 30. ONa+H 2O+CO 2 OH+ NaHCO 331. +3Br 2 ↓+3HBr32. CH 3CHO + H 2 CH 3CH 2OH 33. 2CH 3CHO + O 2 2CH 3COOH34. CH 3CHO+2Ag(NH 32OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O35CH 3CHO+2Cu(OH2 CH 3COOH+Cu 2O ↓+2H 2O36. 2CH 3COOH+2Na CH 3COONa+H 2↑ 37.2CH 3COOH+Na 2CO 3 2CH3COONa+H 2O+CO 2↑38. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑39. CH 3COOH + NaOH CH 3COONa + H 2O40. 2CH 3COOH + Cu(OH2 (CH 3COO2Cu + 2H 2O 41.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O42. CH 3COOCH 2CH 3+NaOH CH 3COONa+ CH 3CH 2OH43.nOHCH 2CH 2COOH [ OCH 2CH 2C ] n +nH 2O44.45. C 6H 12O 6 2CH 3CH 2OH + 2CO2葡萄糖46. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 蔗糖葡萄糖果糖47. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽糖葡萄糖48. (C 6H 10O 5n + nH 2O n C 6H 12O 6淀粉葡萄糖 49. (C 6H 10O 5n + nH 2O n C 6H 12O 6纤维素葡萄糖50.C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 51. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH△ CH 3CH 2OH+HBr CH 3CH 2Br+H 2O △稀硫酸CH 3COOCH 2CH 3+H 2O CH 3COOH+CH 3CH 2OHONa+ HCl OH+ NaCl OH +Na 2CO 3 ONa + NaHCO 3。
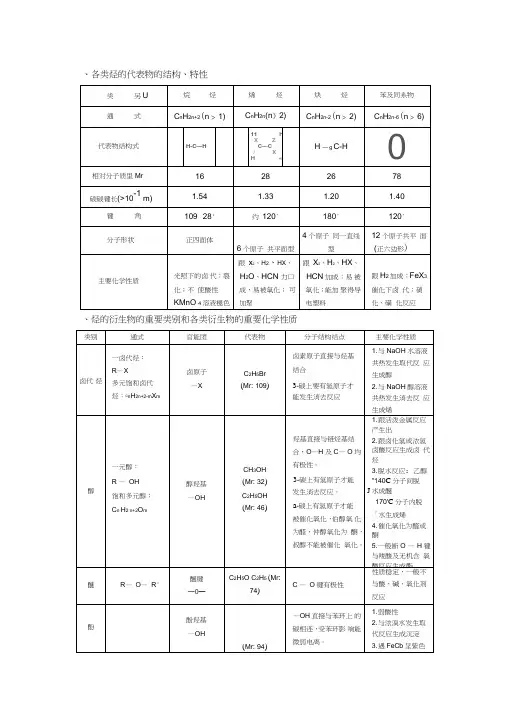
、各类烃的代表物的结构、特性、烃的衍生物的重要类别和各类衍生物的重要化学性质三、有机物的鉴别鉴别有机物,必须熟悉有机物的性质(物理性质、化学性质),要抓住某些有机物的特征反应,选用合适的试剂,一一鉴别它们。
1常用的试剂及某些可鉴别物质种类和实验现象归纳如下:2 •卤代烃中卤素的检验取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
3 •烯醛中碳碳双键的检验(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2 )若样品为水溶液,则先向样品中加入足量的新制C U(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若褪色,则证明含有碳碳双键。
★若直接向样品水溶液中滴加溴水,则会有反应:一CHO + B「2 + H2O T —COOH +2HBr而使溴水褪色。
4. 二糖或多糖水解产物的检验若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
5. 如何检验溶解在苯中的苯酚?取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
★若向样品中直接滴入FeCI3溶液,则由于苯酚仍溶解在苯中,不得进入水溶液中与卩63+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
★若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀。
6. 如何检验实验室制得的乙烯气体中含有CH2= CH 2、SO2、CO2、H2O ?将气体依次通过无水硫酸铜、品红溶液、饱和Fe2(SO4)3溶液、品红溶液、澄清石灰水、(检验水)(检验SO2)(除去SO2)(确认SO2已除尽)(检验CO2 )溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液(检验CH2= CH2)。
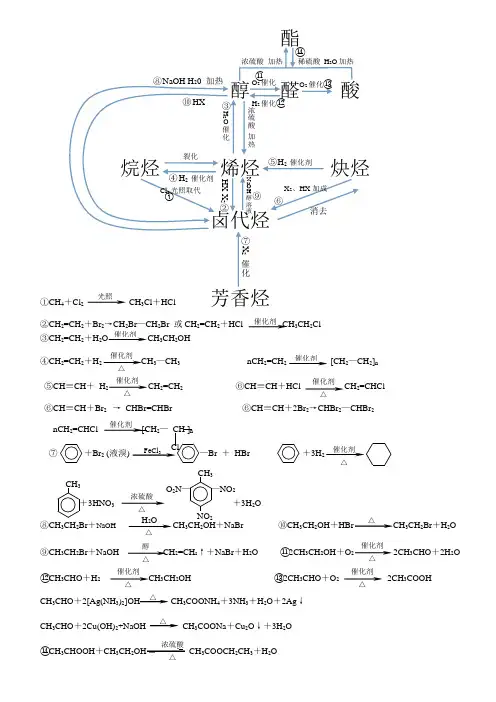
裂化 H 2 催化剂 酯 醇 醛 酸烷烃 烯烃 炔烃卤代烃①CH 4+Cl 2 CH 3Cl +HCl 芳香烃 ②CH 2=CH 2+Br 2→CH 2Br —CH 2Br 或CH 2=CH 2+HCl CH 3CH 2Cl③CH 2=CH 2+H 2O CH 3CH 2OH④CH 2=CH 2+H 2 CH 3—CH 3 nCH 2=CH 2 [CH 2—CH 2]n ⑤CH ≡CH + H 2 CH 2=CH 2 ⑥CH ≡CH +HCl CH 2=CHCl ⑥CH ≡CH +Br 2 → CHBr=CHBr ⑥CH ≡CH +2Br 2→CHBr 2—CHBr 2 nCH 2=CHCl [CH 2— CH ]n ⑦ +Br 2 (液溴) —Br + HBr +3H 2+3HNO 3 +3H 2O⑧CH 3CH 2Br +NaOH CH 3CH 2OH +NaBr ⑩CH 3CH 2OH +HBr CH 3CH 2Br +H 2O⑨CH 3CH 2Br +NaOH CH 2=CH 2↑+NaBr +H 2O ⑪2CH 3CH 2OH +O 2 2CH 3CHO +2H 2O ⑫CH 3CHO +H 2 CH 3CH 2OH ⑬2CH 3CHO +O 2 2CH 3COOH CH 3CHO +2[Ag(NH 3)2]OH CH 3COONH 4+3NH 3+H 2O +2Ag ↓ CH 3CHO +2Cu(OH)2+NaOH CH 3COONa +Cu 2O ↓+3H 2O⑭CH 3CHOOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O Cl 2光照取代 消去 X 2、HX 加成 H 2 催化剂 H 2O 催化 浓硫酸 加热 O 2催化 H 2催化 O 2催化 浓硫酸 加热 稀硫酸 H 2O 加热 X 2 催化 HX X 2 NaOH 醇溶液 HX NaOH H 20 加热 催化剂 △ 催化剂 催化剂 催化剂 △ 催化剂 △Cl 催化剂 △ FeCl 3 CH 3浓硫酸△ CH 3O 2N — —NO 2 NO 2 醇 △ H 2O △催化剂 △ 催化剂 △△ △ 浓硫酸 △ 光照催化剂 催化剂△ 催化剂 △ ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑪ ⑫ ⑬ ⑭。
人教版有机化学(选修5)教材全部实验整理P17实验1-1.蒸馏实验:蒸馏:利用互溶液体混合物中各组分沸点不同(一般相差30℃以上)进行分离提纯的一种方法。
【注意】③要仪器:蒸馏烧瓶、冷凝管、接引管(尾接管)、锥形瓶②温度计水银球位于支管口处③冷却水的通入方向:进水水流与气流方向相反。
④沸点高而不稳定的液态物质可以考虑减压蒸馏⑤要加入碎瓷片(未上釉的废瓷片)防止液体暴沸,使液体平稳沸腾⑥蒸馏烧瓶盛装溶液体积最大为烧瓶体积的2/3p18:实验1-2;苯甲酸的重结晶:重结晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
【溶剂要求】①杂质在此溶剂中的溶解度很小或溶解度很大,易于除去;②被提纯的有机物在此溶剂中的溶解度受温度的影响较大,即热溶液中溶解度大,冷溶液中的溶解度小。
【主要步骤】加热溶解、趁热过滤、冷却结晶【注意事项】①为了减少趁热过滤过程中损失苯甲酸,应在趁热过滤前加入少量蒸馏水,避免立即结晶,且使用短颈漏斗。
②较为复杂的操作:漏斗烘热、滤纸用热液润湿、马上过滤、漏斗下端越短越好。
p19:萃取:利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一溶剂中,从而进行分离的方法。
1、萃取包括液-液萃取和固-液萃取。
2、常用的萃取剂有乙醚、石油醚、二氯甲烷、CCl4等【萃取剂的选择】①萃取剂与原溶剂不互溶、不反应②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度③溶质不与萃取剂发生任何反应▲分液:常用于两种互不相溶的液体的分离和提纯。
p19:实践活动:用粉笔分离菠菜叶中的色素,研磨时用到仪器研钵。
p32:实验2-1:乙炔的实验室制取及性质:1. 反应方程式:2. 此实验能否用启普发生器,为何?不能,因为1)CaC2吸水性强,与水反应剧烈,若用启普发生器,不易控制它与水的反应;2)反应放热,而启普发生器是不能承受热量的;3)反应生成的Ca(OH)2微溶于水,会堵塞球形漏斗的下端口。
高二选修五化学方程式总汇_高二选修五必背化学方程式归纳高二化学的重点内容是有机化学,而有机化学的重点则是方程式。
那么你知道高二选修五化学方程式有哪些吗?下面是由店铺为您带来的高二选修五化学方程式总汇,欢迎翻阅。
高二选修五化学方程式总汇(一)1, 非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4 HNO3(稀)===3SO2+4NO+2H2O N2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2) PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO高二选修五化学方程式总汇(二)金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)高二选修五化学方程式总汇(三)甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解.CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照. )实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式.CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3C HO+2Cu→Cu2O(沉淀)+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH (条件为催化剂)乙醛的制取乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热) 乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)乙醛的催化氧化:CH3CHO+O2→2CH3COOH (条件为催化剂加热)取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照.)。
化学选修五方程式汇总
一、烷烃
1、取代反应
①甲烷与氯气的取代(只写出第一步反应)
注:但共有种产物,其中的产量最多,有种有机产物。
2、氧化反应
①不能使酸性高锰酸钾溶液褪色。
②甲烷燃烧:
③烷烃燃烧通式:
3、分解反应
①甲烷高温下分解:
②十六烷催化裂解:
③丁烷催化裂化:
一、烯烃
1、加成反应
①乙烯与溴水(或溴的四氯化碳)的加成反应:
②乙烯制工业酒精:
③乙烯与氢气反应:
④乙烯与氯化氢反应:
⑤1,3-丁二烯与氯气发生1,2-加成:
⑥1,3-丁二烯与氯气发生1,4-加成:
2、氧化反应
①使酸性高锰酸钾溶液褪色。
②乙烯燃烧:
③烯烃燃烧通式:
④乙烯氧化法制乙醛:
3、加聚反应
①乙烯发生加聚反应:
②2-丁烯发生加聚反应:
③乙烯与苯乙烯发生共聚反应:
一、炔烃
实验室制备乙炔:
1、加成反应
①乙炔与溴水(或溴的四氯化碳)1:1加成反应:
②乙炔与溴水(或溴的四氯化碳)1:2加成反应:
③乙炔与氢气1:1反应:
④乙炔与氯化氢1:1反应:
2、氧化反应
①使酸性高锰酸钾溶液褪色。
②乙炔燃烧:
③炔烃燃烧通式:
3、加聚反应
①乙炔发生加聚反应:
②丙炔发生加聚反应:
三、芳香烃
1、取代反应
①卤代:苯与液溴、铁粉的取代反应
②硝化:苯与浓硫酸、浓硝酸共热
③磺化:苯与浓硫酸共热
④甲苯与浓硫酸、浓硝酸共热发生硝化反应
⑤甲苯与氯气光照:(1:1)
⑥甲苯与氯气氯化铁催化:(1:1)
2、氧化反应
①苯不能使酸性高锰酸钾溶液褪色,甲苯或乙苯能使酸性高锰酸钾溶液褪色,生成苯甲酸。
②苯在空气中燃烧
③苯和苯的同系物在空气中燃烧通式
④烃(C x H y)燃烧通式
3、加成反应
①苯与氢气加成:
②甲苯与氢气加成:
四、卤代烃
1、水解反应
①溴乙烷的水解
②1,2-二氯乙烷的水解
2、消去反应
①溴乙烷的消去反应
②2-氯丙烷的消去反应
③1,2-二溴乙烷的消去反应
五、醇
1、置换反应
①乙醇与金属钠的置换反应
②乙二醇与金属钠的置换反应
③丙三醇与金属钠的置换反应
2、消去反应
①乙醇与浓硫酸共热170℃(实验室制备乙烯)
②2-丙醇与浓硫酸共热发生消去反应
3、取代反应
①乙醇与浓氢溴酸混合共热
②乙醇与浓硫酸共热140℃
③乙醇与乙酸发生酯化反应
④乙二醇与足量的乙酸发生酯化
4、氧化反应
①乙醇在空气中燃烧:
②乙醇催化氧化:
③2-丙醇催化氧化:
④乙醇能被酸性重铬酸钾溶液氧化,能使酸性高锰酸钾溶液褪色。
⑤烃的含氧衍生物(C x H y O z)燃烧通式
五、酚
1、弱酸性
①苯酚与氢氧化钠溶液反应
②苯酚与碳酸钠溶液反应
③苯酚钠溶液中加入稀盐酸
④苯酚钠溶液中通入二氧化碳
2、置换反应
①苯酚与金属钠反应
3、取代反应
①苯酚与浓溴水反应
4、显色反应
①苯酚溶液与Fe3+作用能显紫色。
5、氧化反应
①苯酚在空气中燃烧:
②苯酚在空气中被氧化成粉红色物质。
③苯酚能使酸性高锰酸钾溶液褪色。
6、加成反应
①苯酚与氢气加成:
7、缩聚反应
①苯酚与甲醛制取酚醛树脂
六、醛
1、氧化反应
①乙醛在空气中燃烧:
②乙醛催化氧化:
③乙醛发生银镜反应:
④乙醛与新制氢氧化铜悬浊液的反应
⑤乙醛与溴水的反应
⑥乙醛能使酸性高锰酸钾溶液褪色。
⑦苯甲醛发生银镜反应:
⑧甲醛发生银镜反应:
⑨甲醛与新制氢氧化铜悬浊液的反应
2、加成反应
①乙醛与氢气的反应(还原反应)
②乙醛与氰化氢的反应
七、酮
①丙酮与氢气的反应(还原反应)
②丙酮不能银氨溶液、新制氢氧化铜悬浊液反应
八、羧酸
1、弱酸性
乙酸具有酸的通性,其电离的方程式:
①乙酸能使紫色石蕊试液变。
②乙酸与金属钠反应
③乙酸与氢氧化钠反应
④乙酸与氧化钠反应
⑤乙酸与碳酸氢钠反应
2、酯化反应
①乙酸与乙醇发生酯化反应
②甲酸与2-丙醇发生酯化反应
①乙二酸与乙二醇酯化成六元环酯
②乙二酸与乙二醇酯化成聚酯
九、酯
1、水解反应
①乙酸乙酯在酸性条件下的水解
②乙酸乙酯在碱性条件下的水解
③苯甲酸乙酯在酸性条件下水解
④乙酸苯酚酯在碱性条件下的水解
十、油脂
1、水解反应
①硬脂酸甘油酯酸性条件下水解
②硬脂酸甘油酯碱性条件下水解(皂化反应)
2、氢化(加成反应)
①油酸甘油酯与氢气反应
十一、糖类
葡萄糖的化学性质
1、氧化反应
①葡萄糖燃烧
②葡萄糖发生银镜反应
③葡萄糖与新制氢氧化铜悬浊液的反应
④葡萄糖能使酸性高锰酸钾溶液褪色。
2、加成反应
①葡萄糖与氢气反应
3、酯化反应
①葡萄糖与乙酸发生酯化反应(1:5)
其它糖类的化学性质
①蔗糖、麦芽糖的水解、
②纤维素、淀粉的水解、
③纤维素与硝酸发生酯化反应
十二、氨基酸蛋白质
1、两性
①甘氨酸与盐酸反应
②甘氨酸与氢氧化钠反应
2、成肽反应
①甘氨酸脱水缩合。