希托夫法测定离子的迁移数 PPT
- 格式:ppt
- 大小:2.65 MB
- 文档页数:22

希托夫法测定离子迁移数希托夫法测定离子迁移数1目的要求1.掌握希托夫法测定电解质溶液中离子迁移数的某本原理和操作方法。
2.测定CuSO4溶液中Cu2+和SO42-的迁移数。
2 实验原理当电流通过电解质溶液时,溶液中的正负离子各自向阴、阳两极迁移,由于各种离子的迁移速度不同,各自所带过去的电量也必然不同。
每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数。
若正负离子传递电量分别为q+和q-,通过溶液的总电量为Q, 则正负离子的迁移数分别为:t+=q+/Q t-=q-/Q离子迁移数与浓度、温度、溶剂的性质有关,增加某种离子的浓度则该离子传递电量的百分数增加,离子迁移数也相应增加;温度改变,离子迁移数也会发生变化,但温度升高正负离子的迁移数差别较小;同一种离子在不同电解质中迁移数是不同的。
离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法等。
用希托夫法测定CuSO4溶液中Cu2+和SO42-的迁移数时,在溶液中间区浓度不变的条件下,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,读取阳极区(或阴极区)溶液的体积,可计算出通电后迁移出阳极区(或阴极区)的Cu2+和SO42-的量。
通过溶液的总电量Q由串联在电路中的电量计测定。
可算出t+和t-。
在迁移管中,两电极均为Cu电极。
其中放CuSO4溶液。
通电时,溶液中的Cu2+在阴极上发生还原析出Cu,而在阳极上金属铜溶解生成Cu2+。
对于阳极,通电时一方面阳极区有Cu2+迁移出,另一方面电极上Cu溶解生成Cu2+,因而有式中表示迁移出阳极区或迁入阴极区的Cu2+的量,m m 表示通电前阳极区或阴极区所含Cu2+的量,表示通电后阳极区所含Cu2+的量,表示通电后阴极区所含Cu2+的量。
表示通电时阳极上Cu溶解(转变为Cu2+)的量,也等于铜电量计阴极上Cu2+析出Cu的量,可以看出希托夫法测定离子的迁移数至少包括两个假定:(1)电的输送者只是电解质的离子,溶剂水不导电,p p 这一点与实际情况接近。




希托夫法测定离子迁移数
一、实验步骤
1、配制0.05mol/L CuSO4溶液250ml。
洗净所有容器。
用0.05mol/L CuSO4溶液荡洗
3次,然后在迁移管中装入该溶液,迁移管中不应有气泡。
2、铜电极放在1mol/L HNO3溶液中稍微洗涤一下,以除去表面的氧化层,用蒸馏水冲
洗后,将作为阳极的两片铜电极放入盛有镀铜液的库仑计中(镀铜液:100ml水中含15克CuSO4·5H2O,5ml浓H2SO4,5ml乙醇),将铜阴极用无水乙醇淋洗一下,吹干,在天平上称重得M1,然后放入库仑计。
3、按图接好测量线路。
接通电源,通过调节使电流在10mA左右。
4、通电90分钟,关闭电源。
取出库仑计中的铜阴极,用蒸馏水冲洗后,用无水乙醇
淋洗,再吹干,然后称重得M2。
5、分别将中间区、阴极区的CuSO4溶液部分取出,测其吸光度,分别得A中和A阴,查
工作曲线找到相应浓度,分别得到C前和C后。
二、实验装置连接图
1、Hb迁移管
2、阳极
3、阴极
4、库仑计
5、阴极插座
6、阳极插座
7、电极固定板
8、阴极铜片
9、阳极铜片。

物理化学1.希托夫法测定离子迁移数的基本原理?2.如何求电极反应的物质的量?3.如何求离子迁移的物质的量?4.当电极为惰性电极或消耗性电极时,分别如何进行物料衡算?离子的运动速率离子的电迁移率离子的迁移数Hittorf(希托夫)法界面移动法电动势法基本原理一电迁n n t B B ,离子 B 迁移的物质的量 电极反应的物质的量库仑计物料衡算实验装置二希托夫法测定离子的迁移数在Hittorf 迁移管中,用Ag电极电解AgNO3水溶液,电解前,溶液中每 1kg 水中含 43.50mmol AgNO3。
实验后,串联在电路中的银库仑计上有0.723mmolAg析出。
据分析知,通电后阳极区含 23.14g 水和1.390mmol AgNO3。
试求Ag+和NO3-的离子迁移数。
0.723mmolAg电解前43.50mmol AgNO3/1kg 水 1.007mmolAgNO3电解后1.390mmol AgNO3例题A g A g e A g e A g阳极:阴极:++→++→1、n 电= 0.723mmol 2、求n 迁:电解前后阳极区中水的量不变mmoln 007.114.23100050.43=⨯=前电解前mmoln 390.1=后电解后mmol340.0n -n n n =+=后电前迁3、求t +:470.0723.0340.0===+电迁n n t 4、求t -:530.0470.011=-=-=+-t t 希托夫法测定离子的迁移数迁电前后n n n n -+=阴极区铜离子:14(CuSO )159.62 g m olM -=⋅希托夫法测定离子的迁移数mol n 41-108771.1mol107.88g 20.0405g -⨯=⋅⨯=电mol mol g n 31107.064362.1591.1276g --⨯=⋅=前mol molg n 31106.947762.1591.1090g --⨯=⋅=后电迁前后n n n n -+=moln n n n 51011.7-⨯=-+=前电后迁0.382==+电迁n n t Cu 62.01224=-=+Cu SO t t Cue Cu =++22例题希托夫法测定离子的迁移数铜电量计-+t t ,有变化吗?铂电极铂电极-+t t ,有变化吗?PPT 模板下载:/moban/ 行业PPT 模板:/hangye/ 节日PPT 模板:/jieri/ PPT 素材下载:/sucai/PPT 背景图片:/beijing/ PPT 图表下载:/tubiao/ 优秀PPT 下载:/xiazai/ PPT 教程: /powerpoint/ Word 教程: /word/ Excel 教程:/excel/ 资料下载:/ziliao/ PPT 课件下载:/kejian/ 范文下载:/fanwen/ 试卷下载:/shiti/ 教案下载:/jiaoan/ 字体下载:/ziti/谢谢观看。
希托夫法测定离子的迁移数一、实验目的掌握希托夫法测定电解质溶液中离子迁移数的基本原理和操作方法。
测定4CuSO 溶液中+2Cu 和-24SO 的迁移数。
二、实验原理当电流通过电解质溶液时,在两电极上发生氧化、还原反应,反应物质的量与通过电量的关系服从法拉第定律。
同时,在溶液中的正、负离子分别向阴、阳两极迁移,由于正、负离子的移动速度不同,所带电荷不等,因此它们在迁移电量时所分担的份额也不同。
电解的结果是两极区的溶液浓度发生了变化。
为了表示电解质溶液中离子的特征,以及它们对溶液导电能力贡献的大小,引入离子迁移数的概念。
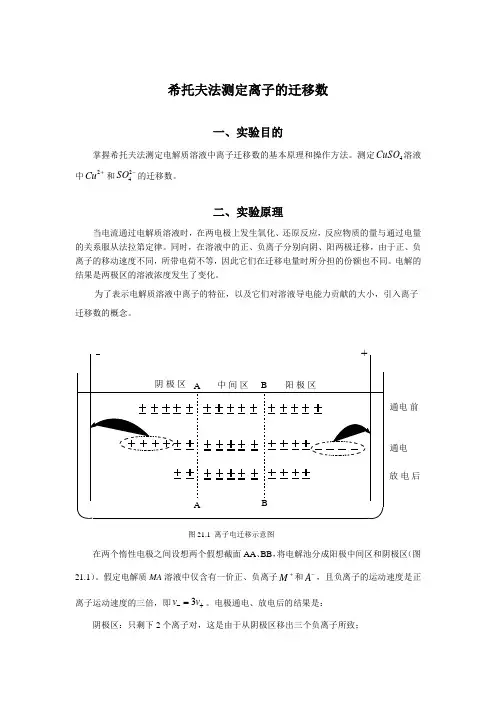
通 电 前通 电 放 电 后图21.1 离子电迁移示意图在两个惰性电极之间设想两个假想截面AA 、BB ,将电解池分成阳极中间区和阴极区(图21.1)。
假定电解质MA 溶液中仅含有一价正、负离子+M 和-A ,且负离子的运动速度是正离子运动速度的三倍,即+-=v v 3。
电极通电、放电后的结果是:阴极区:只剩下2个离子对,这是由于从阴极区移出三个负离子所致;阳极区:只剩下4个离子对,这是由于从阳极区移出一个正离子所致。
通过溶液的总电量Q 为正、负离子迁移电量的总和,即4个电子电量,因此可以得到如下关系:)()(-+-+==Q Q v v 负离子迁移的电荷量正离子迁移的电荷量阴极区减少的电解质阳极区减少的电解质 定义离子的迁移数为:正离子迁移数 Q Q t ++=,负离子迁移数 QQt --=,其中Q 总电量 1=+=+∴-+-+QQ Q Q t t 离子迁移数可以用希托夫法进行测定,其实验原理如图2所示,包括一个阴极管、一个阳极管和一个中间管,外电路中串联有库仑电量计(本实验中采用铜电量计),可测定通过电流的总电量。
在溶液中间区浓度不变的条件下,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,比较等重量溶剂所含MA 的量,可计算出通电后迁移出阳极区(或阴极区)的MA 的量。
通过溶液的总电量Q ,由串联在电路中的电量计测定。

实验结果:1.实验数据记录KPa P 22.101=大气压C T ︒=1.31温度11046.0-⋅=L mol c NaO Hm L L V SO H 68.01068.008.9898.084.110001025005.03342=⨯=⨯⨯⨯⨯=--所需浓硫酸的体积: mL V O H 10.1490.1000.2522=-=+气体电量计读数:g m 6157.495758.541915.104=-=阴极液质量:KPa p C w 49.43131=︒时:查表得:C RT VF p p Q w 08.691.3115.273314.83965001010.141049.4-22.10143)(46-3=+⨯⨯⨯⨯⨯⨯⨯=-=)()(则 3.。
减少的量阴极通电前后n SO H 4221 mL mV 52.49002.16157.49===ρ阴极液体积: 1330420952.01000.1010208.910.91046.02142---⋅=⨯⨯+⨯=⋅=L m ol V V c c SO H SO H NaOH NaOH 的浓度:原始133420930.01000.1010292.890.81046.02142---⋅=⨯⨯+⨯=⋅=L m ol V V c c SO H SO H NaOH NaOH 的浓度:阴极液 molV c c n SO H 430421009.11052.49)0930.00952.0()(:21--⨯=⨯⨯-=⋅-=浓度减少的量4.。
及计算离子的迁移数-+24SO H t t 848.0152.011152.008.69965001009.124244=-=-==⨯⨯=⋅=-+--SO H SO t t Q F n t思考题:1.如何保证气体电量计测得的气体体积是在大气压下的体积?答:轻弹电量管,待气体电量计气体全部逸出后,移动水准管,使水准管与量气管内液面相平,由流体静力学原理可知,此时所测气体体积即满足条件。


希托夫法测定离⼦的迁移数物理化学实验报告实验题⽬:希托夫法测定离⼦的迁移数平均室温:℃平均⽓压:Kpa同组⼈:⽇期:2013-3-12⼀、实验⽬的。
1. 掌握希托夫法测定电解质溶液中离⼦迁移数的基本原理和操作⽅法。
2. 测定CuSO4溶液中Cu2+和SO42-的迁移数。
⼆、实验原理。
当电解质溶液中通过电流时,会在两级上发⽣氧化和还原反应。
反应物的物质的量与通电量的关系服从法拉第定律。
设正、负离⼦的迁移数分别为:u+和u-。
当通电量为Q时有:阳极电解质减少的物质的量/阴极电解质增加的物质的量= Q+/Q- = u+/u-正、负离⼦的迁移电量与迁移速度成正⽐。
通过溶液的总电量Q等于正负离⼦的电量之和。
即:Q= Q+ + Q-t+ = Q+/Q = t- = Q-/Q在溶液中间浓度不变的条件下,分析通电前原溶液通电后阳极区溶液的浓度,⽐较等重量溶剂所含MA的量,可计算出通电后迁移出阳极区的MA的量。
通过溶液总电量Q由串联电路中的电量计测定。
可以算出t+和t-。
n迁= n电+ n后-n原三、仪器与试剂迁移数管1⽀;铜电量计1套;直流稳压电源1台滑线电阻1台;移液管2⽀;滴定管1⽀KI溶液(10﹪)淀粉指⽰剂(0.5﹪)硫代硫酸钠溶液(0.04912mol/L)HAc溶液(1 mol/L)HNO3(A.R.) 硫酸铜溶液(0.05mol/L)四、主要实验步骤。
1. 清洗迁移数管,注意活塞是否漏⽔。
⽤少量硫酸铜溶液(0.05mol/L)淌洗两次,将该溶液充满迁移数管。
2. ⽤铜电量计测定通过溶液的电量。
阴极和阳极皆为铜⽚,实验前将阴极铜⽚⽤细砂纸磨光,再⽤稀硝酸浸洗,然后⽤蒸馏⽔洗净,晾⼲并称其重量(m1)。
3. 接通电源,调节变压器使阴极铜⽚上的电流密度为10~15mA/cm2,通电90分钟后切断电源。
取出铜电量计中部铜⽚⽤蒸馏⽔洗净,取出晾⼲并称其重量(m2)。
4. 将迁移管中的溶液分别缓慢放⼊已称量的锥形瓶中,再称其各瓶的重量,然后计算各溶液的净重。

实验10 离子迁移数的测定——希托夫法实验10 离子迁移数的测定——希托夫法一、目的要求1. 掌握希托夫法测定离子迁移数的方法2(了解气体库仑计的原理及应用。
(加深对离子迁移数的基本概念的理解 3二、原理在电场的作用下~即通电于电解质溶液~在溶液中则发生离子迁移现象~正离子向阴极移动~负离子向阳极移动。
正、负离子共同承担导电任务~致使电解质溶液能导电~由于正负离子移动的速率不同~因此它们对任务分担的百分数也不同~某一种离子迁移的电量与通过溶液总电量之比称为该离子的迁移数。
II,,由迁移数定义:t,,t= -+I,II,I,,,,式中I、I分别为正负离子所负担的迁移的电量~t及t为相应离子的迁移数。
--++图10-1 离子的电迁移情况希托夫法是根据电解前后阴极区及阳极区的电解质数量的变化来计算离子的迁移数。
我们用图13—1来说明。
设想在两个惰性电极之间有想象的平面AA和BB~将溶液分为阳极区~中间区和阴极区三部分。
假定在末通电前~各区均含有正、负离子各5mo1~分别用“+”、“-”号的数量来表示正、负离子的物质的量。
今通入4法拉第的电量之后~在阳极上有4mol负离子发生氧化反应~同时在阴极上有4mol正离子发生还原反应~在溶液中的离子也同时发生迁移。
假如正离子的速率是负离子的3倍~则在溶液中的任一截面上~将有3mo1的正离子通过截面向阴极移动~有1mo1的负离子通过截面向阳极移动~通电完毕后~中间区溶液的浓度不变~但阳极区及阴极区的浓度都会有变化~它们之间的浓度变化关系可以用公式表示出来。
如分析阴极区:,,,nn n,- 始后迁,,,,nnn ,+-n 始后迁电同理分析阳极区:,,,,,+- nnnn始后迁电,,,,+ nnn始后迁-2, 对HSO溶液~因为SO不参加电极反应~参加电极反应的是OH离子~所以此时上述244公式应是:,,, ,+ nnn始后迁,,,,,-+ nnnn始后迁电在上述各公式中:,,、分别表示通电后各区所含负离子及正离子物质的量。