国家食品药品监督管理局公告2010年第61号――国家药品质量公告(2010年第2期,总第82号)
- 格式:docx
- 大小:9.16 KB
- 文档页数:4


药品生产监督管理办法试题药品上市许可持有人应当建立药品质量保证体系,履行O责任,对其取得药品注册证书的药品质量负责。
A药品生产B药品检验C药品上市放行(「「工)D以上都是药品上市许可持有人、药品生产企业应当建立并实施药品追溯制度,按照规定赋予药品各级销售包装单元追溯标识,通过O实施药晶追溯,及时准确记录、保存药品追溯数据,并向药品追溯协同服务平台提供追溯信息。
A纸质记录B信息化手段C纸质记录和信息化手段D纸质记录或信息化手段国家药品监督管理局主管全国药品生产监督管理工作,对省、自治区、直辖市药品监督管理部门的药品生产监督管理工作进行监督和指导。
省、自治区、直辖市药品监督管理部门负责本行政区域内的药品生产监督管理,承担药品生产环节的O等工作。
A许可B检查C处罚D以上都是从事制剂、原料药、中药饮片生产活动,申请人应当按照本办法和国家药品监督管理局规定的药品生产许可证申报资料要求,向O提出申请。
A国家药品监督管理部门B省、自治区、直辖市药品监督管理部门「工)C市药品监督管理部门D以上均可省、自治区、直辖市药品监督管理部门应当自药品生产许可证申请受理之日起()日内,作出决定。
经审查符合规定的,予以批准,并自书面批准决定作出之日起()日内颁发药品生产许可证;不符合规定的,作出不予批准的书面决定,并说明理由。
A30;10 ;:)B30;30C10;10D10;30省、自治区、直辖市药品监督管理部门按照()等有关规定组织开展药品生产许可证申报资料技术审查和评定、现场检查。
A药物非临床研究质量管理规范B药物临床试验质量管理规范C药品生产质量管理规范(;2)D药品经营质量管理规范药品生产许可证有效期为O,分为正本和副本。
药品生产许可证样式由国家药品监督管理局统一制定。
药品生产许可证电子证书与纸质证书具有同等法律效力。
A三年B四年C五年D以上都不是变更生产地址或者生产范围,药品生产企业应当按照本药品生产监督管理办法第六条的规定及相关变更技术要求,提交涉及变更内容的有关材料,并报经O审查决定。


国家药典委员会关于勘误“布洛伪麻缓释片”标准有关内容
的函
【法规类别】药品管理
【发文字号】国药典化发[2010]61号
【发布部门】国家药典委员会
【发布日期】2010.02.25
【实施日期】2010.02.25
【时效性】现行有效
【效力级别】部门规范性文件
国家药典委员会关于勘误“布洛伪麻缓释片”标准有关内容的函
(国药典化发〔2010〕61号)
各省、自治区、直辖市食品药品监督管理局:
“布洛伪麻缓释片”标准编号为WS1-(X-167)-2004Z-2007)。
其标准有关内容有误,经我会核查,该品种:【检查】释放度项下盐酸伪麻黄碱将“…… 加pH7.2磷酸盐缓冲液5ml,加氯仿5ml,轻摇提取,如此提取3次,合并氯仿液,加5ml硼酸乙醇液(0
1 / 1。

国家食品药品监督管理局公告2010年第6号――药品
GMP认证公告(第196号)
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2010.02.03
•【文号】国家食品药品监督管理局公告2010年第6号
•【施行日期】2010.02.03
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局公告
(2010年第6号)
药品GMP认证公告(第196号)
按照国家食品药品监督管理局《药品生产质量管理规范认证管理办法》的规定,经现场检查和审核批准,北京广大制药厂等63家药品生产企业符合药品GMP 要求,发给《药品GMP证书》。
特此公告。
附件:药品GMP认证目录(第196号)
国家食品药品监督管理局
二○一○年二月三日附件
药品GMP认证目录(第196号)。

国家食品药品监督管理局公告2010年第43号关于实施《中国药典》2010年版有关事宜的公告《中华人民共和国药典》2010年版(以下简称中国药典)已由卫生部2010年第5号公告颁布,自2010年10月1日起执行。
现就实施中国药典的有关事宜公告如下:一、中国药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
二、凡中国药典收载的品种,自执行之日起,原收载于历版药典、卫生部颁布药品标准、国家食品药品监督管理局颁布新药转正标准和地方标准上升国家标准的同品种药品标准同时废止。
药品注册标准不符合中国药典有关要求的,药品生产企业应按《药品注册管理办法》的有关规定提出补充申请。
对于药品注册标准中收载的检验项目多于中国药典规定的或质量指标高于中国药典要求的,在执行中国药典的基础上,应同时执行原标准的相应项目和指标。
中国药典品种项下未收载的制剂规格,其质量标准按中国药典同品种相关要求执行,规格项按原批准证明文件执行。
三、药品生产企业应根据中国药典的增修订内容,按照我局相关规定及程序变更药品说明书和标签。
2010年10月1日起生产的药品必须使用变更后的说明书和标签。
对于通用名称已作修订的药品,其原名称可作为曾用名过渡使用。
四、中国药典所收载的相同品种,如含有中国药典规定以外的杂质,应当增加杂质控制项目。
五、中国药典关于眼用制剂无菌要求的具体执行时间将根据《药品生产质量管理规范》实施的要求另行规定。
六、药品生产企业应积极做好执行中国药典有关准备工作,对在中国药典执行中发现的问题应及时报所在地省级食品药品监督管理局。
同时应不断加强质量标准研究,提高药品质量控制水平。
七、各级地方食品药品监督管理部门应配合做好中国药典的宣贯工作,加强中国药典执行中的监督与指导,及时收集和反馈相关问题和意见。
八、国家药典委员会负责中国药典执行中的具体指导等有关工作。

卫生部公布药食同源可用于保健食品清单(2010-03-28 08:11:24)转载标签:分类:话榭语轩国医养生药食同源紫苏代代花郁李仁健康俗话说“病从口入”,国医研究表明许多现代病、慢性病都是由于饮食不当而吃出来的。
那么,吃进来的病还能吃出去吗?答案是肯定的!国家卫生部公布的药食同源食品清单中的食、药品可以帮助我们找到因不良习惯,不科学饮食而丢失的健康。
现转帖如下以备查询,也希望给朋友们提供一些方便:第一批《中华人民共和国食品卫生法(试行)》第八条规定的按照既是食品又是药品的物品名单如下:1、《中华人民共和国药典》85版和中国医学科学院卫生研究所编著的《食品成分表》(1981年第三版,野菜除外)中同时列入的品种:刀豆山药百合薏苡仁赤小豆生、干姜紫苏木瓜枸杞子昆布海藻山楂(红果)桑椹杏仁(苦)白果莲子牡蛎榧子(香榧)花椒蜂蜜佛手藿香(小)扁豆(白)龙眼肉(桂圆)芡实(鸡头米)莴苣淡豆豉桃仁黑芝麻八角茴香。
2、乌梢蛇蝮蛇酸枣仁牡蛎栀子甘草代代花罗汉果肉桂决明子莱菔子陈皮砂仁乌梅肉豆蔻白芷菊花藿香沙棘郁李仁青果薤白薄荷丁香高良姜白果香橼火麻仁桔红茯苓香薷红花紫苏第二批(91)第45号文麦芽黄芥子鲜白茅根荷叶桑叶鸡内金马齿苋鲜芦根第三批(98)国家卫生部公布新增一批药食同用的天然食物名单。
同时要求各级食品卫生监督机构在保健食品市场整顿中,注意把握政策界限,依法规范各级食品的生产经营活动。
新公布的药食同用的七种天然植物是:蒲公英益智淡竹叶胖大海金银花葛根鱼腥草。
连同过去公布的两批69种天然植物,我国确定的既是食品又是药品的天然植物已达76种。
(98.11.6.)第四批(2002):卫生部2002年公布的《关于进一步规范保健食品原料管理的通知》中,对药食同源物品、可用于保健食品的物品和保健食品禁用物品做出具体规定。
三种物品名单如下:1、既是食品又是药品的物品名单(按笔画顺序排列)。
丁香、八角茵香、刀豆、小茵香、小蓟、山药、山楼、马齿觅、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆范、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蝠、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、积棋子、拘祀子、桅子、砂仁、胖大海、获荃、香摊、香羔、桃仁、桑叶、桑堪、橘红、桔梗、益智仁、荷叶、莱放子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊芭、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、概子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、惹芭仁、燕白、覆盆子、落香。


卫生部关于立即查处违法添加药物的“糖济可胶囊”等14种保健食品的通知文章属性•【制定机关】卫生部(已撤销)•【公布日期】2005.11.27•【文号】卫监督发[2005]469号•【施行日期】2005.11.27•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文卫生部关于立即查处违法添加药物的“糖济可胶囊”等14种保健食品的通知(卫监督发[2005]469号)各省、自治区、直辖市卫生厅局、新疆生产建设兵团卫生局,卫生部卫生监督中心,中国疾病预防控制中心:根据2005年食品专项整治工作安排,我部组织部卫生监督中心和有关省份对调节血糖类保健食品添加化学药品情况进行专项监督检查,发现“糖济可胶囊”等14种产品含有格列美脲、苯乙双胍等化学药品(具体名单见附件)。
以上产品对消费者身体健康构成严重危害,违反《食品卫生法》和《保健食品管理办法》的规定。
为保障消费者身体健康,根据食品卫生法有关规定,现紧急通知如下:一、上述生产企业所在地的省级卫生行政部门要立即组织对这些生产企业进行监督检查,依法对这些单位违法生产经营行为予以严肃查处,责令其公告收回所有保健食品,在调查取证后吊销其相关卫生许可证明。
同时,要核查其生产情况和产品流向,及时向各相关省份卫生行政部门通报查处结果。
对涉嫌触犯刑法的,要依法及时向公安部门移送。
二、各地卫生行政部门要立即通知本辖区内食品经营单位停止销售这些产品,责令其公告收回已售出产品。
对不按要求收回和仍在违法经营这些产品的行为,要依法予以行政处罚,情节严重的,吊销相应卫生许可证明。
三、各地卫生行政部门要加强对保健食品生产经营活动的卫生许可和监督检查工作,依法查处违法生产经营行为,并及时向社会通报。
同时,请将有关情况及时函报我部监督司。
联系人:张旭东、房军联系电话:68792594,68792407 传真:68792408附件:添加化学药品的部分调节血糖类保健食品二〇〇五年十一月二十七日附件:添加化学药品的部分调节血糖类保健食品┌─┬─────┬──┬─────┬─────┬────────┬─────────┬───┐││标示的产品│商标│规格│生产日期或│标示的批准文号│标示的生产单位│添加的│││名称│││批号│││ 药物│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│1 │糖济可胶囊│九郡│0.5g/粒× │050228/050│国食健字G20040│陕西天福保健品有限│格列美│││││48粒│208│726│责任公司(委托生产│ 脲、││││││││:内蒙古五原九郡药│苯乙双││││││││业有限责任公司)│胍│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│2 │康立舒胶囊││0.5g/粒× │20041005│卫食健字(2000)│陕西利威尔制药有限│格列本│││(口服植物││42粒│200410010 │第0065号│公司│脲│││胰岛素)│││││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│3 │玺圃利唐康│玺圃│0.5g/粒× │A001│国食健字G20040│北京玺圃环球生物医│苯乙双│││胶囊││40粒/瓶│2004/06/22│311│药技术有限公司│ 胍、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│4 │协和牌汉龙│协和│0.5克×36 │2005年03月│卫食健字(2002)│北京美诺保健食品厂│格列美│││胶囊││粒│03日│第0442号│、协和生物工程研究│脲││││││││所有限公司││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│5 │同春堂苦瓜│同春│0.6g×30│041026/041│卫食健字(1999│北京同春堂生物科技│格列甲│││口含片│堂│片/瓶│001│)第107号│有限公司│嗪││├─────┼──┼─────┼─────┼────────┼─────────┼───┤││同春堂苦瓜│同春│0.6g×30│050101/050│卫食健字(1999│山东北京同春堂保健│格列甲│││口含片│堂│片/瓶│106│)第107号│食品有限公司│嗪│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│6 │一生唐乐舒│一生│0.3克×12 │20050423│卫食健字(2002)│北京唐康生物科技有│格列奇│││胶囊││粒×6板││第0546号│限公司、唐山市龙山│特││││││││药业有限公司│││├─────┼──┼─────┼─────┼────────┼─────────┼───┤││一生唐乐舒│一生│0.3克×12 │20050318│卫食健字(2002│北京唐康生物科技有│格列奇│││胶囊││粒×6板││)第0546号│限公司、唐山市龙山│特││││││││药业有限公司││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│7 │唐新胶囊│唐新│0.4g×9粒│20041215│卫食健字(2002)│(山东省)蓬莱深奥│格列美│││││×2板││第0382号│生物科技研究所│ 脲、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│8 │绿因唐平口│绿因│0.8g/片× │20050301 1│卫食健字(2002│山东绿因药业有限公│格列甲│││含片│唐平│30片/盒│8│)第0573号│司│ 嗪、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│9 │苦乐康胶囊││0.45g/粒×│2004-09-13│卫食健字(2002│辽宁健康伟业生物科│格列奇│││││12粒/板×4│/│)第0588号│技有限公司│特│││││板/盒│20040903││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│10│美洛胰克绿││0.25g×12 │041008/│卫食健字(2001│嘉兴三立生物制品开│格列本│││如蓝唐宁胶││粒×2板│20041013│)第0088号│发中心│脲│││囊│││││││├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│11│糖安美片│三圣│0.6g/片× │2005.02.24│国食健字G20040│洛阳康华生物制品有│格列本││││宝│12片×3板││637│限公司│脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│12│安糖胶囊│平川│0.4g/粒× │20050301│卫食健字(2000)│中国哈尔滨平川药业│格列本││││康达│100粒││第0724号│股份有限公司│脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│13│唐胰安苦荞││3克/袋×10│20041213│卫食健字(1998│山西灵丘国威苦荞开│格列奇│││降糖茶││袋/盒│20041216│)第078号│发有限责任公司│ 特、│││││││││格列本│││││││││脲│├─┼─────┼──┼─────┼─────┼────────┼─────────┼───┤│14│神叶牌降糖│神叶│24袋×2.5g│200410061/│卫食健字(1998│江苏省金坛市神叶饮│格列本│││茶│││2004.10.06│)第308号│料有限公司│脲│└─┴─────┴──┴─────┴─────┴────────┴─────────┴───┘。

国家食品药品监督管理局公告2011年第59号国家药品质量公告(2011年第2期,总第86号)为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对氟哌啶醇制剂等17个国家基本药物品种,以及苦参素注射液等4个其他制剂品种进行了质量抽验。
结果显示,本次抽验的21个品种2661批次产品中,有2652批次产品符合标准规定,9批次产品不符合标准规定,被抽验产品总体质量良好。
现将抽验结果公告如下:一、国家基本药物品种抽验结果本次共抽验氟哌啶醇制剂、盐酸多巴酚丁胺注射液、注射用苯唑西林钠、妇科千金制剂、去乙酰毛花苷制剂、鼻炎康片、地塞米松制剂、连翘败毒制剂、川芎茶调制剂、保和丸、右旋糖酐40制剂、盐酸肾上腺素注射液、胰岛素制剂、麻疹减毒活疫苗、醋酸甲羟孕酮制剂、开塞露、益母草制剂17个国家基本药物品种2075批次,其中2066批次产品符合标准规定,9批次产品不符合标准规定。
具体抽验结果如下:(一)氟哌啶醇制剂本次抽样49批次,涉及5家生产企业,经北京市药品检验所检验,全部符合标准规定。
(二)盐酸多巴酚丁胺注射液本次抽样155批次,涉及6家生产企业,经河南省食品药品检验所检验,全部符合标准规定。
(三)注射用苯唑西林钠本次抽样114批次,涉及8家生产企业,经湖南省药品检验所检验,全部符合标准规定。
(四)妇科千金制剂本次抽样33批次,涉及1家生产企业,经湖南省药品检验所检验,全部符合标准规定。
(五)去乙酰毛花苷制剂本次抽样58批次,涉及1家生产企业,经江苏省食品药品检验所检验,全部符合标准规定。
(六)鼻炎康片本次抽样29批次,涉及1家生产企业,经江苏省食品药品检验所检验,全部符合标准规定。
(七)地塞米松制剂本次抽样142批次,涉及26家生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。
(八)连翘败毒制剂本次抽样62批次,涉及17家生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。
国家食品药品监督管理局公告2009年第68号――国家药品质量公告(2009年第3期,总第79号)文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2009.11.09•【文号】国家食品药品监督管理局公告2009年第68号•【施行日期】2009.11.09•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局公告(2009年第68号)国家药品质量公告(2009年第3期,总第79号)为加强药品监管,保障公众用药安全,根据2009年国家药品评价抽验计划,国家食品药品监督管理局在全国范围内组织对克林霉素、洛伐他汀、抗病毒、消核片、妥布霉素、枸橼酸铋钾、西咪替丁等7个制剂品种进行了国家评价抽验。
结果显示,总体质量状况良好。
现将抽验结果公告如下:一、克林霉素制剂(克林霉素磷酸酯注射液、盐酸克林霉素胶囊、盐酸克林霉素注射液、注射用克林霉素磷酸酯、注射用盐酸克林霉素)全国共有292个药品批准文号、173家生产企业。
本次流通领域抽样211批,涉及6家生产企业,经河北省药品检验所检验,全部合格。
二、洛伐他汀制剂(洛伐他汀胶囊、洛伐他汀片剂)全国共有33个药品批准文号、28家生产企业。
本次在流通领域抽样225批,涉及 23家生产企业,经河北省药品检验所检验,221批次抽验结果为合格,4批次不符合标准规定,分别为丽珠集团新北江制药股份有限公司生产的批号为0804005A的2批次,不合格项目为检查项(溶出度);河北华加药业有限公司生产的批号为20080601、20080101各1批次,不合格项目为检查项(溶出度)。
三、抗病毒制剂(口服液、颗粒)全国共有25个药品批准文号,23家生产企业。
本次在流通领域抽样317批,涉及20家生产企业,经辽宁省食品药品检验所检验,全部合格。
四、消核片全国共有1个药品批准文号、1家生产企业。
本次在流通领域抽样33批,涉及1家生产企业,经辽宁省食品药品检验所检验,全部合格。
国家药品质量公告(2010年第3期,总第83期)2010年10月22日发布国家食品药品监督管理局公告2010年第79号国家药品质量公告(2010年第3期,总第83号)为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对板蓝根颗粒等9个国家基本药物品种,以及丹参舒心胶囊等15个其他制剂品种进行了质量抽验。
结果显示,本次抽验的24个品种5181批次产品中,有5142批次产品符合标准规定,39批次产品不符合标准规定,被抽验产品总体质量良好。
现将抽验结果公告如下:一、国家基本药物品种抽验结果本次共抽验板蓝根颗粒、清开灵注射液、盐酸异丙嗪制剂、盐酸氨溴索制剂、硝酸甘油制剂、注射用头孢呋辛钠、左氧氟沙星制剂、头孢氨苄制剂、盐酸环丙沙星制剂等9个国家基本药物品种2628批次,其中2615批次产品符合标准规定,13批次产品不符合标准规定。
具体抽验结果如下:(一)板蓝根颗粒本次抽样475批次,涉及153家生产企业,经北京市药品检验所检验,全部符合标准规定。
(二)清开灵注射液本次抽样242批次,涉及6家生产企业,经广东省药品检验所检验,全部符合标准规定。
(三)盐酸异丙嗪制剂本次抽样277批次,涉及9家生产企业,经江西省食品药品检验所检验,2批次产品不符合标准规定,为北海阳光药业有限公司生产的盐酸异丙嗪片,批号为080414、080415的各1批次,不合格项目均为检查(溶出度)。
(四)盐酸氨溴索制剂本次抽样107批次,涉及7家生产企业,经上海市食品药品检验所检验,全部符合标准规定。
(五)硝酸甘油制剂本次抽样286批次,涉及8家生产企业,经天津市食品药品检验所检验,1批次产品不符合标准规定,为北京益民药业有限公司生产的硝酸甘油片,批号为0701010,不合格项目为检查(含量均匀度)和含量测定。
(六)注射用头孢呋辛钠本次抽样295批次,涉及43家生产企业,经湖南省药品检验所检验,全部符合标准规定。
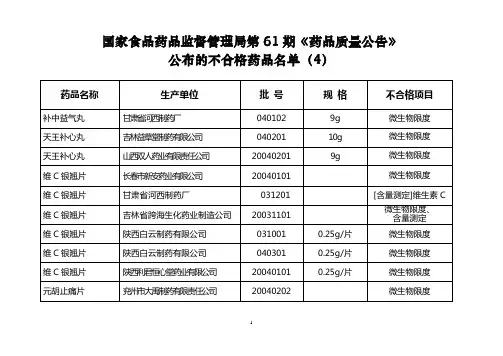
国家药品质量公告(2010年第2期,总第82期)2010年08月24日发布国家食品药品监督管理局公告2010年第61号国家药品质量公告(2010年第2期,总第82号)为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对国家基本药物品种,以及大活络丸等其他11个制剂品种进行了质量抽验。
结果显示,本次抽验的12个品种2415批次产品中,有2387批次产品符合标8批次产品不符合标准规定。
现将抽验结果公告如下:一、国家基本药物品种抽验结果本次抽验的国家基本药物品种三七胶囊,共抽样189批次,涉及17家生产企业,经浙江省食品药品检验所检验,全部符合标准规定二、其他制剂品种抽验结果本次共抽验大活络丸制剂、灯盏花素制剂、氟罗沙星制剂、复方氨酚烷胺制剂、骨肽注射液、七厘散制剂、硫普罗宁注射液、复方甘剂、注射用尿激酶、人参健脾丸、银杏叶片等11个制剂品种2226批次,其中2198批次产品符合标准规定,28批次产品不符合标准抽验结果如下:(一)大活络丸制剂本次抽样232批次,涉及28家生产企业,经上海市食品药品检验所检验,全部符合标准规定。
(二)灯盏花素制剂本次抽样229批次,涉及15家生产企业,经云南省食品药品检验所检验,全部符合标准规定。
(三)氟罗沙星制剂本次抽样155批次,涉及45家生产企业,经安徽省食品药品检验所检验,全部符合标准规定。
(四)复方氨酚烷胺制剂本次抽样366批次,涉及63家生产企业,经四川省食品药品检验所检验,全部符合标准规定。
(五)骨肽注射液本次抽样217批次,涉及16家生产企业,经黑龙江省食品药品检验检测所检验,全部符合标准规定。
(六)七厘散制剂本次抽样30批次,涉及8家企业,经大连市药品检验所检验,2批次产品不符合标准规定,为四川大千药业有限公司生产,批号为0102的各1批次,不合格项目均为检查(装量差异)。
(七)硫普罗宁注射液本次抽样49批次,涉及7家生产企业,经青岛市药品检验所检验,7批次产品不符合标准规定,为海南灵康制药有限公司生产,批号、090101、090103、090301、090302、090501、090502的各1批次,不合格项目均为检查(pH值)。
附件:可用于保健食品的益生菌菌种名单(卫法监发〔2001〕84号)发布日期:2010-07-20 来源:卫生部浏览次数:505【发布单位】卫生部【发布文号】卫法监发〔2001〕84号【发布日期】 2001-03-23【生效日期】 2001-03-23【效力】【备注】两岐双岐杆菌 Bifidobacterium bifidum婴儿双岐杆菌 B. infantis长双岐杆菌 B. longum短双岐杆菌 B. breve青春双岐杆菌 B. adolescentis保加利亚乳杆菌 Lactobacillus. bulgaricus嗜酸乳杆菌 L. acidophilus干酪乳杆菌干酪亚种 L. Casei subsp. casei嗜热链球菌 Streptococcus thermophilus卫生部关于印发真菌类和益生菌类保健食品评审规定的通知中华人民共和国卫生部2004-06-04 16:19:00卫法监发〔2001〕84号各省、自治区、直辖市卫生厅局,中国预防医学科学院:为规范保健食品审批,现印发《真菌类保健食品评审规定》、《益生菌类保健食品评审规定》。
请遵照执行。
附件:1、真菌类保健食品评审规定2、可用于保健食品的真菌菌种名单3、真菌菌种检定单位名单4、益生菌类保健食品评审规定5、可用于保健食品的益生菌菌种名单6、益生菌菌种检定单位名单二○○一年三月二十三日附件1:真菌类保健食品评审规定第一章总则第一条为规范真菌类保健食品评审工作,确保真菌类保健食品的食用安全,根据《中华人民共和国食品卫生法》、《保健食品管理办法》的有关规定,制定本规定。
第二条真菌类保健食品系指利用可食大型真菌和小型丝状真菌的子实体或菌丝体生产的具有特定功能的产品。
真菌类保健食品必须安全可靠,即食用安全,无毒无害,生产用菌种的生物学、遗传学、功效学特性明确和稳定。
第三条除长期袭用的可食真菌的子实体及其菌丝体外,可用于保健食品的真菌菌种名单由卫生部公布。
国家食品药品监督管理局关于对2010年查处制售假药典型案件成绩突出的食品药品监督管理局予以表扬的通报
【法规类别】药品管理
【发文字号】食药监办稽[2011]10号
【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)
【发布日期】2011.01.19
【实施日期】2011.01.19
【时效性】现行有效
【效力级别】XE0303
国家食品药品监督管理局关于对2010年查处制售假药典型案件成绩突出的食品药品监督
管理局予以表扬的通报
(食药监办稽[2011]10号)
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
2010年,各地食品药品监管部门按照国家食品药品监管局的总体部署,在药品安全专项整治、集中治理利用互联网发布虚假信息非法销售药品专项行动以及打击侵犯知识产权制售假冒伪劣商品专项行动中,以高度的责任感和使命感,全力以赴,攻坚克难,奋力拼搏,依法严肃查处了一批制售假劣药品案件,维护了药品生产经营秩序,有效地保障了广大人民群众的用药安全,树立了食品药品监管部门的良好形象。
为了弘扬食品药品监管部门在查办制售假劣药品案件中不畏艰难、奋发作为、锐意进取
的精神,国家食品药品监督管理局决定对在2010年查处制售假药典型案件成绩突出的食品药品监管局予以表扬。
希望各地食品药品监管部门深入贯彻落实科学发展观,大力践行科学监管理念,克服困难,认真履职,继续发扬对食品药品监管事业高度负责的精神,再接再厉,为保障公众用药安全做出更大的贡献。
国家食品药品监督管理局公告2010年第61号――国家药品质量公告(2010年第2期,总第82号)
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2010.08.24
•【文号】国家食品药品监督管理局公告2010年第61号
•【施行日期】2010.08.24
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局公告
(2010年第61号)
国家药品质量公告
(2010年第2期,总第82号)
为加强药品监管,保障公众用药安全,根据全国药品抽验工作计划,国家食品药品监督管理局在全国范围内组织对国家基本药物品种三七胶囊,以及大活络丸等其他11个制剂品种进行了质量抽验。
结果显示,本次抽验的12个品种2415批次产品中,有2387批次产品符合标准规定,28批次产品不符合标准规定。
现将抽验结果公告如下:
一、国家基本药物品种抽验结果
本次抽验的国家基本药物品种三七胶囊,共抽样189批次,涉及17家生产企业,经浙江省食品药品检验所检验,全部符合标准规定。
二、其他制剂品种抽验结果
本次共抽验大活络丸制剂、灯盏花素制剂、氟罗沙星制剂、复方氨酚烷胺制剂、骨肽注射液、七厘散制剂、硫普罗宁注射液、复方甘草口服制剂、注射用尿激酶、人参健脾丸、银杏叶片等11个制剂品种2226批次,其中2198批次产品符合标准规定,28批次产品不符合标准规定。
具体抽验结果如下:
(一)大活络丸制剂
本次抽样232批次,涉及28家生产企业,经上海市食品药品检验所检验,全部符合标准规定。
(二)灯盏花素制剂
本次抽样229批次,涉及15家生产企业,经云南省食品药品检验所检验,全部符合标准规定。
(三)氟罗沙星制剂
本次抽样155批次,涉及45家生产企业,经安徽省食品药品检验所检验,全部符合标准规定。
(四)复方氨酚烷胺制剂
本次抽样366批次,涉及63家生产企业,经四川省食品药品检验所检验,全部符合标准规定。
(五)骨肽注射液
本次抽样217批次,涉及16家生产企业,经黑龙江省食品药品检验检测所检验,全部符合标准规定。
(六)七厘散制剂
本次抽样30批次,涉及8家企业,经大连市药品检验所检验,2批次产品不符合标准规定,为四川大千药业有限公司生产,批号为090101、090102的各1批次,不合格项目均为检查(装量差异)。
(七)硫普罗宁注射液
本次抽样49批次,涉及7家生产企业,经青岛市药品检验所检验,7批次产品不符合标准规定,为海南灵康制药有限公司生产,批号为081003、090101、090103、090301、090302、090501、090502的各1批次,不合格项目均为检查(pH值)。
(八)复方甘草口服制剂
本次抽样350批次,涉及53家生产企业,经厦门市药品检验所检验,6批次产品不符合标准规定,分别为广西广明药业有限公司生产的批号为071114、081020、090321的各1批次,不合格项目分别为pH值、装量、pH值;江西天施康中药股份有限公司生产的批号为081101的1批次,不合格项目为含量测定;张家口长城药业有限责任公司生产的批号为080612的1批次,不合格项目为含量测定;长春大政药业科技有限公司生产的批号为080901的1批次,不合格项目为鉴别及含量测定。
(九)注射用尿激酶
本次抽样56批次,涉及9家生产企业,经河南省食品药品检验所检验,5批次产品不符合标准规定,分别为辽宁天龙药业有限公司生产的批号为20081101的2批次,不合格项目1批次为无菌、1批次为干燥失重及效价测定;北京赛生药业有限公司生产的批号为200807133的2批次,批号为200807223的1批次,不合格项目均为效价测定。
(十)人参健脾丸
本次抽样198批次,涉及33家生产企业,经宁夏回族自治区药品检验所检验,5批次产品不符合标准规定,分别为云南省腾冲县东方红制药有限责任公司生产的批号为20080902的2批次,不合格项目均为含量测定;山西万辉制药有限公司生产的批号为080301的1批次,不合格项目为鉴别;河北安国药业集团有限公司生产的批号为076605、076606的各1批次,不合格项目均为鉴别。
(十一)银杏叶片
本次抽样344批次,涉及56家生产企业,经贵州省药品检验所检验,3批次产品不符合标准规定,分别为广西半宙大康制药有限公司生产的批号为080601的2批次和批号为080701的1批次,不合格项目均为含量测定。
对本次抽验结果为不符合标准规定的药品及相关单位(详见附件),各省(区、市)食品药品监督管理部门正在依法进行查处,查处结果请各省(区、市)食品药品监督管理部门于2010年10月底前报送国家食品药品监督管理局稽查局,同时抄送国家食品药品监督管理局药品市场监督办公室。
对本次抽验结果为符合标准规定的药品,请登录国家食品药品监督管理局网站公告通告栏目查阅。
附件:国家抽验不符合标准规定的药品名单(略)
国家食品药品监督管理局
二○一○年八月二十四日。