缺血性卒中TOAST分型和CISS分型
- 格式:ppt
- 大小:3.77 MB
- 文档页数:18


脑卒中的分级标准全文共四篇示例,供读者参考第一篇示例:脑卒中是一种常见的神经系统疾病,分为缺血性和出血性两种类型。
脑卒中的危害极大,常常导致患者的残疾甚至死亡。
在诊断和治疗过程中,脑卒中的分级标准起着至关重要的作用。
分级标准能够帮助医生快速准确地评估患者的病情严重程度,制定出适当的治疗方案,提高患者的治疗效果和生存率。
当前,脑卒中的分级标准主要分为NIHSS评分、ASPECTS评分、GCS评分、IMS I-II-III等级、TOAST分类等几种。
接下来,我们将分别介绍这几种脑卒中的分级标准。
一、NIHSS评分NIHSS全称是国家卫生卫生研究院卒中量表(National Institutes of Health Stroke Scale),它是一种评估中风严重程度的量表。
NIHSS评分范围是0-42分,一般来说,分数越高,说明中风越严重。
NIHSS评分项目包括意识水平、眼运动、上肢运动、下肢运动、面部瘫痪、偏瘫、感觉、运动、言语等9项内容。
医生通过对患者进行这几个项目的检查,然后评分,最后将各项分数加总得到总分,进而判断脑卒中的严重程度。
通常情况下,NIHSS评分在0-6分的患者为轻度脑卒中患者,7-15分的患者为中度脑卒中患者,16-20分的患者为重度脑卒中患者,21-42分的患者为危重脑卒中患者。
二、ASPECTS评分ASPECTS全称是Alberta Stroke Program Early CT Score,它是通过头部CT检查来评估脑卒中患者脑组织缺血程度的量表。
ASPECTS 评分范围是0-10分,分数越高表示脑卒中患者的缺血程度越轻。
ASPECTS评分主要评估患者脑卒中部位和程度,具体来说就是通过CT图像排列10个特定的脑区域,然后看这些脑区域是否发生缺血性损伤,根据损伤情况给予相应分数。
ASPECTS评分在0-4分的患者为重度脑卒中患者,5-7分的患者为中度脑卒中患者,8-10分的患者为轻度脑卒中患者。


解读:中国缺⾎性卒中亚型——CISS分型卒中是⼀种异质性很强的疾病,不同类型的卒中(脑梗死、脑出⾎) 其所包含的病因也各不相同。
缺⾎性卒中亦是如此,从⼀种“疾病” 到⼀种“临床综合征”观念的转变,⼈们对缺⾎性卒中的认识逐渐深刻,并开始基于病因对不同的缺⾎性卒中患者“对因施治”,这⼀过程是伴随着缺⾎性卒中病因学研究的不断发展⽽不断进步的,⽽以循证医学为基础逐渐发展的缺⾎性卒中治疗指南和治疗⼿段也随之发⽣了⾰命性的变化。
缺⾎性卒中的病因学分型是临床试验、流⾏病学调查、基因研究及临床实践中治疗决策制定的基础。
中国缺⾎性卒中亚型——CISS分型该标准体系的分型过程分为两步:第⼀步同经典的TOAST分型相似,亦将病因分为5种类型,即⼤动脉粥样硬化(large arteryatherosclerosis,LAA)、⼼源性卒中(cardiogenic stroke,CS)、穿⽀动脉疾病(penetratingartery disease,PAD)、其他病因(other etiology,OE)及病因不确定(undetermined etiology,UE),其中LAA 还按照部位分为主动脉⼸粥样硬化和颅内外⼤动脉粥样硬化。
第⼆步对颅内外⼤动脉粥样硬化性脑梗死的发病机制进⾏分型,分为4种类型:载体动脉(斑块或⾎栓) 堵塞穿⽀、动脉到动脉栓塞、低灌注/栓⼦清除下降及混合机制。
1.⼤动脉粥样硬化(LAA)在CISS分型中,⼤动脉粥样硬化(LAA) 包括主动脉⼸和颅内外⼤动脉粥样硬化。
主动脉⼸粥样硬化(1)急性多发梗死病灶,特别是累及双侧前循环和/或前后循环同时受累。
(2)没有与之相对应的颅内或颅外⼤动脉粥样硬化性病变(易损斑块或狭窄≥50%)的证据。
(3)没有⼼源性卒中(CS)潜在病因的证据。
(4)没有可以引起急性多发梗死灶的其他病因如⾎管炎、凝⾎异常及肿瘤性栓塞的证据。
(5)存在潜在病因的主动脉⼸动脉粥样硬化证据[经⾼分辨率磁共振(HR-MRI)/磁共振⾎管成像(MRA)和/或经⾷管超声(TEE)证实的主动脉⼸斑块≥4mm和/或表⾯有⾎栓]。

中国缺血性卒中亚型(急性缺血性卒中正确的临床分型对患者的急性期治疗、二级预防以及卒中相关研究如临床试验、流行病学和基因学研究都至关重要。
目前,在临床试验和临床实践中应用最为广泛的卒中分型系统是TOAST分型,该分型中沿用的概念主要来源于哈佛卒中登记分型和美国国家神经疾病与卒中研究所卒中数据库的分型标准。
最近国外又发表了两种新的卒中分型标准:SSS-TOAST和韩国改良TOAST分型,这两种分型都在原来TOAST分型基础上对动脉粥样硬化和小动脉闭塞的诊断标准进行了改良和优化。
而最近发表的A-S-C-O分型更适合于二级预防、临床试验以及基因相关研究。
但是,上述所有分型均忽视了穿支动脉粥样硬化疾病,也没有哪个分型再将大动脉粥样硬化所致缺血性卒中的病理生理机制进一步分类。
临床工作中,我们会看到这样的一些病人,穿支动脉区孤立梗死灶,直径不一定大于1.5cm,血管影像检查未发现载体动脉有狭窄,但这样的病人用已有的分类都被分到小动脉闭塞、小动脉疾病或小血管病,且现代的大多数神经科医生通常认为这就是小动脉玻璃样变引起的,而这显然不太符合疾病的临床过程,这样的病人尽管应用了抗血小板药或抗凝药物可能都无效,病情常常进展。
这样的临床表现不得不使人想到或许还是和穿支动脉口的病变有关,而我们以往的分型在这方面的考虑是有欠缺的,需要一个新的分型,把穿支动脉口的病变纳入到分型中去。
1随着影像学技术的不断进步如64 排CT、增强MRA(CEMRA)、CT 血管成像(CTA)、灌注CT、磁共振灌注成像(DWP)、高分辨MRI/MRA (HR-MRI/MRA)、TCD微栓子监测(TCD-MES)、经食道超声(TEE)以及心脏磁共振成像的出现,使得越来越多以前无法看到的病理结构和模棱两可的病灶可以很清晰地显示出来。
在这里我们要提出的是一个新的卒中分型诊断标准—中国缺血性卒中亚型(CISS)。
CISS 定义大动脉粥样硬化(LAA)CISS 分型中,大动脉粥样硬化(LAA)包括主动脉弓和颅内/颅外大动脉粥样硬化。

急性缺血性脑卒中的TOAST分型标准TOAST亚型分类标准根据临床特点及影像学、实验室检查,TOAST将缺血性脑卒中分为5个类型,各类型的病因不同,具体分类标准如下。
1.1 大动脉粥样硬化性卒中(LAA)这一类型患者通过颈动脉超声波检查发现颈动脉闭塞或狭窄(狭窄≥动脉横断面的50%)。
血管造影或MRA显示颈动脉、大脑前动脉、大脑中动脉、大脑后动脉、椎基底动脉狭窄程度≥50%。
其发生是由于动脉粥样硬化所致。
患者如出现以下表现,对诊断LAA有重要价值,(1)病史中曾出现多次短暂性脑缺血发作(TIA),多为同一动脉供血区内的多次发作;(2)出现失语、忽视、运动功能受损症状或有小脑、脑干受损症状;(3)颈动脉听诊有杂音、脉搏减弱、两侧血压不对称等;(4)颅脑CT或MRI检查可发现有大脑皮质或小脑损害,或皮质下、脑干病灶直径>1.5 cm,可能为潜在的大动脉粥样硬化所致的缺血性脑卒中;(5)彩色超声波、经颅多普勒超声(TCD)、MRA或数字减影血管造影(DSA)检查可发现相关的颅内或颅外动脉及其分支狭窄程度>50%,或有闭塞;(6)应排除心源性栓塞所致的脑卒中。
1.2 心源性脑栓塞(CE)这一类型是指包括多种可以产生心源性栓子的心脏疾病所引起的脑栓塞。
(1)临床表现及影像学表现与LAA相似;(2)病史中有多次及多个脑血管供应区的TIA或卒中以及其他部位栓塞;(3)有引起心源性栓子的原因,至少存在一种心源性疾病。
1.3 小动脉闭塞性卒中或腔隙性卒中(SAA)患者临床及影像学表现具有以下3项标准之一即可确诊。
(1)有典型的腔隙性梗死的临床表现,影像学检查有与临床症状相对应的卒中病灶的最大直径<1.5 cm;(2)临床上有非典型的腔隙梗死的症状,但影像学上未发现有相对应的病灶;(3)临床上具有非典型的腔隙性梗死的表现,而影像学检查后发现与临床症状相符的<1.5 cm的病灶。
1.4 其他原因所致的缺血性卒中(SOE)SOE临床上较为少见,如感染性、免疫性、非免疫血管病、高凝状态、血液病、遗传性血管病以及吸毒等所致急性脑梗死。


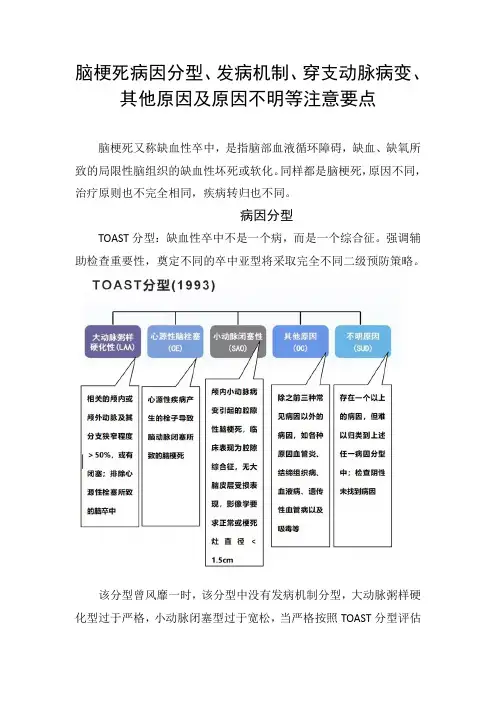
脑梗死病因分型、发病机制、穿支动脉病变、其他原因及原因不明等注意要点脑梗死又称缺血性卒中,是指脑部血液循环障碍,缺血、缺氧所致的局限性脑组织的缺血性坏死或软化。
同样都是脑梗死,原因不同,治疗原则也不完全相同,疾病转归也不同。
病因分型TOAST分型:缺血性卒中不是一个病,而是一个综合征。
强调辅助检查重要性,奠定不同的卒中亚型将采取完全不同二级预防策略。
该分型曾风靡一时,该分型中没有发病机制分型,大动脉粥样硬化型过于严格,小动脉闭塞型过于宽松,当严格按照TOAST分型评估时会发现临床中不明原因的分型过多。
表1缺血性卒中病因分型的主要类型CISS分型:对TOAST分型缺点进行改良,并在大动脉粥样硬化型病因中提出了发病机制分型,该分型中没有小动脉闭塞型,而是穿支动脉疾病,两者是完全不同的。
CISS分型中病因为大动脉粥样硬化的发病机制包括载体动脉(斑块或血栓)阻塞穿支动脉、动脉-动脉栓塞、低灌注/栓子清除率下降以及混合机制。
(1)载体动脉(斑块或血栓)阻塞穿支动脉穿支动脉分布区的急性孤立梗死灶,载体动脉存在斑块或任何程度狭窄的证据。
例如,发生在基底节区的急性孤立梗死灶,在同侧MCA分布区不存在其它急性梗死病灶;或者在脑桥发生的急性孤立梗死灶,而在基底动脉供血区内不存在其他急性梗死病灶。
该急性孤立梗死灶是甶载体动脉的斑块突出后堵塞了穿支动脉的血流所致。
图4 左侧基底节区急性孤立性梗死灶,同侧MCA狭窄图5 脑梗死发病机制示意图(2)动脉-动脉栓塞影像学上显示在粥样硬化的颅内外大动脉分布区内的皮层小的梗死灶或单发的区域性梗死灶。
在该病变血管分布区内不存在与之相关的分水岭区梗死。
如果病灶为多发,或者虽为单一梗死病灶但在TCD上发现微栓子信号,则该诊断可以明确。
但是,即使皮层梗死病灶为单发或者虽有流域性梗死,但TCD未发现微栓子信号也可以诊断动脉-动脉栓塞。
图6 左侧MCA供血区皮层多发急性梗死灶,左侧MCA无严重狭窄,左侧ICA末端重度狭窄图7 脑梗死发病机制示意图(3)低灌注/栓子清除下降此类机制的梗死病灶仅位于分水岭区。

缺血性脑卒中CISS分型中国缺血性卒中亚型急性缺血性卒中正确的临床分型对患者的急性期治疗、二级预防以及卒中相关研究如临床试验、流行病学和基因学研究都至关重要。
从经典的TOAST分型,到SSS-TOAST和韩国改良TOAST分型,以及A-S-C-O分型都越来越适合于缺血性脑卒中的二级预防、临床试验以及基因相关研究。
但是,上述所有分型均忽视了穿支动脉粥样硬化疾病,也没有哪个分型再将大动脉粥样硬化所致缺血性卒中的病理生理机制进一步分类。
随着影像学的进步,使得越来越多以前无法看到的病理结构和模棱两可的病灶可以很清晰地显示出来。
一个新的卒中分型诊断标准—中国缺血性卒中亚型(CISS)诞生。
CISS 定义大动脉粥样硬化(LAA)CISS 分型中,大动脉粥样硬化(LAA)包括主动脉弓和颅内/颅外大动脉粥样硬化。
1.主动脉弓粥样硬化1)急性多发梗死病灶,特别是累及双侧前循环和/或前后循环同时受累;2)没有与之相对应的颅内或颅外大动脉粥样硬化性病变(易损斑块或狭窄≥50%)的证据;3)没有心源性卒中(CS)潜在病因的证据;4)没有可以引起急性多发梗死灶的其他病因如血管炎、凝血异常以及肿瘤性栓塞的证据;5)存在潜在病因的主动脉弓动脉粥样硬化证据(经高分辨MRI/MRA和/或经食道超声证实的主动脉弓斑块≥4mm和/或表面有血栓)。
2.颅内外大动脉粥样硬化1)无论何种类型梗死灶(除外了穿支动脉区孤立梗死灶),有相应颅内或颅外大动脉粥样硬化证据(易损斑块或狭窄≥50%)。
2)对于穿2支动脉区孤立梗死灶类型,以下情形也归到此类:其载体动脉有粥样硬化斑块(HR-MRI)或任何程度的粥样硬化性狭窄(TCD、MRA、CTA 或DSA);3)需排除心源性卒中;4)排除其他可能的病因。
心源性卒中(CS)诊断标准:1、急性多发梗死灶,特别是累及双侧前循环或前后循环共存的在时间上很接近的包括皮层在内的梗死灶;2、无相应颅内外大动脉粥样硬化证据;3、不存在能引起急性多发梗死灶的其他原因,如血管炎、凝血系统疾病、肿瘤性栓塞等;4、有心源性卒中证据;5、如果排除了主动脉弓粥样硬化,为肯定的心源性,如果不能排除,则考虑为可能的心源性。

脑梗死TOAST分型及分型标准
脑梗死是指脑血管病的一种,是由于脑血管内血栓或栓子导致脑部血液循环中断而引起的脑组织缺血性坏死。
脑梗死TOAST分型及分型标准是指根据不同的病因因素将脑梗死分为不同的类型,并制定相应的诊断标准。
根据TOAST分型,脑梗死可以分为5种类型:大动脉粥样硬化型(LAA)、心源性栓子型(CE)、小动脉病变型(SVO)、其他原因型(OTH)和未能确定原因型(UND)。
其中,大动脉粥样硬化型是最常见的类型。
大动脉粥样硬化型是指由于大脑血管内粥样硬化斑块形成或破裂导致血栓形成而引起的脑梗死。
其诊断标准包括:①有明确的大动脉粥样硬化病史;②脑血管影像学检查显示大动脉粥样硬化斑块;③临床表现符合脑梗死的特点。
心源性栓子型是指由于心脏疾病导致血栓形成而引起的脑梗死。
其诊断标准包括:①有明确的心脏病史;②脑血管影像学检查显示有源性心脏疾病;③临床表现符合脑梗死的特点。
小动脉病变型是指由于小脑血管病变导致的脑梗死。
其诊断标准包括:①脑血管影像学检查显示病变在小脑血管;②临床表现符合脑梗死的特点。
其他原因型是指由于其他病因因素导致的脑梗死。
其诊断标准包括:①有明确的其他病因因素;②脑血管影像学检查显示相应的病变;③临床表现符合脑梗死的特点。
未能确定原因型是指无法确定脑梗死具体病因的类型。
其诊断标准包括:①无法确定脑梗死具体病因;②脑血管影像学检查显示相应的病变;③临床表现符合脑梗死的特点。
解读:中国缺血性卒中亚型——CISS分型卒中是一种异质性很强的疾病,不同类型的卒中(脑梗死、脑出血) 其所包含的病因也各不相同。
缺血性卒中亦是如此,从一种“疾病” 到一种“临床综合征”观念的转变,人们对缺血性卒中的认识逐渐深刻,并开始基于病因对不同的缺血性卒中患者“对因施治”,这一过程是伴随着缺血性卒中病因学研究的不断发展而不断进步的,而以循证医学为基础逐渐发展的缺血性卒中治疗指南和治疗手段也随之发生了革命性的变化。
缺血性卒中的病因学分型是临床试验、流行病学调查、基因研究及临床实践中治疗决策制定的基础。
中国缺血性卒中亚型——CISS分型该标准体系的分型过程分为两步:第一步同经典的TOAST分型相似,亦将病因分为5种类型,即大动脉粥样硬化(large arteryatherosclerosis,LAA)、心源性卒中(cardiogenic stroke,CS)、穿支动脉疾病(penetratingartery disease,PAD)、其他病因(other etiology,OE)及病因不确定(undetermined etiology,UE),其中LAA 还按照部位分为主动脉弓粥样硬化和颅内外大动脉粥样硬化。
第二步对颅内外大动脉粥样硬化性脑梗死的发病机制进行分型,分为4种类型:载体动脉(斑块或血栓) 堵塞穿支、动脉到动脉栓塞、低灌注/栓子清除下降及混合机制。
1.大动脉粥样硬化(LAA)在CISS分型中,大动脉粥样硬化(LAA) 包括主动脉弓和颅内外大动脉粥样硬化。
主动脉弓粥样硬化(1)急性多发梗死病灶,特别是累及双侧前循环和/或前后循环同时受累。
(2)没有与之相对应的颅内或颅外大动脉粥样硬化性病变(易损斑块或狭窄≥50%)的证据。
(3)没有心源性卒中(CS)潜在病因的证据。
(4)没有可以引起急性多发梗死灶的其他病因如血管炎、凝血异常及肿瘤性栓塞的证据。
(5)存在潜在病因的主动脉弓动脉粥样硬化证据[经高分辨率磁共振(HR-MRI)/磁共振血管成像(MRA)和/或经食管超声(TEE)证实的主动脉弓斑块≥4mm和/或表面有血栓]。
缺血性卒中的分型——从原始TOAST到ASCO分型422ChinJStroke,May2011,Vol6,No.5classificationusingtheTrialofORG10172inAcuteCCS-TOAST分型成功的减少了不明原因卒中StrokeTreatment(TOAST)criteria[J].Stroke,2001,的比例,ASCO第1级分型中,大动脉粥样硬化32:1091-1098.的比例增加及小血管病的比例减少,可惜不明10MeschiaJF,BarrettKM,ChukwudelunzuF,etal.InterobserverAgreementintheTrialofOrg10172in原因卒中的比例并没有减少,不过3种分型系统AcuteStrokeTreatmentClassificationofStrokeBased[19]的一致性都显示良好的结果。
结合我们的努onRetrospectiveMedicalRecordReview[J].JStroke力,希望未来能发展出适合中国人的缺血性卒CerebrovascDis,2006,15:266-272.11AyH,FurieKL,SinghalA,etal.Anevidence-based中分型,进一步研究验证其信效度。
causativeclassificationsystemforacuteischemicstroke[J].AnnNeurol,2005,58:688-697.12AyH,BennerT,ArsavaEM,etal.Acomputerized参考文献algorithmforetiologicclassificationofischemic1AdamsHPJr,BendixenBH,KappelleLJ,etstroke:theCausativeClassificationofStrokeal.ClassificationofsubtypeofacuteischemicSystem[J].Stroke,2007,38:2979-2984.stroke.Definitionsforuseinamulticenterclinical13KangDW,ChalelaJA,EzzeddineMA,etal.trial.TOAST.TrialofOrg10172inAcuteStrokeAssociationofischemiclesionpatternsonearlyTreatment[J].Stroke,1993,24:35-41.diffusion-weightedimagingwithTOASTstroke2MohrJP,CaplanLR,MelskiJW,etal.TheHarvardsubtypes[J].ArchNeurol,2003,60:1730-1734.CooperativeStrokeRegistry:aprospectiveregistry[J].14WesselsT,WesselsC,EllsiepenA,etal.ContributionNeurology,1978,8:754-762.ofDiffusion-WeightedImaginginDeterminationof3BogousslavskyJ,VanMelleG,RegliF.TheLausanneStrokeEtiology[J].AJNRAmJNeuroradiol,2006,StrokeRegistry:analysisof1000consecutivepatients27:35-39.withfirststroke[J].Stroke,1988,9:1083-1092.15ArsavaEM,BallabioE,BennerT,etal.TheCausative4FoulkesMA,WolfPA,PriceTR,etal.TheClassificationofStrokesystem:aninternationalStrokeDataBank:design,methods,andbaselinereliabilityandoptimizationstudy[J].Neurology,2010,characteristics[J].Stroke,1988,19:547-554.75:1277-1284.5BamfordJ,DennisM,SandercockP,etal.The16HanSW,KimSH,LeeJY,etal.Anewsubtypefrequency,causesandtimingofdeathwithin30days classificationofischemicstrokebasedontreatmentofafirststroke:theOxfordshireCommunityStrokeandetiologicmechanism[J].EurNeurol,2007,Project[J].JNeurolNeurosurgPsychiatry,1990,57:96-102.53:824-829.17AmarencoP,BogousslavskyJ,CaplanLR,etal.6PittockSJ,MeldrumD,HardimanO,etal.TheNewApproachtoStrokeSubtyping:TheA-S-C-O OxfordshireCommunityStrokeProjectclassification:(Phenotypic)ClassificationofStroke[J].Cerebrovasccorrelationwithimaging,associatedcomplications, Dis,2009,27:502-508. andpredictionofoutcomeinacuteischemicstroke[J]. 18HakanAy.AdvancesintheDiagnosisofEtiologic JStrokeCerebrovascDis,2003,12:1-7. SubtypesofIschemicStroke[J].CurrNeurolNeurosci 7AmarencoP,BogousslavskyJ,CaplanLR,etal. Rep,2010,10:14-20. Classificationofstrokesubtypes[J].CerebrovascDis, 19MarnaneM,DugganCA,SheehanOC,etal.Stroke 2009,27:493-501. subtypeclassificationtomechanism-specificand8MaddenKP,KaranjiaPN,AdamsHPJr,etal. undeterminedcategoriesbyTOAST,A-S-C-O,and Accuracyofinitialstrokesubtypediagnosisinthe causativeclassificationsystem:directcomparisonin TOASTstudy.TrialofORG10172inAcuteStroke theNorthDublinpopulationstrokestudy[J].Stroke, Treatment[J].Neurology,1995,45:1975-1979. 2010,41:1579-1586.9GoldsteinLB,JonesMR,MatcharDB,etal.(收稿日期:2010-12-23)Improvingthereliabilityofstrokesubgroup。