最新大学无机化学基础第15章 氧族元素
- 格式:ppt
- 大小:4.55 MB
- 文档页数:7







无机化学《氧族元素》教案教学要求]1. 掌握臭氧、过氧化氢的结构和性质。
2. 掌握硫化氢的特性及硫化物的水溶性。
3. 了解掌握硫的氧化物、含氧酸及其盐的结构、一般性质及用途。
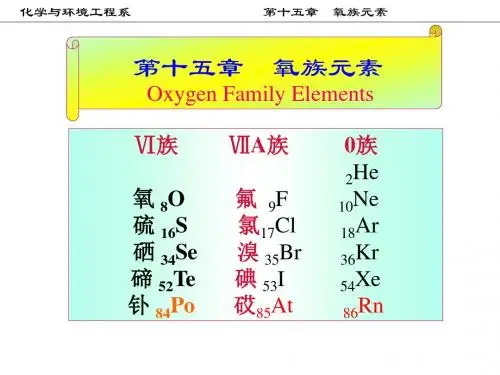
[ 教学重点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构、制备和性质[ 教学难点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构和性质[ 教学时数]6 学时[ 教学内容]1. 氧族元素的通性2. 氧及其化合物3. 硫及其化合物15-1 氧族元素的通性一、氧族元素的存在氧族元素有氧、硫、硒、碲和钋五种元素。
氧是地球上含量最多,分布最广的元素。
约占地壳总质量的46.6% 。
它遍及岩石层、水层和大气层。
在岩石层中,氧主要以氧化物和含氧酸盐的形式存在。
在海水中,氧占海水质量的89% 。
在大气层中,氧以单质状态存在,约占大气质量的23% 。
硫在地壳中的含量为0.045% ,是一种分布较广的元素。
它在自然界中以两种形态出现棗单质硫和化合态硫。
天然的硫化合物包括金属硫化物、硫酸盐和有机硫化合物三大类。
最重要的硫化物矿是黄铁矿FeS2,它是制造硫酸的重要原料。
其次是黄铜矿CuFeS2、方铅矿PbS 、闪锌矿ZnS 等。
硫酸盐矿以石膏CaSO 4· 2H 2 O 和Na2SO 4 · 10H 2 O 为最丰富。
有机硫化合物除了存在于煤和石油等沉积物中外,还广泛地存在于生物体的蛋白质、氨基酸中。
单质硫主要存在于火山附近。
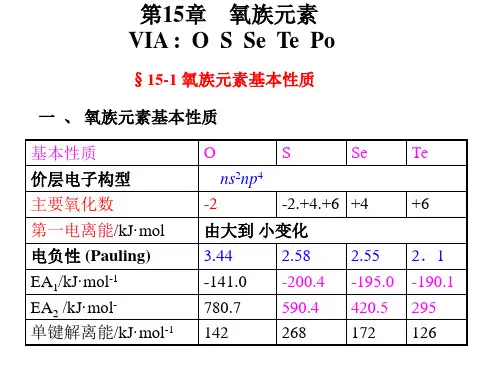
二、氧族元素的基本性质氧族元素的一些基本性质性质氧硫硒碲原子序数原子量价电子构型常见氧化态815.992s 2 2p 4-2,-1,01632.063s 2 3p 4-2,0,+2,+4,+63478.964s24p 4-2,0,+2,+4,+652127.605s 2 5p 4-2,0,+2,+4,+6共价半径/pmM 2 - 离子半径/pm第一电离能/(kJ/mol)第一电子亲合能/(kJ/mol) 第二电子亲合能/(kJ/mol) 单键解离能/(kJ/mol)电负性(Pauling 标度) 661401314141-7801423.441041841000200-5902262.58117198941195-4201722.55137221869190-2951262.10三、氧族元素的电极电势氧的电势图:2.07 0.68 1.77φ A θ / V O 3 ——— O 2——— H 2 O 2 ——— H 2 O1.24 –0.08 0.87φ B θ / V O 3 ——— O 2 ——— HO 2 -——— OH –硫的电势图:2.05 0.20 0.40 0.50 0.14φ A θ / V S 2 O 82 -——— SO 4 2 -——— H 2 SO 3 ——— S 2 O 3 2 - ——— S ——— H 2 S-0.92 -0.58 -0.74 -0476φ B θ / V SO 4 2 - ——— SO 3 2 - ——— S 2 O 3 2 -——— S ——— S 2 -15-2 氧及其化合物一、单质氧自然界中的氧含有三种同位素,即16 O 、17 O 和18 O ,在普通氧中,16 O 的含量占99.76% ,17 O 占0.04% ,18 O 占0.2% 。

第十五章氧族元素之教案15-1 氧族元素的通性15-1.1:总结氧族元素通性的变化规律.(C级掌握)解:氧族元素原子的价电子层结构ns2np4,常见氧化态有-2,0,+2,+4,+6.从上到下随着原子半径依次增大,电离势和电负性依次减小,第一电子亲合势依次减小(O反常的小于S),即放热依次减少.X2解离能依次减小(O2反小于S2除外).本族元素从上到下非金属性依次减弱,金属性逐渐增强.15-1.2:为什么氧族元素的氧化态为偶数(-2,+2,+4,+6)?(B级掌握)解:氧族元素的价电子轨道排布式为:ns2np2xnp1ynp1z当失去电子时,首先是np1y和np1z上的这两个电子同时失去而显+2氧化态.继续失电子时,因同一原子轨道中的两个电子性质相同,所以同时失去而显+4氧化态,依次为+6.得到2个电子达稳定构型显-2,所以其氧化态均为偶数.2。
与同周期的卤素元素比较(C级掌握)15-1.3:为什么氧族元素的非金属活泼性和电负性均小于同周期的卤素元素?(C级掌握)解:因为氧族元素的原子序数比卤素元素的小1,则其原子半径大,有效核电荷小,则获得电子形成X2-的倾向比卤素形成X-的小,所以非金属活泼性和电负性均小于同周期的卤素元素.3。
氧族元素从上到下正氧化态的稳定性逐渐增加。
二:氧的特殊性(C级重点掌握)(1)电子亲合势:O<S(原因同卤素的F<Cl)(2)解离能:O-0<S-S(原因同卤素的F2<Cl2)(3)氧在正常化合物中的氧化数均为-Ⅱ,OF2、H2O2等例外。
氧可形成强的双键,而S,Se,Te形成双键的倾向越来越小.15-1.4:硫与氧相比,为什么氧易形成p-p的π键,而硫却难以形成?(B级掌握)解:因p-pπ键形成的有效性高低与原子的半径大小有关,对于第二周期的原子,半径较小,其两条2p轨道肩并肩重叠的有效性高,形成的π键稳定.而S在第三周期,原子半径大,由两条3p轨道肩并肩形成的π键稳定性较差(远低于S-S单键).三:氧族元素的存在(了解)15-2 氧及其化合物15-2-1 氧气单质(了解)一:氧气的结构二:氧气的性质氧的化学性质很活泼,除稀有气体、卤素、氮气和一些贵金属外,其余元素都能和氧直接化合. 三:氧气的制备15-2.1:指出工业上和实验室制备氧气的方法(C级了解)解:工业上制备氧气主要是通过物理方法(即先将空气降温到临界温度以下,并加大压力)使空气液化,然后分馏得到氧气.经过反复分馏提纯后压入高压钢瓶中储存和使用实验室最常用的方法是以二氧化锰为催化剂加热(约473K)使KClO3分解得到氧气.四:氧气的用途15-2-2 氧化物一:氧化物的分类15-2.2:总结氧化物按三种不同标准进行的分类情况,并各举一例说明(C级了解)解:(1)以氧的氧化态不同分为普通氧化物(如Na2O),过氧化物(如Na2O2),超氧化物(如KO2),臭氧化物(如KO3)和复杂氧化物(如Fe3O4).(2)以酸碱性不同分为酸性(如V2O5),碱性(如MgO),两性(如Cr2O3)和中性(如CO).(3)以价键特征不同分为离子型(碱金属和碱土金属氧化物MI2O和MⅡO以及低氧化态的金属氧化物),共价型(高氧化态的金属氧化物如Mn2O7和非金属氧化物如NO2)和过渡型(离子型含部分共价性如BeO,CuO和共价型含部分离子性如Ag2O,GeO2).二:氧化物的酸碱性(C级掌握)15-2.3:总结氧化物在周期表中的酸碱性变化规律(C级掌握)解:总体规律:(1)活泼金属氧化物显碱性,典型非金属氢化物显酸性或中性.(2)同一元素低氧化态的氧化物偏碱性,高氧化态的氧化物偏酸性,中间氧化态的氧化物显两性.(3)同一主族从上到下族价氧化物酸性减弱,碱性增强;同一周期从左到右碱性减弱,酸性增强.副族变化规律性差.15-2-3 臭氧一: 臭氧的存在和保护作用(P490-491)二:臭氧的产生(了解)三:臭氧的性质(C级掌握)臭氧是淡蓝色,俱鱼腥臭味的气体。