第十五章 氧族元素
氧族元素
氮族元素概述
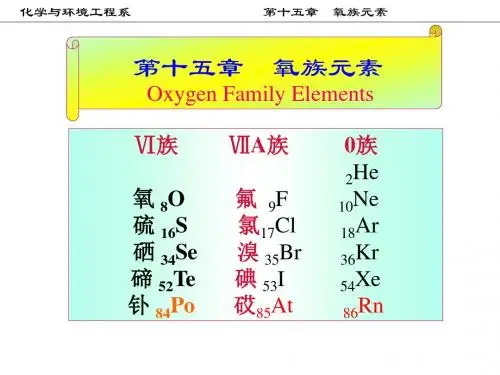
氧族 (VIA) 元素 存在 价层电子构 型 电负性 氧化值 O 非金属 S Se 准金属 Te Po 放射性金属
金属性逐渐增强,非金属性减弱 单质或矿物 共生于重金属硫化物中
2s22p4 3.44
-2, (- 1)
3s23p4 2.58 ±2,4,6 分子 晶体
实验室制法
BaO2+H2SO4=BaSO4↓+H2O2 BaO2+CO2+H2O=BaCO3↓+H2O2
阳极:2HSO4-=S2O82-+2H++2e阴极:2H+ + 2e-=H2↑
工业制法
S2O82-+2H2O=H2O2+2HSO4-
化学与环境工程系
第十五章 氧族元素
乙基蒽醌法
只要求了解
H2O2 是一种重要的化学试剂,常用做 漂白剂和消毒剂, 3% 的过氧化氢称为双 氧水,用于伤口消毒。在航天工业上, 可作为火箭发射的燃料。
化学与环境工程系
乙醚
第十五章 氧族元素
Cr2O72- + 2H2O2 + 2H+ == 5H2O + 2CrO5
(蓝色加合物)
此反应用于铬酸根的检验,加合 物不稳定,在水溶液中很快分解, 常加入一些乙醚萃取,使其稳定. 不稳定性 过氧化氢受热、遇光或重金属离子Mn2+、Fe3+、Cr3+分解: 2H2O2====2H2O+O2 它在碱性介质中的分解更快,应保存在棕色瓶中,放于阴 凉地方,还可加入些稳定剂如锡酸钠、焦磷酸钠或8-羟基 喹啉等。
电负性:氧仅次于氟
熔点、沸点、随半径的增大而增 大;第一电离势和电负性则变小。