实验十二 凋亡细胞的诱导与光镜下形态观察
- 格式:ppt
- 大小:1.32 MB
- 文档页数:7

实验项目名称细胞凋亡的显示一、实验目的1.了解细胞凋亡的形态学观察2.掌握荧光显微镜的使用方法二、实验原理1.细胞凋亡,是由基因编辑控制的细胞主动参与的自杀过程,是一种生理性调节机制。
细胞发生凋亡时,在组织中是呈单个细胞发生;细胞体积浓缩:细胞器完整,细胞膜完好;细胞核浓缩、碎裂(染色质浓缩),有规律性的断裂成核碎片。
细胞凋亡过程中细胞核染色质的形态学改变分为三期:1期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;b期的细胞核裂解为碎块,产生凋亡小体。
2.顺铂等肿瘤化疗药物可以作为细胞凋亡诱导剂诱导细胞凋亡。
三、实验仪器与试剂1.材料:A549肺癌细胞2.仪器:荧光显微镜3.试剂:0.01mM PBS, 4%多聚甲醛,DAPI染料4.其它:盖玻片、载玻片、细胞培养板、移液枪、封口膜、烧杯、滤纸、滴管,吸水纸等。
四、实验步骤(一)荧光显微镜使用步骤○1将已处理好的样本放到载物台上○2将10X物镜转入光路,调节载物台纵横移动手轮,将标本移入光路○3调节滤光片转换器,选择3档UV光观察:○4调节粗条手轮,看清荧光图片轮廓后,再调节微调手轮调节,直至看到清晰的荧光图像。
○5推出摄影/目视切换杆,电脑拍照(二)观察细胞凋亡1. 盖玻片置于细胞培养皿中,二氧化碳培养箱培养A549肺癌细胞24h,形成细胞爬片;随后加入浓度为3ug/ml的顺铂培养24h,诱导细胞凋亡;2. 取出细胞培养皿,吸出培养基;3. PBS洗涤2次:加入2ml PBS,静置2min,吸出;重复操作一次;4. 加入2ml 37℃预温过的 4%多聚甲醛固定细胞10min;5. 在干净的封口膜中滴加20ul稀释好的DAPI,小心取出细胞爬片,细胞面向下避光孵育10min;6. PBS 洗涤2次:吸水纸吸干DAPI,在爬片一端用注射器加入PBS约0.1ml,吸水纸在爬片另一端吸出PBS(虹吸法);重复操作一次。
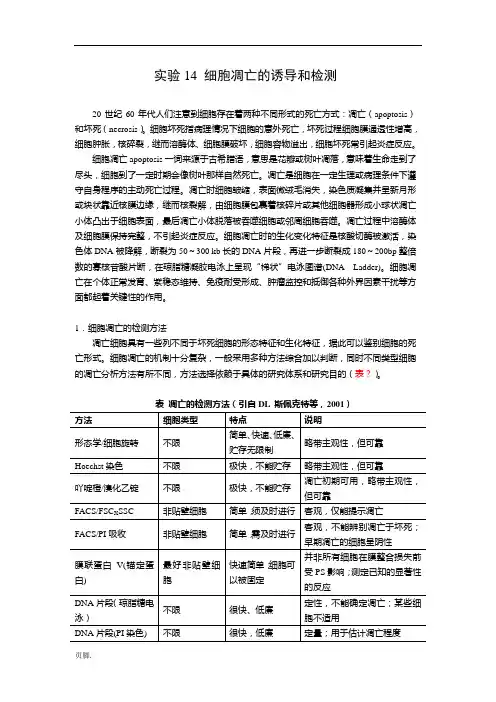
实验14 细胞凋亡的诱导和检测20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。
细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞容物溢出,细胞坏死常引起炎症反应。
细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。
凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。
凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。
凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。
细胞凋亡时的生化变化特征是核酸切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。
细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。
1.细胞凋亡的检测方法凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。
细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征:(1)DAPI时常用的一种与DNA结合的荧光染料。
借助于DAPI染色,可以观察细胞核的形态变化。
(2)Giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。
(3)吖啶橙(AO)染色,荧光显微镜观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜侧,可见细胞膜呈泡状膨出及凋亡小体。

细胞凋亡的几种检测方法Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】细胞凋亡的几种检测方法1、形态学观察方法(1)HE(苏木精—伊红染色法)染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
(2)丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(3)台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
(4)透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
2、 DNA凝胶电泳细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带3、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体’3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’4、加酶的底物,测光吸收制。
用途该法敏感性高,可检测5*100/ml个凋亡细胞。


细胞凋亡的诱导及检测一、实验目的1、了解细胞凋亡的诱导及检测。
2、了解细胞凋亡的机制及生物学意义。
二、实验原理细胞凋亡过程不同于坏死性死亡,其染色质断裂,细胞核破裂成裂片,细胞质浓缩,细胞体积变小,细胞膜内折,整个细胞通过起跑和发芽的方式形成一些大小不等凋亡小体,并逐渐被细胞周围的吞噬细胞吞噬。
在整个凋亡过程中,线粒体基本保持完好,细胞的内容物没有泄露,不会引起周围组织的炎症反应,凋亡的细胞核的核DNA 的断裂发生在核小体之间,因此产生的断裂DNA在电泳是会呈180至200dp整数倍大小的阶梯状条带,这是识别凋亡细胞的可靠生化特征,能诱导细胞凋亡的方法很多,在这里采用H202诱导细胞凋亡。
细胞凋亡的检测方法也很多,而形态学的观察方法更为方便,1、吖啶橙只进入活细胞,正常细胞及处于凋亡早期的细胞,从而将细胞染成绿色而嗅化乙啶(EB)只进入死细胞,凋亡的细胞核染成橙红色,2、是一种荧光染料他可以与DNA双螺旋凹槽部分结合,可在紫外线下激发蓝光也可以用于观察凋亡的细胞。
三、实验材料1、酿酒酵母,2、荧光显微镜,3、8.8mol/LH2O2,4、AO/EB的PBS溶液5、酿酒酵母培养基,6、DAPI溶液台盼蓝四、实验步骤1、使用马铃薯培养基恒温30摄氏度,在振荡条件下培养24h再用3500rpm×10min 除去上清液,再用去离水洗涤,沉淀即湿菌体。
2、取上述酵母湿菌体,加双氧水2ml,在室温下缓慢振荡24h后加入乙醇,室温固定10min。
3、去掉乙醇,用PBS洗净。
4、染色DAPI染色法,加入500ml的PBS和50ul的DAPI的母液染色约10min置显微镜下观察。
AO/ EB染色法:取25ml上述悬浮细胞于载玻片上加入AO/ EB混合液,再从中取10ml 于载玻片上加一滴台盼蓝,染色5至10min,盖上盖玻片,放在荧光显微镜下观察。
五、实验结果DAPI:有的细胞染色均匀且表面光滑为正常细胞,有的细胞染色不均表面不光滑,核轮廓不规则,这是凋亡前期的细胞,有的细胞核固缩染色体凝聚边缘化,为凋亡中期细胞有的细胞崩解成碎片可看见颗粒状碎片,这是凋亡后期碎片。

山东大学实验报告2018年5月28日________________________________________ _________________________姓名:丁志康系年级:2016级组别:周一下午科目:细胞生物学实验题目:细胞凋亡的诱导及观察学号:201600140055一、实验目的1.学习细胞凋亡的简史、概念和原理。
2.了解细胞凋亡的检测方法。
3.掌握诱导和形态学观察动植物细胞凋亡的基本方法。
二、实验原理1.细胞凋亡细胞凋亡(apoptosis)指为维持内环境稳定,由基因控制的细胞自主的有序的死亡,也称细胞程序性死亡。
细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。
2.细胞凋亡的生理意义1)维持生物体内环境的稳定;2)参与防御反应;3)胚胎发育过程中清除一些细胞。
3.细胞凋亡的检测方法●细胞凋亡的形态学检测●磷脂酰丝氨酸外翻分析(Annexin V法)●线粒体膜势能的(△Ψmt)检测●DNA片段化检测●TUNEL法●Caspase-3活性的检测●WB检测●凋亡相关蛋白的表达和细胞定位分析4.细胞凋亡的形态学检测未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。
贴壁细胞出现皱缩、变圆、脱落。
染色细胞:常用姬姆萨染色、瑞氏染色等。
凋亡细胞的染色质浓缩、边缘化,核膜破裂、染色质分割成块状和凋亡小体等典型的凋亡形态。
5.细胞凋亡的诱导因素➢物理因素:射线、热休克、冷激等。
➢化学因素:重金属离子、激素、毒素、活性氧、一氧化氮等。
➢生物因素:病毒、细菌、肿瘤坏死因子、抗肿瘤药物、DNA和蛋白质合成抑制剂等。
6.细胞坏死细胞坏死(necrosis)被认为是因病理而产生的被动死亡,如物理性或化学性的损害因子及缺氧与营养不良等均导致细胞坏死。

实验14-细胞凋亡的诱导和检测实验14 细胞凋亡的诱导和检测20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。
细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞内容物溢出,细胞坏死常引起炎症反应。
细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。
凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。
凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。
凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。
细胞凋亡时的生化变化特征是核酸内切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。
细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。
1.细胞凋亡的检测方法凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。
细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
表凋亡的检测方法(引自DL 斯佩克特等,2001)方法细胞类型特点说明形态学/细胞旋转不限简单、快速、低廉、贮存无限制略带主观性,但可靠Hoechst染色不限极快,不能贮存略带主观性,但可靠吖啶橙/溴化乙锭不限极快,不能贮存凋亡初期可用,略带主观性,但可靠FACS/FSC X SSC 非贴壁细胞简单,须及时进行客观,仅能提示凋亡FACS/PI吸收非贴壁细胞简单,需及时进行客观,不能辨别凋亡于坏死;早期凋亡的细胞呈阴性膜联蛋白V(锚定蛋白) 最好非贴壁细胞快速简单;细胞可以被固定并非所有细胞在膜整合损失前受PS影响;测定已知的显著性的反应DNA片段(琼脂糖电泳)不限很快、低廉定性,不能确定凋亡;某些细胞不适用DNA片段(PI染色) 不限很快,低廉定量;用于估计凋亡程度DNA片段(JAM 分析) 循环细胞低廉,可分析多种类混合定量,不能确定凋亡含量;不能用于所有细胞TUNEL 不限昂贵,耗时定量,常被认为可靠(尽管应该结合形态学评价)线粒体膜电位损不限低廉,不能确定凋失快速亡,并非次生坏死前的所有细胞都适用caspase活化(蛋白酶活性) 不限中等花费,很快目前不能确定凋亡,但适用于监测器;不能鉴别特定激活的caspasescaspase活化(caspase免疫印迹) 不限中等花费可以鉴别特定激活的caspases;依赖于抗体的有效性caspase活化(基质免疫印迹) 不限中等花费通过特异切割反应测定caspase活化;如这些反应功能可确定形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征:(1)DAPI时常用的一种与DNA结合的荧光染料。

检测细胞凋亡的实验方法一、形态学观察方法1、HE染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
2、丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
3、台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
4、透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
二、DNA凝胶电泳(一)、检测原理细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
(二)结果判断正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带。
三、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
(一)检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体’3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’4、加酶的底物,测光吸收制。
(二)用途该法敏感性高,可检测5*100/ml个凋亡细胞。
可用于人、大鼠、小鼠的凋亡检测。
该法不需要特殊仪器,适合基层工作,但是不能精确测定凋亡细胞发生的绝多对量。

实验报告细胞凋亡的诱导与调控机制研究实验报告:细胞凋亡的诱导与调控机制研究引言在生物学研究领域,细胞凋亡作为一种重要的细胞死亡方式,一直受到广泛关注。
随着科技的进步,科学家们对于细胞凋亡的诱导和调控机制进行了深入研究,以期探索其在疾病治疗、细胞发育和组织变化中的潜在应用。
本实验旨在研究细胞凋亡的诱导与调控机制,以加深对其原理的理解。
材料与方法1. 细胞培养:使用XXX细胞系培养基,将细胞置于37℃、5% CO2的培养箱中。
2. 实验组设定:将细胞平均分为两组,实验组A和对照组B。
实验组A接受特定诱导剂处理,对照组B不进行任何处理。
3. 细胞凋亡检测:利用TUNEL法检测细胞凋亡程度,使用荧光显微镜观察实验组和对照组下凋亡细胞数量的差异。
4. 分子机制研究:采用Western blot和实时荧光定量PCR技术,检测关键凋亡相关蛋白的表达和基因表达水平。
结果与讨论经过实验,我们观察到以下结果:1. 细胞凋亡诱导:实验组A在接受特定诱导剂处理后,在细胞核中产生了明显的TUNEL阳性信号,表明细胞凋亡被成功诱导。
而对照组B则未出现明显的凋亡相关特征。
2. 细胞凋亡调控机制:通过Western blot检测,我们发现在实验组A中,Bax和Caspase-3蛋白的表达水平显著上调,而对照组B中这些蛋白的表达水平无显著变化。
这表明通过诱导剂的作用,Bax和Caspase-3被激活,并参与细胞凋亡的调控。
另外,实时荧光定量PCR结果显示,实验组A中凋亡相关基因的表达水平明显增加,而对照组B未见明显变化。
这进一步印证了凋亡的调控机制中基因表达的变化重要性。
综合结果分析,我们可以得出以下结论:1. 细胞凋亡可以被特定诱导剂成功激活,从而实现对细胞凋亡的处理。
2. 在细胞凋亡的调控机制中,Bax和Caspase-3等蛋白的上调发挥重要作用。
3. 细胞凋亡的调控还涉及到基因表达的改变,特定诱导剂可以引起相关基因的显著上调。


细胞凋亡(apoptosis)的形态学观察细胞凋亡(apoptosis)的命名主要是根据某些单个细胞死亡时细胞碎裂如花瓣或树叶散落般的形态学特征。
目前对细胞凋亡的认识正不断得到深化,检测凋亡细胞的方法也逐渐增多,但形态改变仍是确定细胞凋亡的最可靠的方法。
一、光学显微镜观察凋亡细胞的主要特征为核染色质致密深染,形成致密质块,有时可碎裂。
在HE染色的组织切片中细胞体积缩小,胞质致密、嗜酸性染色增强,并可形成凋亡小体。
在组织中凋亡细胞常以分散单个形式存在,凋亡细胞与周围细胞分离,不引起炎症反应。
本方法简便易行,但在细胞密集的组织中对于改变不典型的细胞判断较困难,常缺乏较为特征的指标,具有较强的主观性,重复性差。
本方法可用于调亡现象的初步观察,作为分析指标之一。
检测方法:细胞涂片或组织石蜡切片作HE染色或Giemsa染色,在高倍物镜下观察凋亡细胞的形态改变,结合显微测量工具可作凋亡细胞计数。
二、视频时差显微技术(video time-lapse microscopy)本方法用于细胞培养,通过相差显微镜可动态观察细胞凋亡的变化过程,尤其是观察细胞表和外形的变化。
凋胞与基质分离,胞体变圆、收缩、出泡,有的细胞拉长,出现钉状突起,特续数小时后细胞膜破裂,细胞溶解,通过连续观察,本方法可养壑培养中的凋亡细胞,但不能用于病理组织。
检测方法:收集2×105细胞/ml培胞,置于多孔培养板,加入凋亡诱导剂,在带有自动摄像装置的相差显微镜下观察凋亡细胞的动态改变,每隔分钟 30秒作序列摄影,连续24小时。
如同进进行荧光染色,可参荧光晃微镜下观察和摄影。
三、电子显微镜观察关于凋亡细胞的超微结构特征,包括透射电镜和扫描电镜下的改变,在许我文献中已有详尽描述。
凋亡细胞的典型形态改变如胞质的固缩,染色质浓缩成半月形或帽状附于核膜,核的碎裂和凋亡小体形成等,在透射电镜下得到最佳的体现。
为凋亡细胞判定提供了最可靠的依据。
本方法的缺点是样品制作过程较复杂,且仪器、设备的费用昂贵,较难广泛大量开展。
实验报告细胞凋亡的诱导与调控机制研究实验报告:细胞凋亡的诱导与调控机制研究一、前言细胞凋亡是一种重要的生理过程,对于维持细胞数量的平衡、清除受损或多余的细胞以及保证机体的正常发育和功能起着关键作用。
深入研究细胞凋亡的诱导与调控机制不仅有助于我们更好地理解生命的基本规律,还对多种疾病的治疗和预防具有重要的指导意义。
本实验旨在探究不同因素对细胞凋亡的诱导作用以及相关的调控机制。
二、实验材料与方法(一)实验材料1、细胞系:选用了人肝癌细胞系 HepG2 和人乳腺癌细胞系 MCF-7。
2、试剂:凋亡诱导剂如阿霉素、紫杉醇,凋亡检测试剂盒,细胞培养所需的培养基、血清等。
3、仪器:流式细胞仪、荧光显微镜、酶标仪等。
(二)实验方法1、细胞培养:将 HepG2 和 MCF-7 细胞分别培养在含有 10%血清的培养基中,置于 37°C、5% CO2 的培养箱中培养。
2、凋亡诱导:将处于对数生长期的细胞分别用不同浓度的阿霉素和紫杉醇处理,设置对照组(未加诱导剂),处理一定时间后收集细胞。
3、凋亡检测:采用流式细胞术检测细胞凋亡率,通过 Annexin VFITC/PI 双染法区分早期凋亡和晚期凋亡细胞。
同时,利用荧光显微镜观察细胞形态学变化,如细胞核浓缩、染色质边缘化等。
4、蛋白表达检测:通过 Western blot 技术检测凋亡相关蛋白如 Bax、Bcl-2、Caspase-3 等的表达水平。
三、实验结果(一)阿霉素诱导的细胞凋亡1、流式细胞术结果显示,随着阿霉素浓度的增加和处理时间的延长,HepG2 和 MCF-7 细胞的凋亡率逐渐升高。
在一定浓度范围内,凋亡率与阿霉素的浓度和处理时间呈正相关。
2、荧光显微镜下观察到,阿霉素处理后的细胞出现明显的细胞核浓缩、染色质边缘化等凋亡特征。
3、 Western blot 结果表明,阿霉素处理后,促凋亡蛋白 Bax 的表达水平显著上调,而抗凋亡蛋白 Bcl-2 的表达水平下降,Caspase-3 被激活并发生剪切。
实验报告细胞凋亡的诱导与调控机制研究实验报告:细胞凋亡的诱导与调控机制研究一、引言细胞凋亡是一种程序性细胞死亡过程,对于多细胞生物的发育、稳态维持和疾病发生等具有重要意义。
深入研究细胞凋亡的诱导与调控机制,有助于我们更好地理解生命现象,为疾病的诊断和治疗提供新的思路和方法。
二、实验目的本实验旨在探究不同因素对细胞凋亡的诱导作用,以及细胞内相关信号通路在凋亡调控中的机制。
三、实验材料与方法(一)实验材料1、细胞系:选用人肝癌细胞系 HepG2 和人乳腺癌细胞系 MCF-7。
2、试剂:凋亡诱导剂(如紫杉醇、顺铂),细胞凋亡检测试剂盒(如 Annexin VFITC/PI 凋亡检测试剂盒),细胞培养相关试剂(如培养基、血清、抗生素),蛋白提取和定量试剂盒,抗体(针对凋亡相关蛋白如 Bax、Bcl-2、Caspase-3 等)。
(二)实验方法1、细胞培养将 HepG2 和 MCF-7 细胞分别培养在含 10%胎牛血清、1%双抗的培养基中,置于 37°C、5% CO2 培养箱中培养。
待细胞融合度达到 80%左右时,进行传代培养。
2、细胞凋亡诱导将处于对数生长期的细胞接种于 6 孔板中,培养 24 小时后,分别加入不同浓度的凋亡诱导剂(紫杉醇、顺铂),设置对照组(仅加入等体积的溶剂),继续培养 24 48 小时。
3、细胞凋亡检测(1)Annexin VFITC/PI 双染法收集处理后的细胞,用 PBS 洗涤两次,然后加入 Annexin VFITC和PI 染液,室温避光孵育15 分钟,通过流式细胞仪检测细胞凋亡率。
(2)Hoechst 33258 染色将细胞接种于共聚焦培养皿中,处理后加入 Hoechst 33258 染液,孵育 10 分钟,在荧光显微镜下观察细胞核形态的变化,判断细胞凋亡情况。
4、蛋白提取与 Western blot 检测收集处理后的细胞,提取总蛋白,定量后进行 SDSPAGE 电泳,转膜,封闭,然后分别加入相应的一抗和二抗孵育,最后通过化学发光法检测凋亡相关蛋白(Bax、Bcl-2、Caspase-3 等)的表达水平。
细胞凋亡检测方法一、细胞凋亡的形态学检测1 光学显微镜和倒置显微镜(1)未染色细胞:凋亡细胞的体积变小、变形,全面皱缩,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体,凋亡小体为数个圆形小体围绕在细胞周围。
贴壁细胞出现皱缩、变圆、脱落。
(2)染色细胞:姬姆萨(Giemsa)染色、瑞氏染色等:正常细胞核色泽均一;凋亡细胞染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态;坏死细胞染色浅或没染上颜色。
苏木素-伊红(HE)染色:细胞核固缩碎裂、呈蓝黑色、胞浆呈淡红色(凋亡细胞),正常细胞核呈均匀淡蓝色或蓝色,坏死细胞核呈很淡的蓝色或蓝色消失。
2 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。
常用的DNA特异性染料有:Hoechst 33342,Hoechst 33258,DAPI。
三种染料与DNA 的结合是非嵌入式的,主要结合在DNA的A-T碱基区。
紫外光激发时发射明亮的蓝色荧光。
Hoechst是与DNA特异结合的活性染料,能进入正常细胞膜而对细胞没有太大细胞毒作用。
Hoechst 33342在凋亡细胞中的荧光强度要比正常细胞中要高。
DAPI为半通透性,用于常规固定细胞的染色。
PI和Hoechst33342双标:PI、Hoechst33342均可与细胞核DNA(或RNA)结合。
但PI不能通过正常细胞膜,Hoechst则为膜通透性荧光染料,故细胞在处于坏死或晚期调亡时细胞膜被破坏,这时可为PI着红色。
正常细胞和中早期调亡细胞均可被Hoechst着色,但是正常细胞核的Hoechst着色的形态呈圆形,淡兰色,内有较深的兰色颗粒;而调亡细胞的核由于浓集而呈亮兰色,或核呈分叶,碎片状,边集。
故PI着色为坏死细胞;亮兰色,或核呈分叶状,边集的Hoechst着色的为调亡细胞。
凋亡细胞体积变小,细胞质浓缩。
细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa 期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。
细胞调亡的几种检测方法一、形态学观察方法(一)、HE染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
(二)、丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(三)、台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
(四)、透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
二、DNA凝胶电泳(一)、检测原理细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
(二)结果判断正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带。
三、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
(一)检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体‟3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合…4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合‟5、加酶的底物,测光吸收制。
(二)用途该法敏感性高,可检测5*100/ml个凋亡细胞。
可用于人、大鼠、小鼠的凋亡检测。
该法不需要特殊仪器,适合基层工作,但是不能精确测定凋亡细胞发生的绝多对量。