大学物理
气体动理论
第9讲 气体分子的平均碰撞频率 和平均自由程
一、分子的平均碰撞频率
平均碰撞频率和平均自由程
平衡态宏观性质的维持 非平衡态向平衡态过渡
依靠分子间的频繁碰撞实现
刚性球 模型
不可以像讨论压强那样 将分子看成质点
不需像讨论内能那样考 虑分子内部结构
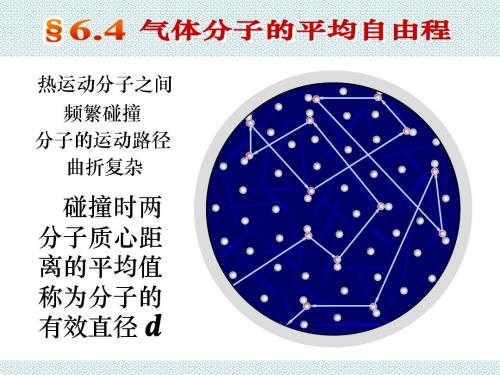
分子的有效直径 d 约为10-10 m
无引力刚 性球模型
=
1.013×105 1.38×10−23 × 273
=
2.69 ×1025 m−3
λ = 1 = 2.14 ×10−7 m 2π d 2n
z = v = 7.95×109 s−1
λ
(约80亿次)
平均碰撞频率和平均自由程
d d
假定: 分子是直径为d 的弹性小球
分子A以平均相对速率 u 运动, 其他分子静止 由麦克斯韦速率分布可证 u = 2 v
球心轨迹为轴, d 为半径作折圆柱体
平均碰撞频率和平均自由程
d d
球心在圆柱体内的分子将与A碰撞
单位时间内有 πd 2u n 个分子与A发生碰撞
平均碰撞频率: z = 2π d 2nv
• 当温度一定时,平均自由程与压强成反比,压强越小,平 均自由程越长.
平均碰撞频率和平均自由程
例. 求氢在标准状态下一秒内分子的平均碰撞次数. (已知 分子直径d = 2×10-10m )
解:
v=
8RT =
Mπ
8×8.31× 273
2 ×10−3π
= 1.70 ×103 m ⋅ s−1
n
=
P kT
二、平均自由程平均碰撞频率平均自由程平均自由程( λ ): 分子在连续两次和其它分子发生碰撞