ICH关于遗传毒性结果评价和追加试验策略指导原则--人用药物遗传毒性试验和结果分析指导原则介绍(三)
- 格式:docx
- 大小:18.22 KB
- 文档页数:5

浅析药物毒理学研究在新药研发中的作用药物安全和有效与否是决定药物能否研发成功的关键,在整个药物研发流程中,毒性是导致新药研发终止的原因之一。
因此对于创新药制剂来说,毒性问题是限制创新药研发成功的重要因素之一,如果在新药研发的整个流程中采用合适的药物毒理学研究,将会大大提高创新药研发的成功率。
药理毒理学研究贯穿于药物研发流程中,在新药发现、临床前安全性评价和上市后的监督与跟踪的整个过程中,都占有重要地位。
1、药物毒理学研究在新药发现阶段中的作用新药研究和开发处于药物研发流程中的早期阶段,在这个阶段如果对多种具有良好前景的候选新药的潜在毒性发现的越早,该药物研发的成功率也就越高。
倘若在药物发现阶段,建立短期高效毒性优化筛选系统,包括体内外毒性筛选、一般毒性筛选和特殊毒性筛选,涵盖原核和真核毒性筛选系统,将具有以下作用:(1)通过早期毒性优化筛选,筛选出更合适研发的化合物,可提高候选药物的质量,并减少药物开发循环的时间;(2)通过对基因表达、蛋白质和代谢产物数据系统性分析,建立更加适合于毒性预测的动物模型;(3)选择更精确的剂量和确定安全域MOS;(4)新的毒理学生物标志物可提高临床实验中的决策率;(5)根据毒理基因学的基因标志物将允许在后期研究和投放市场时选择最合适的病人群体,满足个体化治疗的需要。
2、药物毒理学研究在药物临床前安全性评价上的作用临床前药物安全性评价阶段的毒理学研究主要是为了满足安全和药物管理的要求进行药物安全性和作用靶器官研究。
主要是依据ICH和OECD指导原则,针对不同种类药物采用不同的技术策略,技术方法包括急性毒性、长期毒性、毒代、免疫毒性和安全性药理试验等。
药物安全性评价的毒理学研究的主要内容有:(1)药物的肝脏毒性评价药源性肝毒性已成为临床前药物研发失败或上市药物被召回的主要原因。
随着新药研发的不断发展,对药物肝损伤的早期评价和筛选越来越受到大家的重视。
在传统肝损伤生物标志物的基础上,研究者不断探索研究新的生物标志物,以期在药物开发更早阶段评估和确认药物的肝损伤风险。


附件四药物遗传毒性研究技术指导原则药物遗传毒性研究技术指导原则一、概述遗传毒性研究(Genotoxicity Study)是药物非临床安全性评价的重要内容,它与其他毒理学研究尤其是致癌性研究、生殖毒性研究有着密切的联系,是药物进入临床试验及上市的重要环节。
拟用于人体的药物,应根据受试物拟用适应症和作用特点等因素考虑进行遗传毒性试验。
遗传毒性试验是指用于检测通过不同机制直接或间接诱导遗传学损伤的受试物的体外和体内试验,这些试验能检出DNA损伤及其损伤的固定。
以基因突变、较大范围染色体损伤、重组和染色体数目改变形式出现的DNA损伤的固定,一般被认为是可遗传效应的基础,并且是恶性肿瘤发展过程的环节之一(这种遗传学改变仅在复杂的恶性肿瘤发展变化过程中起了部分作用)。
在检测此类损伤的试验中呈阳性的化合物为潜在致癌剂和/或致突变剂,即可能诱导癌和/或遗传性疾病。
由于在人体中已建立了某些化合物的暴露和致癌性之间的关系,而对于遗传性疾病尚难以证明有类似的关系,故遗传毒性试验主要用于致癌性预测。
但是,因为已经确定生殖细胞突变与人类疾病有关,所以对可能引起可遗传效应的化合物与可能引起癌症的化合物应引起同样的关注;此外,这些试验的结果可能还有助于解释致癌性的机制和试验结果。
因此,在药物开发的过程中,遗传毒性试验的目的是通过一系列试验来预测受试物是否有遗传毒性,在降低临床试验受试者和药品上市后使用人群的用药风险方面发挥重要作用。
本指导原则重点阐述遗传毒性试验体内外试验的基本原则,并介绍标准试验组合方案,以及对试验结果的综合分析及评价。
本指导原则适用于中药、天然药物和化学药物的遗传毒性试验研究。
二、基本原则(一)实验管理药物的遗传毒性试验属于安全性评价研究,根据《中华人民共和国药品管理法》的规定,必须执行《药物非临床研究质量管理规范》。
(二)具体问题具体分析遗传毒性试验的设计,应该在对受试物认知的基础上,遵循“具体问题具体分析”的原则。

CH药物遗传毒性研究指导原则的最新进展介绍黄芳华王庆利审评二部黄芳华审评四部王庆利ICH的指导原则在药品的研究与开发中有较好的参考意义。
从2006年9月开始,ICH提出对遗传毒性指导原则进行修订改版,ICH专家组对遗传毒性试验一系列问题进行了讨论修订,但目前尚未达成一致意见,预期需2年的时间完成该指导原则的修订。
鉴于目前我们起草的指导原则参考的是已有的ICH指导原则的基本原则,及时跟踪国际上,包括ICH遗传毒性研究指导原则在内的相关领域的进展情况,对我们进行药物的研发和评价有借鉴作用。
因此,本文拟对ICH关于遗传毒性研究指导原则的相关进展进行简介。
针对遗传毒性研究,ICH分别于1995年和1997年发布了两个指导原则,即ICH S2A:Guidance on Specific Aspects of Regulatory Genotoxicity Tests for Pharmaceuticals(药物遗传毒性试验的特殊性指导原则)和ICH S2B:Genotoxicity:a Standard Battery for Genotoxicity Testing of Pharmaceuticals(遗传毒性:药物遗传毒性试验标准组合)。
由于遗传毒性试验大部分是短期试验,新技术发展迅速,且对于涉及基因突变过程的不同类型遗传损伤和不同作用方式的性质和相关性的科学认识也在不断发展,使得对遗传毒性试验有了新的认识。
在这种情况下,ICH于2006年启动了遗传毒性指导原则的修订工作,并于2006年9月和2007年5月的ICH会议上进行了讨论,最近的会议在2007年10月底至11月初召开。
ICH修订指导原则的起因主要源于两方面:其一是现有遗传毒性试验的进展与原指导原则推荐的试验方法存在着一些问题。
这些年来,一系列的体内和体外遗传毒性试验有了新发展并积累了大量的数据使得具有加入到原指导原则中的价值,如体外微核试验、体内彗星试验、转基因模型等。


发布日期20080729栏目化药药物评价>>综合评价ICH关于遗传毒性体外、体内试验的建议--ICHS2(R1)人用药物遗传毒性标题试验和结果分析指导原则介绍(二)作者黄芳华部门正文内容审评二部黄芳华前文已介绍了ICH关于遗传毒性标准试验组合的要求,以下介绍ICHS2(R1)Guidance on Genotoxicity Testing and Data Interpretation forPharmaceuticals Intended for Human Use(人用药物遗传毒性试验和结果分析指导原则)中关于体外、体内试验的建议。
一、对体外试验的建议1、试验重复和分析实验结果的重现性是涉及新方法或意外发现的研究的基本组成部分。
但是,用标准的、已广泛应用的遗传毒性试验进行常规试验时往往不需要完全重复。
这些试验都经过很好的充分验证且有有效的内部控制,对明确的阳性或阴性结果试验通常不需要重复。
理想状态是可明确宣称试验结果是明确的阳性或明确的阴性。
但是,试验结果有时达不到阳性或阴性称谓的预先设定的标准,因此被定为“可疑”。
统计学方法的应用有助于数据分析;但是,充足的生物学分析是至关重要的。
可疑试验的重复可致(i) 一个明确的阳性结果,因此作为整体阳性结果;(ii) 一个阴性结果,所以结果不需要重复和总体结果为阴性;或(iii)另一个可疑的结果,最后结论仍维持可疑。
2、对细菌突变试验的推荐方案OECE指导原则(1997)和IWGT报告(Gatehouse et al, 1994) 给出了对方案的建议。
2.1 高剂量水平的选择最高剂量水平当不受溶解度或细胞毒性限制时,推荐最高浓度为5000µg/皿。
溶解度的限制对于细菌培养,如果沉淀不干扰评分应对沉淀量进行评分,毒性不限制,最高剂量不超过5000µg/皿。
有证据表明在用细菌遗传毒性试验检测某些受试物时,在不溶解的浓度范围内也能检测出剂量相关性的遗传毒性。

总局关于发布药物遗传毒性研究技术指导原则来源:CFDA2018年03月15日,总局发布关于发布药物遗传毒性研究技术指导原则的通告(2018年第50号),为指导和规范药物遗传毒性研究,国家食品药品监督管理总局组织修订了《药物遗传毒性研究技术指导原则》,现予发布。
原国家食品药品监督管理局2007年发布的《药物遗传毒性研究技术指导原则》废止。
特此通告。
附件:药物遗传毒性研究技术指导原则食品药品监管总局2018年3月12日药物遗传毒性研究技术指导原则一、概述遗传毒性研究(GenotoxicityStudy)是药物非临床安全性评价的重要内容,与其他研究尤其是致癌性、生殖毒性等研究有着密切的联系,是药物进入临床试验及上市的重要环节。
拟用于人体的药物,应根据受试物拟用适应症和作用特点等因素考虑进行遗传毒性试验。
遗传毒性试验是指用于检测通过不同机制直接或间接诱导遗传学损伤的受试物的体外和体内试验,这些试验能检测出DNA损伤及其损伤的固定。
以基因突变、较大范围染色体损伤或重组形式出现的DNA 损伤的固定,通常被认为是可遗传效应的基础,并且是恶性肿瘤多阶段发展过程的重要因素(恶性肿瘤发展变化是一个复杂的过程,遗传学改变可能仅在其中起部分作用)。
染色体数目的改变也与肿瘤发生有关,并可提示生殖细胞出现非整倍体的可能性。
在遗传毒性试验中呈阳性的化合物为潜在的人类致癌剂和/或致突变剂。
由于在人体中已建立了某些致突变/遗传毒性化合物的暴露与致癌性之间的相关性,而对于遗传性疾病尚难以证明有类似的相关性,因此遗传毒性试验主要用于致癌性预测。
但是,因为生殖细胞突变与人类疾病具有明确的相关性,所以也应同样重视化合物引起潜在可遗传性效应的风险。
此外,遗传毒性试验结果可能对致癌性试验的结果分析有重要作用。
因此,在药物开发的过程中,遗传毒性试验的目的是通过一系列试验来预测受试物是否有遗传毒性,在降低临床试验受试者和药品上市后使用人群的用药风险方面发挥重要作用。


I C H-系列指导原则-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIANICH:Quality质量Q1A(R2): Stability Testing of New Drug Substances and Products (Second Revision)新原料药和制剂的稳定性试验(第二版)Q1B: Photostability Testing of New Drug Substances and Products新原料药和制剂的光稳定性试验Q1C: Stability Testing for New Dosage Forms新制剂的稳定性试验Q1D: Bracketing and Matrixing Designs for Stability Testing of Drug Substances and Drug Products原料药和制剂稳定性试验的交叉和矩阵设计Q1E: Evaluation of Stability Data对稳定性数据的评估处理Q1F: Stability Data Package for Registration Applications in Climatic Zones III and IV 在气候带III和IV,药物注册申请所提供的稳定性数据Q2A: Text on Validation of Analytical Procedures分析程序的验证Q2B: Validation of Analytical Procedures: Methodology分析程序的验证:方法学Q3A(R): Impurities in New Drug Substances (Revised Guideline)新原料药中的杂质(修订版)Q3B(R): Impurities in New Drug Products (Revised Guideline)新制剂中的杂质(修订版)Q3C: Impurities: Guideline for Residual Solvents杂质:残留溶剂指南Q3C(M): Impurities: Guideline for Residual Solvents (Maintenance)杂质:残留溶剂指南(修改内容)Q4: Pharmacopoeias药典Q4A: Pharmacopoeial Harmonisation 药典的协调Q4B: Regulatory Acceptance of Pharmacopoeial Interchangeability药典互替在法规上的可接受性Q5A: Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin来源于人或者动物细胞系的生物技术产品的病毒安全性评估Q5B: Quality of Biotechnological Products: Analysis of the Expression Construct in Cells Used for Production of r-DNA Derived Protein Products生物技术产品的质量:源于重组DNA的蛋白质产品的生产中所用的细胞中的表达构建分析Q5C:Quality of Biotechnological Products: Stability Testing of Biotechnological/ Biological Products生物技术产品的质量:生物技术/生物产品的稳定性试验Q5D: Derivation and Characterisation of Cell Substrates Used for Production of Biotechnological/Biological Products用于生产生物技术/生物产品的细胞底物的起源和特征描述Q5E: Comparability of Biotechnological/Biological Products Subject to Changes in Their Manufacturing Process基于不同生产工艺的生物技术产品/生物产品的可比较性Q6: Specifications for New Drug Substances and Products新原料药和制剂的质量规格Q6A: Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances质量规格:新原料药和新制剂的检验程序和可接收标准:化学物质Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products质量规格:生物技术/生物产品的检验程序和可接收标准Q7: Good Manufacturing Practices for Pharmaceutical Ingredients活性药物成份的GMPQ7A: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients活性药物成份的GMP指南Q8: Pharmaceutical Development药物研发Q9: Quality Risk Management质量风险管理ICH:Safety安全S1A: Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究需要的指南S1B: Testing for Carcinogenicity of Pharmaceuticals药物致癌性的检验S1C: Dose Selection for Carcinogenicity Studies of Pharmaceuticals药物致癌性研究之剂量选择S1C(R): Addendum: Addition of a Limit Dose and Related Notes附录:极限剂量和有关注释的的补充S2A: Guidance on Specific Aspects of Regulatory Genotoxicity Tests for Pharmaceuticals受法规管辖的药物基因毒性检验的特定方面的指南S2B: Genotoxicity: A Standard Battery for Genotoxicity Testing for Pharmaceuticals 基因毒性:药物基因毒性检验的标准S3A: Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposure in Toxicity Studies毒物代谢动力学指南的注释:毒性研究中的全身性暴露量的评估S3B: Pharmacokinetics: Guidance for Repeated Dose Tissue Distribution Studies药物代谢动力学:重复剂量的组织分布研究指南S4:??Single Dose Toxicity Tests单剂量毒性检验S4A:??Duration of Chronic Toxicity Testing in Animals (Rodent and Non-Rodent Toxicity Testing)动物体内慢性毒性持续时间的检验(啮齿动物和非啮齿动物毒性检验)S5A: Detection of Toxicity to Reproduction for Medicinal Products药物对生殖发育的毒性的检验S5B(M): Maintenance of the ICH Guideline on Toxicity to Male Fertility:??An Addendum to the Guideline on Detection of Toxicity to Reproduction for Medicinal Products对男性生殖能力的毒性的指南的变动:药物对生殖发育的毒性的检验指南增加了一个附录S6: Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals生物技术生产的药物的临床前安全评价S7A: Safety Pharmacology Studies for Human Pharmaceuticals人用药的安全药理学研究S7B: The Nonclinical Evaluation of the Potential for Delayed Ventricular Repolarization(QT Interval Prolongation) By Human Pharmaceuticals药物延迟心室复极化(QT间期)潜在作用的非临床评价S8: Immunotoxicology Studies for Human Pharmaceuticals人用药免疫毒理学研究M3(M): Maintenance of the ICH Guideline on Non-Clinical Safety Studies for the Conduct of Human Clinical Trials for Pharmaceuticals药物的对人临床试验的非临床安全研究指南的变动E1: The Extent of Population Exposure to Assess Clinical Safety for Drugs Intended for Long-Term Treatment of Non-Life-Threatening Conditions对用于无生命危险情况下长期治疗的药物进行临床安全评估的族群暴露量范围E2A: Clinical Safety Data Management: Definitions and Standards for Expedited Reporting临床安全数据管理:速报制度的定义和标准E2B(R): Revision of the E2B(M) ICH Guideline on Clinical Safety Data Management Data Elements for Transmission of Individual Case Safety Reports个案安全报告送交的临床安全数据管理的数据要素指南(E2B(M))的修订版E2B (M): Maintenance of the Clinical Safety Data Management including: Data Elements for Transmission of Individual Case Safety Reports临床安全数据管理的变动包括:个案安全报告送交的数据要素E2B(M): Maintenance of the Clinical Safety Data Management including Questions and Answers临床安全数据管理的变动,包括问答E2C: Clinical Safety Data Management: Periodic Safety Update Reports for Marketed Drugs临床安全数据管理:已上市药品的周期性安全数据更新报告Addendum to E2C: Periodic Safety Update Reports for Marketed DrugsE2C的附录:已上市药品的周期性安全数据更新报告E2D: Post-Approval Safety Data Management: Definitions and Standards for Expedited Reporting批准后的安全数据管理:速报制度的定义和标准E2E: Pharmacovigilance Planning药物警戒计划E3: Structure and Content of Clinical Study Reports临床研究报告的结构和内容E4: Dose-Response Information to Support Drug Registration支持药品注册的剂量-效应资料E5: Ethnic Factors in the Acceptability of Foreign Clinical Data引入海外临床数据时要考虑的人种因素E6: Good Clinical Practice: Consolidated GuidelineGCP:良好的临床规范:统一的指南E7: Studies in Support of Special Populations: Geriatrics对特定族群的支持的研究:老人病学E8: General Considerations for Clinical Trials对临床试验的总的考虑E9: Statistical Principles for Clinical Trials临床试验的统计原则E10: Choice of Control Group and Related Issues in Clinical Trials临床试验中控制组和有关课题的选择E11: Clinical Investigation of Medicinal Products in the Pediatric Population小儿科药物的临床调查E12A: Principles for Clinical Evaluation of New Antihypertensive Drugs新抗高血压药物的临床评价原则E14: The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs非抗心率失常药物的QT/QTc 间期和致心率失常潜在作用的临床评价Multidisciplinary Guidelines 多学科兼容的指南M1: Medical Terminology医学术语M2: Electronic Standards for Transmission of Regulatory Information (ESTRI)药政信息传递之电子标准M3: Timing of Pre-clinical Studies in Relation to Clinical Trials (See Safety Topics)有关临床试验的临床前研究的时间安排M4: The Common Technical Document (See CTD section for complete Status of the guidelines)通用技术文件(见有关CTD章节)M5: Data Elements and Standards for Drug Dictionaries药物词典的数据要素和标准。

ich基因毒杂质指导原则
ICH发布的基因毒性杂质的控制指导原则是ICH M7,名为“评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险”。
该指导原则对基因毒性杂质的定义、风险评估、分类、限度制定、控制策略等进行了详细说明。
对于已知致癌阈值的基因毒性杂质,可根据该阈值设置每日最大允许暴露量(PDE),以此来控制该类基因毒性杂质的限度;对于无充分阈值相关机理证据(实验)的遗传毒性化合物,一般采用毒理学关注阀值(TTC)来确定基因毒性杂质的可接受限度。
发布日期20080729栏目化药药物评价>>综合评价ICH遗传毒性标准试验组合的最新要求--ICHS2(R1)人用药物遗传毒性试标题验和结果分析指导原则介绍(一)作者黄芳华部门正文内容审评二部黄芳华从2006年9月开始,ICH提出对遗传毒性指导原则进行修订改版,ICH 专家组对遗传毒性试验一系列问题进行了讨论修订,并起草了S2(R1):Guidance on Genotoxicity Testing and Data Interpretation forPharmaceuticals Intended for Human Use(人用药物遗传毒性试验和结果分析指导原则)。
该指导原则于2008年3月6日达到ICH进程的第二阶段。
根据协调进程,该指导原则由ICH委员会向ICH三方的管理部门(欧盟、日本和美国)以征询国内外的意见。
该指导原则将替代ICH原来的遗传毒性研究的两个指导原则(S2A和S2B),这将对药物遗传毒性研究产生重大的影响。
及时了解国际遗传毒性技术要求的进展,对于国内遗传毒性的研究也有重大意义。
该指导原则对遗传毒性试验标准组合、体内外试验的要求及结果分析和评价方面提出了新的要求。
以下是ICHS2(R1)关于遗传毒性标准试验组合的要求。
一、基本原理药品注册要求对其潜在性遗传毒性进行全面评价。
大量回顾研究表明许多被细菌回复突变(Ames)试验检出是致突变剂的化合物是啮齿类动物致癌剂。
加上体外哺乳动物细胞试验可提高灵敏度和加宽遗传学物质的检测谱,但是同时也降低了预测的特异性,即提高了阳性结果发生率(而该结果与此啮齿类动物致癌性不相关)。
然而,组合方法仍是合理的,因为没有任何一个单一试验能检测所有与肿瘤发生相关的遗传毒性机制。
标准试验组合应具备的基本特征如下:i.用细菌回复突变试验评价致突变性。
该试验能检出相关的遗传学改变和大部分啮齿类动物和人类的遗传毒性致癌剂。
ii.遗传毒性还应采用与哺乳动物细胞体外和/或体内试验进行评价。
该指导原则为ICH(人用药品注册技术要求的国际协调会议)三方(欧盟、日本和美国)协调的指导原则。
根据ICH程序,该指导原则由ICH专家工作组(安全性)起草,并提交管理部门讨论协商。
1994年10月27日,在ICH程序的第4阶段会议上,该指导原则被ICH筹备委员会推荐给欧盟、日本和美国的行政管理部门采纳。
1995年3月,该指导原则发布在美国FDA的Federal Register上(60 FR 11264),适用于化学药物和生物制品[医学教育网整理发布]。
1 前言本指导原则所涉及的毒物代谢动力学(毒代动力学)仅与拟开发作为人用的药品有关。
毒代动力学是药代动力学在全身暴露评价中的延伸,为非临床毒性研究的一个组成部分,或为某一特殊设计的支持研究。
研究结果可用于阐明毒理学发现及其与临床安全性的关系(文中其它术语的定义见注释1)。
制定该指导原则是为了使人们理解毒代动力学的意义和应用,指导毒代动力学的试验设计。
本指导原则强调毒性试验需与毒代动力学相结合,这将有助于解释毒理学发现和制定合理的试验设计。
毒代动力学测定通常是结合于毒性研究中,故又被称为“伴随毒代动力学”。
毒性试验的试验程序有助于获得受试动物多剂量的毒代动力学数据。
如果在毒性试验中测定了合适的指标或参数,毒代动力学研究可避免重复的毒性试验。
有时,模拟毒性试验的支持研究也可获得相应的毒代动力学数据。
获取数据的优化设计可以减少试验动物数。
非临床药代动力学和代谢过程的研究,对解释毒理学的发现可能有价值,但毒代动力学数据侧重于新药毒性研究中的动力学。
因此,毒代动力学是非临床试验设计的组成部分,在理解毒性试验结果和临床人体用药风险性、安全性时可提高毒理学资料的价值。
毒代动力学已成为毒性试验的组成部分,成为非临床和临床试验间的桥梁,其研究重点是解释毒性试验结果,而不是为描述受试物的基本药代动力学参数特征。
由于药品开发是在非临床和临床间反馈的动态过程,因此毒代动力学研究无严格的、详细的试验程序,也无必要在全部研究中获取毒代动力学数据,应该科学地判断什么情况下需要进行。
附件四则编号:药物遗传毒性研究技术指导原则药物遗传毒性研究技术指导原则一、概述遗传毒性研究(Genotoxicity Study)是药物非临床安全性评价的重要内容,它与其他毒理学研究尤其是致癌性研究、生殖毒性研究有着密切的联系,是药物进入临床试验及上市的重要环节。
拟用于人体的药物,应根据受试物拟用适应症和作用特点等因素考虑进行遗传毒性试验。
遗传毒性试验是指用于检测通过不同机制直接或间接诱导遗传学损伤的受试物的体外和体内试验,这些试验能检出DNA损伤及其损伤的固定。
以基因突变、较大范围染色体损伤、重组和染色体数目改变形式出现的DNA损伤的固定,一般被认为是可遗传效应的基础,并且是恶性肿瘤发展过程的环节之一(这种遗传学改变仅在复杂的恶性肿瘤发展变化过程中起了部分作用)。
在检测此类损伤的试验中呈阳性的化合物为潜在致癌剂和/或致突变剂,即可能诱导癌和/或遗传性疾病。
由于在人体中已建立了某些化合物的暴露和致癌性之间的关系,而对于遗传性疾病尚难以证明有类似的关系,故遗传毒性试验主要用于致癌性预测。
但是,因为已经确定生殖细胞突变与人类疾病有关,所以对可能引起可遗传效应的化合物与可能引起癌症的化合物应引起同样的关注;此外,这些试验的结果可能还有助于解释致癌性的机制和试验结果。
因此,在药物开发的过程中,遗传毒性试验的目的是通过一系列试验来预测受试物是否有遗传毒性,在降低临床试验受试者和药品上市后使用人群的用药风险方面发挥重要作用。
本指导原则重点阐述遗传毒性试验体内外试验的基本原则,并介绍标准试验组合方案,以及对试验结果的综合分析及评价。
本指导原则适用于中药、天然药物和化学药物的遗传毒性试验研究。
二、基本原则(一)实验管理药物的遗传毒性试验属于安全性评价研究,根据《中华人民共和国药品管理法》的规定,必须执行《药物非临床研究质量管理规范》。
(二)具体问题具体分析遗传毒性试验的设计,应该在对受试物认知的基础上,遵循“具体问题具体分析”的原则。
人用药品注册技术要求国际协调会(ICH)文件目录ICH的论题主要分为四类,因此ICH根据论题的类别不同而进行相应的编码分类:1. “Q”类论题:Q代表QUALITY,指那些与化工和医药,质量保证方面的相关的论题。
Q1/Q2...Q10都属于这类。
2. “S”类论题:S代表SAFETY,指那些与实验室和动物实验,临床前研究方面的相关的论题。
3. “E”类论题:E代表EFFICACY,指那些与人类临床研究相关的课题。
4. “M”类论题:M代表MULTIDISCIPLINARY, 指那些不可单独划入以上三个分类的交叉涉及的论题。
同时M又细分为5个小类:M1: 常用医学名词(Med DRA)M2: 药政信息传递之电子标准M3: 与临床试验相关的临床前研究时间的安排M4: 常规技术文件(CTD)M5: 药物词典的数据要素和标准一、ICH. 质量部分(Quality)稳定性1.Quality质量2.Q1: Stability稳定性3.Q1A(R2): Stability Testing of New Drug Substances and Products 新原料药和制剂的稳定性试验4.Q1B: Photostability Testing of New Drug Substances and Products 新原料药和制剂的光稳定性试验5.Q1C: Stability Testing for New Dosage Forms 新剂型的稳定性试验6.Q1D: Bracketing and Matrixing Designs for Stability Testing of Drug Substances and Drug Products原料药和制剂稳定性试验的交叉和矩阵设计 Q1E: Evaluation of Stability Data 稳定性数据的评估7.Q1F: Stability Data Package for Registration Applications in Climatic Zones III andIV在气候带III和IV,药物注册申请所提供的稳定性数据8.Q2: Analytical Validation分析验证9.Q2(R1): Validation of Analytical Procedures: Text and Methodology分析程序的验证:正文及方法论10.Q3: Impurities 杂质11.Q3A(R2): Impurities in New Drug Substances 新原料药中的杂质12.Q3B(R2): Impurities in New Drug Products (Revised Guideline) 新制剂中的杂质13.Q3C(R3): Impurities: Guideline for Residual Solvents 杂质:残留溶剂指南Impurities: Guideline for Residual Solvents (Maintenance) 杂质:残留溶剂指南(保留)PDE for Tetrahydrofuran (in Q3C(R3)) 四氢呋喃的日允许接触剂量PDE for N-Methylpyrrolidone (in Q3C(R3)) N-甲基吡咯烷酮的日允许接触剂量14.Q4: Pharmacopoeias药典15.Q4A: Pharmacopoeial Harmonisation 药典的协调16.Q4B: Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regions药典内容的评估及推荐为用于ICH地区17.Q4B Annex1 Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regionson Residue on Ignition/Sulphated Ash General Chapter附录1 药典内容的评估及推荐为用于ICH地区关于灼烧残渣/灰分常规篇18.Q4B Annex2 Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regionson Test for Extractable Volume of Parenteral Preparations General Chapter附录2 药典内容的评估及推荐为用于ICH地区关于注射剂可提取容量测试常规篇19.Q4B Annex3 Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regionson Test for Particulate Contamination: Sub-Visible Particles General Chapter附录3 药典内容的评估及推荐为用于ICH地区关于颗粒污染物测试:不溶性微粒常规篇20.Q5: Quality of Biotechnological Products 生物技术制品质量21.Q5A(R1): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin来源于人或者动物细胞系的生物技术产品的病毒安全性评估22.Q5B: Quality of Biotechnological Products: Analysis of the Expression Construct in Cells Used for Production of r-DNA Derived Protein Products生物技术产品的质量:源于重组DNA的蛋白质产品的生产中所用的细胞中的表达构建分析23.Q5C: Quality of Biotechnological Products: Stability Testing of Biotechnological/Biological Products生物技术产品的质量:生物技术/生物产品的稳定性试验24.Q5D: Derivation and Characterization of Cell Substrates Used for Production of Biotechnological/Biological Products用于生产生物技术/生物产品的细胞底物的起源和特征描述25.Q5E: Comparability of Biotechnological/Biological Products Subject to Changes inTheir Manufacturing Process基于不同生产工艺的生物技术产品/生物产品的可比较性26.Q6: Specifications规格27.Q6A: Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances (including decision trees) 质量规格:新原料药和新制剂的检验程序和可接收标准:化学物质(包括决定过程)28.Q6B: Specifications: Test Procedures and Acceptance Criteria for29.Biotechnological/Biological Products质量规格:生物技术/生物产品的检验程序和可接收标准30.Q7: Good Manufacturing Practices (GMP)31.Q7A: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients活性药物成份的GMP指南32.Q8: Pharmaceutical Development药物研发33.Annex to Q8Q8附录34.Q9: Quality Risk Management质量风险管理35.Q10: Pharmaceutical Quality System药物质量体系二、ICH.安全性部分(Safety) 致癌试验1.S1A Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals 药物致癌试验的必要性2.S1B Testing for Carcinogenicity of Pharmaceuticals 药物致癌试验3.S1C(R2) Dose Selection for Carcinogenicity Studies of Pharmaceuticals药物致癌试验的剂量选择4.S1C’药物致癌试验的剂量选择的附件:补充剂量限度和有关注释遗传毒性5.S2(R1) Guidance on Genotoxicity Testing and Data Interpretation forPharmaceuticals Intended for Human Use 人用药物的遗传毒性试验和数据分析指导原则6.S2A药物审评遗传毒性试验的特殊性指导原则7.S2B遗传毒性:药物遗传毒性试验标准组合药代8.S3A Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposurein Toxicity Studies 毒代动力学指导原则:毒性研究中全身暴露的评价9.S3B Pharmacokinetics: Guidance for Repeated Dose Tissue Distribution Studies药代动力学:重复给药的组织分布研究指导原则慢性毒性10.S4Duration of Chronic Toxicity Testing in Animals (Rodent and Non RodentToxicity Testing) 动物慢性毒性试验的周期(啮齿类和非啮齿类)生殖毒性11.S5(R2) Detection of Toxicity to Reproduction for Medicinal Products andToxicity to Male Fertility (the Addendum dated November 1995 has beenincorporated into the core guideline in November 2005 )12.S5A药品的生殖毒性检测13.S5B雄性生育力毒性其他14.S6Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals 生物技术药品的临床前安全性试验15.S7A Safety Pharmacology Studies for Human Pharmaceuticals 人用药物的安全性药理研究16.S7B The Non-clinical Evaluation of the Potential for Delayed VentricularRepolarization (QT Interval Prolongation) by Human Pharmaceuticals人用药延迟心室复极化(QT间期延长)潜在作用的非临床评价指导原则17.S8Immunotoxicity Studies for Human Pharmaceuticals人类药品的免疫毒性研究18.S9 Nonclinical Evaluation for Anticancer Pharmaceuticals抗癌药物的临床前评价19.S10 Photosafety Evaluation三、ICH.临床部分(Efficacy)1.E1The Extent of Population Exposure to Assess Clinical Safety for Drugs Intended for Long-Term Treatment of Non-Life-Threatening Conditions 评价临床长期给药方案的安全性2.E2A Definitions and Standards for Expedited Reporting 快速报告的定义和标准3.E2B(R3) Data Elements for Transmission of Individual Case Safety Reports个体病例安全性报告传递的数据要素4.E2C Periodic Benefit-Risk Evaluation Report 上市药品定期安全性更新报告5.E2D Post-Approval Safety Data Management: Definitions and Standards for Expedited Reporting批准后安全性数据管理:快速报告的定义和标准6.E2E Pharmacovigilance Planning药物警戒计划7. E2F Development Safety Update Report8.E3Structure and Content of Clinical Study Reports 临床研究报告的结构与内容9.E4Dose-Response Information to Support Drug Registration 新药注册所需量-效关系的资料10.E5(R1)Ethnic Factors in the Acceptability of Foreign Clinical Data 对国外临床研究资料的种族因素的可接受性11.E6(R1) Good Clinical Practice: Consolidated Guideline 药品临床研究规范(GCP)一致性指导原则12.E7Studies in Support of Special Populations: Geriatrics 老年人群的临床研究13.E8General Considerations for Clinical Trials 临床试验的一般考虑14.E9Statistical Principles for Clinical Trials 临床试验统计原则15.E10Choice of Control Group and Related Issues in Clinical Trials 对照组的选择16.E11Clinical Investigation of Medicinal Products in the Pediatric Population 儿童人群的临床研究17.E12按治疗分类的各类药物临床评价E12 Principles for Clinical Evaluation of New Antihypertensive Drugs18.E14The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs 非抗心律失常药物致QT/QTc间期延长及潜在心律失常作用的临床评价19.E15 Definitions for Genomic Biomarkers, Pharmacogenomics, Pharmacogenetics, Genomic Data and Sample Coding Categories20.E16 Biomarkers Related to Drug or Biotechnology Product Development: Context, Structure and Format of Qualification Submissions四、ICH.综合部分 (Multidisciplinary)1.M1医学术语Med DRA2.M2Electronic Transmission of Individual Case Safety Reports MessageSpecification (ICH ICSR DTD Version 2.1) companion document to E2B(R3)注册资料传递所需的电子代码3.M3Guidance on Nonclinical Safety Studies for the Conduct of Human ClinicalTrials and Marketing Authorization for Pharmaceuticals与临床研究有关的临床前研究的时间安排4.M4 Organisation of the Common Technical Document for the Registration ofPharmaceuticals for Human Use (Edited with Numbering and Section Header Changes, September 2002). Including the Annex : the Granularity Document(Revised November 2003).CTD(common technical document)(包括CTD、CTD-Q、CTD-S、CTD-E和eCTD)药品词汇的数据要素和标准5.M4Q (R1) The Common Technical Document for the Registration ofPharmaceuticals for Human Use: Quality (Edited with Numbering and Section Header Changes, September 2002)6.M4S (R2) The Common Technical Document for the Registration ofPharmaceuticals for Human Use: Safety (Edited with Numbering and SectionHeader Changes, September 2002)7.M4E (R1) The Common Technical Document for the Registration ofPharmaceuticals for Human Use: Efficacy (Edited with Numbering and Section Header Changes, September 2002)8.M7 Assessment and Control of DNA Reactive (Mutagenic) Impurities inPharmaceuticals to Limit Potential Carcinogenic Risk Reference:1. 《ICH 药品注册的国际要求》2. 3. /health/Health/yx/yao/2007-08-07/6326.html。
临床试验管理规范指导原则(ICH-GCP)前言临床试验管理规范(GCP)是设计、实施、记录和报告设计人类对象参加的试验国际性伦理和科学质量标准。
遵循这一标准为保护对象的权利、安全性和健康,为与源于赫尔辛基宣言的原则保持一致以及临床试验数据的可信性提供了公众保证。
ICH-GCP指导原则的目的是为欧盟、日本和美国提供统一的标准,以促进这些管理当局在其权限内相互接受临床数据。
本指导原则的发展考虑了欧盟、日本、美国,以及澳大利亚、加拿大、北欧国家和世界卫生组织(GCP)的现行GCP。在产生打算提交给管理当局的临床数据时应当遵循本指导原则。
本指导原则中确立的原则也可应用于可能影响人类对象安全和健康的其他临床研究。
1.术语药品不良反应(ADR)在一个新的药品或药品的新用途在批准之前的临床实践,尤其是治疗剂量尚未确定前,ADR是指与药物任何剂量有关的所有有害的和非意求的反应都应被考虑为药物不良反应。
该术语用于药品是指在药品与不良反应之间的因果关系至少有一个合理的可能性,即不能排除这种关系。
对已上市药品,ADR指人对用于预防、诊断或治疗疾病或改善生理功能的药物在常用剂量出现的有害和非意求反应(参见ICH临床安全性数据管理指导原则:快速报告的定义和标准)。不良事件(AE)在用药病人或临床研究对象中发生的任何不幸医疗事件,他不一定要与治疗有因果关系。
因此,一个不良事件(AE)可以是与使用(研究)药物在时间上相关的任何不利的和非意求的征兆(包括异常的实验室发现)、症状或疾病,而不管其是否与药物有关(参见ICH临床安全性数据管理指导原则:快速报告的定义和标准)。修改(试验方案)见试验方案修改适用的管理要求有关实施试验用药品临床试验的任何法律和法规。
批准(机构审评委员会)IRB表示赞成的决定:指对一项临床试验已经进行审评,并可在IRB、研究机构、GCP和适用管理要求的约束下由研究机构方实施。
稽查对试验相关活动和文件进行系统和独立的监察,以判定试验的实施和数据的记录、分析与报告是否符合试验方案、申办者的标准操作程序(SOP)、临床试验管理规范(GCP)以及适用的管理要求。
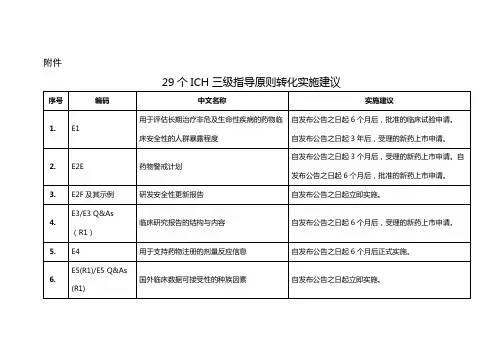
发布日期20080729栏目化药药物评价>>综合评价ICH关于遗传毒性结果评价和追加试验策略指导原则--ICHS2(R1)人用药物遗传标题毒性试验和结果分析指导原则介绍(三)作者黄芳华部门正文内容审评二部黄芳华遗传毒性试验能检出DNA损伤及其损伤的固定。
以基因突变、较大范围染色体损伤、重组和染色体数目改变形式出现的DNA损伤的固定,一般被认为是可遗传效应的基础,并且是恶性肿瘤发展过程的环节之一(这种遗传学改变仅在复杂的恶性肿瘤发展变化过程中起了部分作用)。
染色体数目的改变还与肿瘤发生有关和可提示生殖细胞发生非整倍体的潜在性。
在检测这些类别损伤的试验中呈阳性的化合物为潜在人类致癌剂和/或致突变剂。
由于在人体中已建立了某些化合物的暴露和致癌性之间的关系,而对于遗传性疾病尚难以证明有类似的关系,故遗传毒性试验主要用于致癌性预测。
但是,因为已经确定生殖细胞突变与人类疾病有关,所以对可能引起可遗传效应的化合物与可能引起癌症的化合物应引起同样的关注;此外,这些试验的结果可能还有助于致癌性试验分析。
遗传毒性研究在药物研发中处于比较的重要位置,尤其是在药物筛选阶段,在很大程度上遗传毒性试验结果将影响到药物开发的进程。
但是遗传毒性的假阳性和假阴性结果难以避免,尤其是近年来体外哺乳动物细胞试验系统阳性结果(该结果与人用危险不相关)过高的问题已引起的广泛关注。
因此对结果进行综合分析尤为重要。
FDA于2006年出台了推荐的遗传毒性试验结果综合分析法指导原则(Guidance for industy and review staff: Recommended approaches to integrationof genetic toxicology study results),对遗传毒性试验出现阳性结果如何评价和处理进行了讨论。
现介绍ICH S2(R1)中的遗传毒性结果评价和追加试验策略。
对比试验已明确显示,在预测药物对啮齿类动物致癌性时每种体外检测系统均可产生假阴性和假阳性结果。
遗传毒性试验组合(包括体内和体外试验)检测的是被认为主要通过直接的遗传损伤机制的致癌剂,如绝大多数已知的人类致癌剂。
因此,这些组合无法检测出非遗传毒性致癌剂。
体外试验的一些实验条件,如体外代谢活化系统有限的能力,可能导致假阴性结果。
试验组合方法的设计是为了减少有潜在遗传毒性化合物的假阴性结果的风险,但是,任何一种遗传毒性试验中的阳性结果并不一定能说明受试物对人体真正具有遗传毒性或致癌性的危险。
虽然体外试验阳性资料可提示药物内在的遗传毒性特征,在大多数情况下恰当的体内试验资料确定这些体外试验信号的生物学意义。
而且,由于许多遗传毒性的非直接机制仅在某些浓度以上才有作用,对于具有这些机制证据的药物类别有可能确定安全剂量水平(阈值)(见下述5.2., Müller and Kasper, 2000; Scott et al, 1991; Thybaud et al 2007)。
1、生物学相关性评估假定试验已采用合适的剂量间距、毒性水平等进行,建议如下:体外或体内遗传毒性表观上的小的增加,首先应评价是否有重现性和生物学意义。
不被认为有生物学意义的结果的例子包括:i.小的增加与阴性或溶剂对照组值相比有统计学意义,但是在试验条件的历史对照范围内ii.弱/可疑结果不可重复。
若以上任一情况应用证据权衡提示缺乏潜在遗传毒性,该试验被认为是阴性或该发现无生物学相关性,无需进行进一步的试验。
2、体外试验结果评价在评价阳性结果时,尤其是细菌突变试验,应考虑受试物的纯度,以确定阳性结果是否归因于污染物。
2.1 体外细菌突变试验阳性结果的评价有关于菌落的假升高而事实上是不相关的典型例子,这可发生于由于氨基酸的污染(为沙门氏菌株提供组氨酸或为E.Coli菌株提供色氨酸),因此细菌回复突变试验不适合检测可能降减的肽类。
也有当细菌突变试验阳性结果并不显示提示在人体内有遗传毒性潜力的一些例子,例如当细菌特异性代谢发生时(如通过细菌硝基还原酶活化)。
2.2体外哺乳动物细胞试验阳性结果的评价IWGT报告(如Thybaud et al 2007)中讨论了关于阳性遗传毒性试验结果时的证据权衡评估和追加试验的建议。
另外,科研文献出给出了一些可能导致有疑问相关性的体外试验阳性结果的情况。
因此,任何体外试验阳性结果应基于下述的证据权衡法进行评价。
以下所列并非详尽,仅供下结论时参考:i.体内不存在的条件(pH值、渗透压、沉淀物)注意:1 mM 的限度避免了渗透压的升高,以及,如果受试物改变了pH值,建议在给药时调整未给药培养基的pH值至正常pH值。
ii.该作用仅发生于最高毒性浓度在MLA试验升高发生于RTG减少≥80%时对体外遗传细胞学试验,生长抑制≥50%如果以上情况应用证据权衡提示缺乏潜在的遗传毒性和在一个试验为阴性的标准组合(选择1)之外无附加试验,可能需进行体内的试验。
2.3 体外试验阴性结果评价对于体外试验阴性结果,在一些特殊情况下需考虑进行进一步的试验,比如(以下所列并非详尽,仅供下结论时参考):受试物的化学结构或已知代谢提示采用的标准体外代谢活化技术(如啮齿类动物肝脏S9)可能不合适;化合物的结构或已知活性提示采用其他检测方法或系统更合适。
3、体内试验结果评价体内试验方法具有考虑到与人体应用相关的吸收、分布、排泄的优点,而体外试验则不具备。
此外,体内代谢相对于体外试验常规使用的代谢系统更具有相关性。
如果体外与体内试验的结果不一致,对其中的差异应采用具体问题具体分析的原则进行考虑/解释分析,如代谢的差异、化合物在体内可能发生快速和高效能的排泄,等等。
体内遗传毒性试验也有给出误导的阳性结果的可能性,该结果并不提示真正的遗传毒性。
例如:微核的升高发生于未给任何遗传毒性物质,而是由于干扰了红血球生成(Tweats et al, 2007 I),DNA加合物数据可解释为内源性加合物的已知背景水平,以及间接的、毒性相关的作用可能影响DNA链断裂试验的结果(如碱洗脱和彗星试验)。
因此评价遗传毒性数据时考虑所有的毒理学和血液学发现很重要(注释17)。
与毒性改变相关的间接作用可能有安全范围,并可能与临床不相关。
4、对阳性结果追加研究策略4.1 对体外哺乳动物细胞试验发现的追加以下讨论基于假定Ames细菌突变试验结果为阴性。
4.1.1 机制/体内试验追加为评价体外哺乳动物细胞试验阳性结果(当在无充分证据提示缺乏相关性时),为提供试验证据,建议对哺乳动物细胞试验进行追加,无论是通过体外附加试验或通过进行两种合适的体内试验,如下:i.有助于对缺乏相关遗传毒性提供证据权衡的机制信息,常产生于体外,如诱导MLA试验中染色体畸变或突变的受试物不是DNA损伤物质的证据(如Ames试验外附加其他阴性突变/DNA损伤试验;结构考虑),或者对于与体内试验不相关的间接/阈值机制的证据(如抑制DNA合成、仅在高浓度时产生活化氧簇,等等)(Galloway et al, 1998; Scott et al, 1991; Muller and Kasper, 2000)。
相似研究也可用于体外微核试验阳性结果的追加,或在证据包含有提示染色体丢失/非整倍体的已知机制,或者着丝点染色试验(注释18)提示染色体丢失的情况下。
如果上述机制信息和证据权衡支持缺乏遗传毒性,仅需要一个体内试验,并有暴露的合适证据,以确定缺乏遗传毒性作用。
这是一个代表性的细胞遗传学试验,以及为染色体丢失潜力进行追加试验时需进行体内微核试验。
多倍体在体外染色体畸变试验常见。
虽然非整倍体可诱导多倍体,多倍体单独也不能提示非整倍体潜力,可能仅能提示细胞周期受干扰;它也常与细胞毒性升高有关。
如果在体外试验中可见多倍体,而非结构上的染色体断裂,在保证有充分暴露的体内微核试验上的阴性结果,通常可提供缺乏诱导非整倍体潜力的充分证据。
或者ii.进行两个合适的体内试验,通常采用不同的组织,以及有支持暴露的证据。
总之,如果体外哺乳动物细胞试验结果为阳性,和无充分证据权衡或机制信息以排除遗传毒性潜力,要求进行两种采用合适的终点和在合适的组织上(通常是两种不同的组织),以及重点在于在体内模型上获得充分暴露的体内试验。
在两种对终点测定有充分的验证,并证明有暴露(见4.8.1节)的合适的体内试验阳性结果,足以说明缺乏遗传毒性作用。
4.1.2 依赖于S9的体外试验阳性结果的追加当阳性结果仅见于S9活化系统存在条件下,首先应确认是代谢活化的原因和非其他一些不同条件(如,与非活化培养≥10%的血清比较,S9混合物中低或无血清)。
因而追加策略目的是确定体外产生活化代谢与体内条件的相关性,通常可重在肝脏上进行的体内试验(注释16)。
4.2 对体内微核试验阳性结果的追加若体内微核有升高,应对所有的毒理学资料进行评价,以确定是否是由于非遗传毒性作用的原因或是其中的一个作用因素(注释17)。
如果怀疑有非特异性的干扰红血球生成的作用或生理学作用(如体温偏低或过高),对于染色体畸变一项体内试验更为适合。
如果一个“真正”的升高被怀疑,需采用能证明该升高是否是由于染色体丢失或染色体断裂的策略(注释18)。
有证据表明非整倍体诱导作用,如纺缍体抑制剂,有非线性剂量反应关系。
因此,可能需确定是否有低于不得到染色体丢失的阈值暴露,以及确定与临床暴露比较是否有合适的安全范围。
总之,化合物遗传毒性潜力的评价应考虑所有的发现和信息的内在价值和体内体外试验的局限性。
5、致癌性生物测定的肿瘤发现相关的追加遗传毒性试验在标准试验组合中呈阴性,但在致癌性生物测定显示肿瘤发生率升高,而无充分证据以建立非遗传毒性作用机制的化合物,应在合适模型上进行附加遗传毒性试验。
为了有助于了解作用方式,追加试验可包括改变体外试验的代谢活化条件或包括测定肿瘤诱导靶器官遗传损伤的体内试验,如DNA链断裂试验(如彗星试验或碱洗脱试验)、肝UDS试验、DNA加合试验(如通过32P-后标记)、转基因突变诱导试验,或肿瘤相关基因遗传变化的分子特征性分析(Kasper et al, 2007)。
备注。