17碳、硅、硼
- 格式:ppt
- 大小:4.03 MB
- 文档页数:57

元素周期表简介化学元素周期表元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。
每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。
共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
元素周期表创始人--门捷列夫简介德米特里•伊万诺维奇•门捷列夫(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
1841年,7岁的门捷列夫进了中学,他在上学的早几年就表现出了出众的才能和惊人的记忆力,他对数学、物理学和地理发生了极大的兴趣。
1850年,门捷列夫进入中央师范学院学习,在大学一年级,门捷列夫就迷上了化学。
他决心要成为一个化学家,为了人类的利益而获得简单、价廉和“到处都有”的物质。

第十七章碳,硅,硼基本要求:1、掌握碳的单质,氧化物,碳酸,碳酸盐的结构和性质。
2、掌握单质硅,氧化物与硅酸的性质和结构。
3、掌握硼的单质,氢化物,含氧化合物的结构和性质,掌握缺电子原子的结构特点。
我们对卤素元素作了较系统的讨论,对ⅥA,ⅤA族阐述的重点只是本周期的一些常见元素——氧,硫,氮,磷。
本章包括ⅥA碳,硅,锗,锡,铅组成及ⅢA硼,铅,镓,铟,铊组成。
对这两族,在本章只重点学习碳,硅,硼这三个非金属元素,对其它金属放在以后学习。
碳是第二周期元素,我们仍应注意它在族中的特殊表现,硼的价电子数(3个)少于价电子层轨道数(4个),它是具有这种特征的唯一非金属元素,常称为缺电子原子,由此带来一系列性质表现。
学习时应注意。
我们一再指出,学习元素知识应注意运用对比方法,寻找知识间的异同点。
本章里,碳和硅虽然是同族元素,我们不妨找它们间的相同点。
相反,硼和硅虽非同族元素,我们力求寻找它们间的相似处,便于学习,掌握。
§17-1 概述对ⅥA—ⅤA一些元素的性质及其递变规律总结如下:1-1、形成原子晶体从ⅥA—ⅤA族,非金属但是多为双原子或多原子的有限分子,组成分子晶体,而C,Si,B都能形成原子间共价结合的庞大分子,组成原子晶体。
金刚石是碳的同素异形体之一,具有典型的原子晶体结构,其中每个C原子以共价键(sp3)和其他4个C原子键合,构成坚固的,连续的网状骨架结构。
碳的另一种同素异形体石墨,它的性质和金刚石有很大差别,石墨很软,能导电;而金刚石很硬,不导电截然相反。
石墨的这些性质完全由它的晶体结构所决定,石墨晶体中,C原子的4个价电子轨道仅3个参与了杂化,形成的3个sp2杂化轨道与相邻3个C原子的相应轨道构成σ单键,排列在一个平面,再引伸开去便成六角平面的网状结构,整个晶体中这种互相平行的许多平面,构成了层状结构。
另外,C原子还剩有一个未杂化的P电子,这些P轨道垂直分布于平面上下,并可以象金属晶体中的自由电子那样,自由表示,而层间地在层间宽广范围内流动,构成极多个C原子间相互重叠的离域ヰ键,用ヰxx作用力是范德华力。
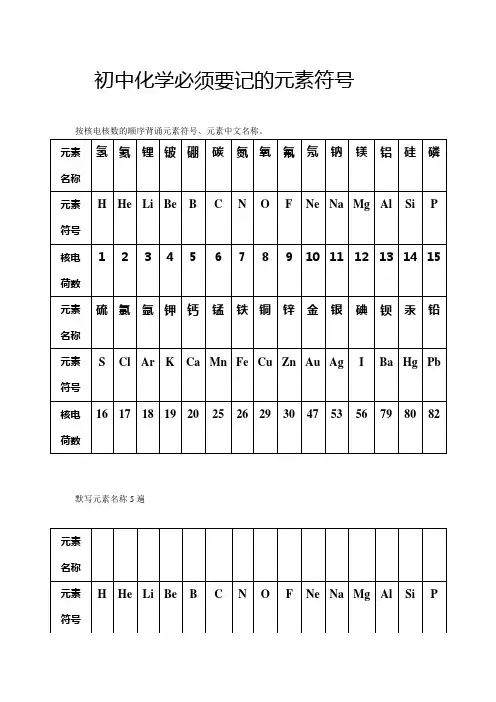


元素周期表读音及元素化学符号表示化学元素周期表读音及元素化学符号表示01号元素:氢[化学符号]H,读qīng第02号元素:氦[化学符号]He,读hài第03号元素:锂[化学符号]Li,读lǐ第04号元素:铍[化学符号]Be,读pí第05号元素:硼[化学符号]B,读péng第06号元素:碳[化学符号]C,读tàn第07号元素:氮[化学符号]N,读dàn第08号元素:氧[化学符号]O,读yǎng第09号元素:氟[化学符号]F,读fú第10号元素:氖[化学符号]Ne,读nǎi第11号元素:钠[化学符号]Na,读nà第12号元素:镁[化学符号]Mg,读měi第13号元素:铝[化学符号]Al,读lǚ第14号元素:硅[化学符号]Si,读guī第15号元素:磷[化学符号]P,读lín第16号元素:硫[化学符号]S,读liú第17号元素:氯[化学符号]Cl,读lǜ第18号元素:氩[化学符号]Ar,A,读yà第19号元素:钾[化学符号]K,读jiǎ第20号元素:钙[化学符号]Ca,读gài第21号元素:钪[化学符号]Sc,读kàng第22号元素:钛[化学符号]Ti,读tài第23号元素:钒[化学符号]V,读fán第24号元素:铬[化学符号]Cr,读gè第25号元素:锰[化学符号]Mn,读měng第26号元素:铁[化学符号]Fe,读tiě第27号元素:钴[化学符号]Co,读gǔ第29号元素:铜[化学符号]Cu,读tóng 第30号元素:锌[化学符号]Zn,读xīn 第31号元素:镓[化学符号]Ga,读jiā第32号元素:锗[化学符号]Ge,读zhě第33号元素:砷[化学符号]As,读shēn 第34号元素:硒[化学符号]Se,读xī第35号元素:溴[化学符号]Br,读xiù第36号元素:氪[化学符号]Kr,读kè第37号元素:铷[化学符号]Rb,读rú第38号元素:锶[化学符号]Sr,读sī第39号元素:钇[化学符号]Y,读yǐ第40号元素:锆[化学符号]Zr,读gào 第41号元素:铌[化学符号]Nb,读ní第42号元素:钼[化学符号]Mo,读mù第43号元素:碍[化学符号]Tc,读dé第44号元素:钌[化学符号]Ru,读liǎo 第45号元素:铑[化学符号]Rh,读lǎo 第46号元素:钯[化学符号]Pd,读bǎ第47号元素:银[化学符号]Ag,读yín 第48号元素:镉[化学符号]Cd,读gé第49号元素:铟[化学符号]In,读yīn 第50号元素:锡[化学符号]Sn,读xī第51号元素:锑[化学符号]Sb,读tī第52号元素:碲[化学符号]Te,读dì第53号元素:碘[化学符号]I,读diǎn 第54号元素:氙[化学符号]Xe,读xiān 第55号元素:铯[化学符号]Cs,读sè第56号元素:钡[化学符号]Ba,读bèi 第57号元素:镧[化学符号]La,读lán第59号元素:镨[化学符号]Pr,读pǔ第60号元素:钕[化学符号]Nd,读nǚ第61号元素:钷[化学符号]Pm,读pǒ第62号元素:钐[化学符号]Sm,读shān 第63号元素:铕[化学符号]Eu,读yǒu 第64号元素:钆[化学符号]Gd,读gá第65号元素:铽[化学符号]Tb,读tè第66号元素:镝[化学符号]Dy,读dī第67号元素:钬[化学符号]Ho,读huǒ第68号元素:铒[化学符号]Er,读ěr 第69号元素:铥[化学符号]Tm,读diū第70号元素:镱[化学符号]Yb,读yì第71号元素:镥[化学符号]Lu,读lǔ第72号元素:铪[化学符号]Hf,读hā第73号元素:钽[化学符号]Ta,读tǎn 第74号元素:钨[化学符号]W,读wū第75号元素:铼[化学符号]Re,读lái 第76号元素:锇[化学符号]Os,读é第77号元素:铱[化学符号]Ir,读yī第78号元素:铂[化学符号]Pt,读bó第79号元素:金[化学符号]Au,读jīn 第80号元素:汞[化学符号]Hg,读gǒng 第81号元素:铊[化学符号]Tl,读tā第82号元素:铅[化学符号]Pb,读qiān 第83号元素:铋[化学符号]Bi,读bì第84号元素:钋[化学符号]Po,读pō第85号元素:砹[化学符号]At,读ài 第86号元素:氡[化学符号]Rn,读dōng 第87号元素:钫[化学符号]Fr,读fāng第89号元素:锕[化学符号]Ac,读ā第90号元素:钍[化学符号]Th,读tǔ第91号元素:镤[化学符号]Pa,读pú第92号元素:铀[化学符号]U,读yóu第93号元素:镎[化学符号]Np,读ná第94号元素:钚[化学符号]Pu,读(bù第95号元素:镅[化学符号]Am,读méi第96号元素:锔[化学符号]Cm,读jū第97号元素:锫[化学符号]Bk,读péi第98号元素:锎[化学符号]Cf,读kāi第99号元素:锿[化学符号]Es,读āi第100号元素:镄[化学符号]Fm,读fèi 第101号元素:钔[化学符号]Md,读mén 第102号元素:锘[化学符号]No,读nuò第103号元素:铹[化学符号]Lw,读láo 第104号元素:鐪[化学符号]Rf,读第105号元素:钅杜[化学符号]Db,读dù第106号元素:钅喜[化学符号]Sg,读xǐ第107号元素:钅波[化学符号]Bh,读bō第108号元素:钅黑[化学符号]Hs,读hēi 第109号元素:钅麦[化学符号]Mt,读mài 第110号元素:鐽[化学符号]Ds,读dá第111号元素:钅仑[化学符号]Rg,读lún 第112号元素:uub(112)第113号元素:uut(113)第114号元素:uuq(114)第115号元素:uup(115)第116号元素:uuh(116)化学元素周期表顺口溜巧记我是氢,我最轻,火箭靠我运卫星; 我是氦,我无赖,得失电子我最菜; 我是铍,耍赖皮,虽是金属难电离; 我是硼,有点红,论起电子我很穷; 我是碳,反应慢,既能成链又成环; 我是氮,我阻燃,加氢可以合成氨; 我是氧,不用想,离开我就憋得慌; 我是氟,最恶毒,抢个电子就满足; 我是氖,也不赖,通电红光放出来; 我是钠,脾气大,遇酸遇水就火大; 我是镁,最爱美,摄影烟花放光辉; 我是铝,常温里,浓硫酸里把澡洗; 我是硅,色黑灰,信息元件把我堆; 我是磷,害人精,剧毒列表有我名; 我是硫,来历久,沉淀金属最拿手; 我是氯,色黄绿,金属电子我抢去; 我是氩,活性差,霓虹紫光我来发; 我是钾,把火加,超氧化物来当家; 我是钙,身体爱,骨头牙齿我都在; 我是钛,过渡来,航天飞机我来盖; 我是铬,正六铬,酒精过来变绿色; 我是锰,价态多,七氧化物爆炸猛; 我是铁,用途广,不锈钢喊我叫爷; 我是铜,色紫红,投入硝酸气棕红; 我是砷,颜色深,三价元素夺你魂; 我是溴,挥发臭,液态非金我来秀; 我是铷,碱金属,沾水烟花钾不如; 我是碘,升华烟,遇到淀粉蓝点点; 我是铯,金黄色,入水爆炸容器破; 我是钨,高温度,其他金属早呜呼;我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易融化,沸点很高难蒸发;我是铟,软如金,轻微放射宜小心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液里有玄机;我是铅,能储电,子弹头里也出现。


碳硅硼的实验报告
《碳硅硼实验报告》
实验目的:通过实验观察碳、硅和硼在不同条件下的性质和反应,探究它们在
化学反应中的作用。
实验材料:碳粉、硅粉、硼粉、试管、酒精灯、试管夹、试管架、磁力搅拌器、酒精灯、试管架、试管夹、试管刷、滤纸、蒸馏水。
实验步骤:
1. 将碳粉、硅粉和硼粉分别放入不同的试管中。
2. 在每个试管中加入少量蒸馏水,并用试管架夹住试管。
3. 将试管放置在酒精灯上加热,观察试管中物质的变化。
4. 用磁力搅拌器搅拌试管中的物质,观察其反应情况。
实验结果:
1. 碳粉在加热后产生气体,放置在试管口会发生明亮的火花,表明碳粉具有易
燃性。
2. 硅粉在加热后没有明显变化,但在加热后与氧气反应会产生硅酸盐。
3. 硼粉在加热后产生明亮的火花,表明硼粉也具有易燃性。
实验结论:
1. 碳在加热条件下具有易燃性,可与氧气反应产生二氧化碳。
2. 硅在加热条件下与氧气反应产生硅酸盐,具有一定的化学活性。
3. 硼在加热条件下也具有易燃性,产生明亮的火花。
通过本次实验,我们对碳、硅和硼在不同条件下的性质和反应有了更深入的了解,这对我们进一步研究它们在化学反应中的作用具有重要意义。
希望通过不
断的实验探究,我们能够更好地理解和应用这些化学元素。

碳硅硼14-1 通性一、碳、硅、硼的基本性质碳、硅、硼的基本性质性质碳硅硼元素符号原子序数原子量价电子构型常见氧化态共价半径/pm离子半径/pm M 4+M 3+第一电离能/(kJ/mol) 第一电子亲合能/(kJ/mol) 电负性(Pauling 标度)C612.012s22p 2+2 ,+477151086.5121.92.5Si1428.093s23p20 ,+411741786.6133.61.8B510.812s22p 10 ,+320800.726.732.0二、电子构型和成键特征碳在元素周期表中位于非金属性最强的卤素元素和金属性最强的碱金属之间。
它的价电子层结构为2s 2 2p2,在化学反应中它既不容易失去电子,也不容易得到电子,难以形成离子键,而是形成特有的共价键,它的最高共价数显然为 4 。
碳原子以sp 3 杂化,可以生成 4 个δ键,形成正四面体构型。
例如金刚石、甲烷CH4等;碳原子以sp 2 杂化,生成 3 个δ键, 1 个π键,平面三角形构型。
例如石墨、C2H4等;碳原子以sp 杂化,生成 2 个δ键、2 个π键,直线形构型。
例如CO 2、HCN 、C2H2等;碳原子以sp 杂化,生成 1 个δ键, 1 个π键,1 个配位π键和 1 对孤对电子对,直线型构型。
例如CO 。
碳原子不仅仅可以形成单键、双键和叁键,碳原子之间还可以形成长长的直链、环形链、支链等等。
纵横交错,变幻无穷,再配合上氢、氧、硫、磷、和金属原子,就构成了种类繁多的碳化合物。
硅通常以sp3杂化,生成4 个δ键,但由于其原子半径较大,不易形成π键,但可用3d 价轨道,以sp3d2 杂化形成配位数为 6 的δ键,如SiF62- 。
或与PO43-类似形成d-p π键,如SiO42-。
B 原子的价电子结构是2s22p1 ,它能提供成键的电子是2s 1 2p x1 2p y1,还有一个P 轨道是空的。
B 原子的价电子数少于价层轨道数,在成键时,价电子未被充满,所以 B 原子是缺电子原子,容易形成多中心键。

作物需要的十七种元素以及符号作物生长发育所需的17种元素是:碳(C)、氢(H)、氧(O)、氮(N)、磷(P)、钾(K)、钙(Ca)、镁(Mg)、硫(S)、铁(Fe)、锰(Mn)、锌(Zn)、铜(Cu)、铝(Al)、钼(Mo)、硼(B)和硅(Si)。
首先,碳(C)、氢(H)和氧(O)是构成有机物的基本元素。
通过光合作用,植物能够从空气中吸收二氧化碳,食物中获得碳。
植物也需要水分来提供氢和氧。
氮(N)是植物构建氨基酸、核酸和叶绿素等生物大分子的组成部分。
它是植物生长所需的主要营养元素之一,用于合成蛋白质和核酸等物质。
磷(P)在植物中主要参与能量转移过程,而且对根系的生长和发育有重要作用。
它是植物DNA和RNA分子的一部分,也参与调节酶的活性。
钾(K)在植物中具有多种功能,其中之一是调节植物渗透压和水分平衡,影响细胞膜的稳定性。
钾还参与植物代谢中的离子调节、光合作用、植物逆境应答等过程。
钙(Ca)是植物中的一种重要信号分子,它参与了许多细胞信号转导的过程。
此外,钙还对植物细胞壁的形成和细胞间的黏合起着重要作用。
镁(Mg)是叶绿素的主要组成部分,是光合作用所需的重要成分。
镁还参与多种酶反应,如ATP的合成和DNA的稳定性。
硫(S)是构成许多植物蛋白质的必需元素之一。
它是胺基酸的一部分,并且是硫醇和二硫键的组成部分。
铁(Fe)在植物中作为叶绿素和细胞色素的组成部分,对植物的呼吸和光合作用至关重要。
铁还参与多种酶反应,如维生素合成和氮代谢。
锰(Mn)是植物体内多种酶的结构和功能的必需元素。
它参与植物的氮代谢、光合作用和抗氧化作用。
锌(Zn)在植物中作为化合酶的辅酶,参与氮代谢、光合作用、植物激素合成等。
锌还在植物中调节DNA的合成和稳定性。
铜(Cu)是植物体内一类重要酶的组成和催化次要反应的辅助因子。
它参与植物的光合作用和免疫应答。
铝(Al)在土壤中广泛存在,但对大多数作物来说是有害的。
高浓度的铝可以抑制植物生长和发育。

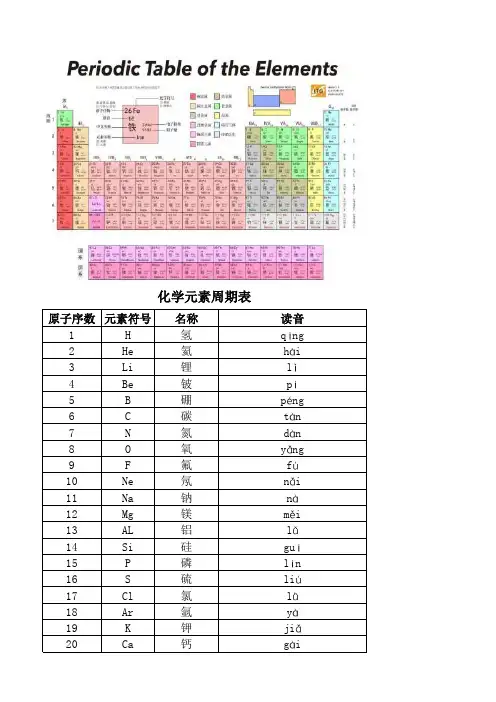
化学元素介绍化学元素介绍11 氢(qīng)H 62 氦(hài)He 63 锂(lǐ)Li 74 铍(pí)Be 85 硼(péng)B 96 碳(tàn)C 97 氮(dàn)N 108 氧(yǎng)O 109 氟(fú)F 1110 氖(nǎi)Ne 1211 钠(nà)Na 1212 镁(měi)Mg 1313 铝(lǚ)Al 1414 硅(guī)Si 1415 磷(lín)P 1516 硫(liú)S 1617 氯(lǜ)Cl 1618 氩(yà)Ar 1719 钾(jiǎ)K 1820 钙(gài)Ca 1822 钛(tài)Ti 2023 钒(fán)V 2024 铬(gè)Cr 2125 锰(měng)Mn 2226 铁(tiě)Fe 2227 钴(gǔ)Co 2328 镍(niè)Ni 2429 铜(tóng)Cu 2530 锌(xīn)Zn 2531 镓(jiā)Ga 2632 锗(zhě)Ge 2733 砷(shēn)As 2734 硒(xī)Se 2835 溴(xiù)Br 2936 氪(kè)Kr 2937 铷(rú)Rb 3038 锶(sī)Sr 3039 钇(yǐ)Y 3140 锆(gào)Zr 3141 铌(ní)Nb 3242 钼(mù)Mo 3344 钌(liǎo)Ru 3445 铑(lǎo)Rh 3446 钯(pá)Pd 3547 银(yín)Ag 3648 镉(gé)Cd 3649 铟(yīn)In 3750 锡(xī)Sn 3851 锑(tī)Sb 3852 碲(dì)Te 3953 碘(diǎn)I 3954 氙(xiān)Xe 4055 铯(sè)Cs 4156 钡(bèi)Ba 4157 镧(lán)La 4258 铈(shì)Ce 4259 镨(pǔ)Pr 4360 钕(nǚ)Nd 4361 钷(pǒ)Pm 4462 钐(shān)Sm 4463 铕(yǒu)Eu 4464 钆(gá)Gd 4566 镝(dí)Dy 4667 钬(huǒ)Ho 4668 铒(ěr)Er 4769 铥(diū)Tm 4770 镱(yì)Yb 4771 镥(lù)Lu 4872 铪(hā)Hf 4873 钽(tǎn)Ta 4974 钨(wū)W 5075 铼(lái)Re 5076 锇(é)O s 5177 铱(yī)I r 5278 铂(bó)Pt 5279 金(jīn)Au 5380 汞(gǒng)Hg 5481 铊(tā)Tl 5482 铅(qiān)Pb 5583 铋(bì)Bi 5684 钋(pō)Po 5685 砹(ài)At 5786 氡(dōng)Rn 5788 镭(léi)Ra 5889 锕(ā)Ac 5990 钍(tǔ)Th 5991 镤(pú)Pa 6092 铀(yóu)U 6093 镎(ná)Np 6194 钚(bù)Pu 6195 镅(méi)Am 6296 锔(jū)Cm 6297 锫(péi)Bk 6398 锎(kāi)Cf 6399 锿(āi)Es 63 100 镄(fèi)Fm 64 101 钔(mén)Md 64 102 锘(nuò)No 64 103 铹(láo)Lr 64 104 鈩(íǔ)Rf 65 105 钅杜Db 66 106 钅喜Sg 66 107 钅波Bh 67 108 钅黑Hs 671 氢(qīng)H原子序数1,元素名来源于希腊文,原意是“水素”。
第四节碳硅硼一.知识梳理1.碳硅硼的结构特征成键方式及其特点1·1 C与Si相似性与差异性(1)相似性:①皆不易形成+4价离子,而主要以共价键存在;②单质皆不活泼;③都能与H—AH4、Cl— ACl4、O—AO2;(2)差异性:①CH4极稳定,不与酸碱反应,而SiH4则被碱水解;②CCl4极稳定,而SiCl4极易水解;③CO2是气体(分子晶体),SiO2是熔点极高的固体(原子晶体);④碳氢化物C n H2n+2中n几乎可以无限扩大,而Si n H2n+2中n最高为15;(3)差别的原因:①C第二周期,无可资利用的d轨道,最高配位数为4;而Si第三周期,有可资利用的d轨道,最高配位数为6;②Si-Si间形成共价键的倾向远不及C-C,此外C=C、C≡C是司空见惯,而Si=Si、Si≡Si实属罕见;③C与O成双键甚至叁键,而Si不能,因此CO2是小分子,而SiO2是巨型分子。
1·2 B与Si的相似性:B与Si处在对角线上,故有许多相似性。
①在自然界中,二者都是以含氧化合物存在;②二者在单质状态下都有半导体的性质;③B-O键和Si-O键都很稳定;④氢化物多种多样,都有挥发性,且可自燃(在空气中),并能水解;⑤卤化物均易水解;⑥H3BO3、H4SiO4都是弱酸,都能形成多酸盐,结构都很复杂⑦氧化物都能熔解金属氧化物,生成特殊颜色的盐2.碳硅硼的单质2·1 碳的同素异形体碳有三种同素异形体:金刚石、石墨、碳原子簇(富勒烯)。
(1)金刚石:金刚石是巨型共价分子,碳原子以sp3杂化轨道成键,形成空间网状结构,是原子晶体,属立方晶系面心立方晶体,C-C键能为345.6kJ.mol-1。
分子中无自由运动的电子,是绝缘体;(2)石墨:又称“黑铅”,碳原子以sp2杂化方式成键,形成层状结构,属于混合型晶体,层与层间以分子间力结合。
无定形碳和碳黑都是石墨微晶。
石墨软,能导电,属于导体,高熔点、高沸点,这些性质都与其独特的结构相关。
化学周期表化学元素周期表元素周期表中的元素(每周期开头设为空4个字节)1H氢 1.00792He氦 4.00263Li 锂 6.9414Be铍9.01225B硼10.8116C碳12.0117N 氮14.0078O氧15.9999F氟18.99810Ne氖20.1711 Na钠22.989812Mg镁24.30513Al铝26.98214Si硅28.08515P磷30.97416S硫32.0617Cl氯35.45318Ar 氩39.9419K钾39.09820Ca钙40.0821Sc钪44.95622 Ti钛47.923V钒50.9424Cr铬51.99625Mn锰54.938 26Fe铁55.8427Co钴58.933228Ni镍58.6929Cu铜63.5430Zn锌65.3831Ga镓69.7232Ge锗72.533As 砷74.92234Se硒78.935Br溴79.90436Kr氪83.837 Rb铷85.46738Sr锶87.6239Y钇88.90640Zr锆91.2241Nb铌92.906442Mo钼95.9443Tc锝(99)44Ru 钌161.045Rh铑102.90646Pd钯106.4247Ag银107.86848Cd镉112.4149In铟114.8250Sn锡118.6 51Sb锑121.752Te碲127.653I碘126.90554Xe氙131.355Cs铯132.90556Ba钡137.3357-71La-Lu镧系57La镧138.958Ce铈140.159Pr镨140.960Nd钕144.261Pm钷(147)62Sm钐150.363Eu铕151.9664 Gd钆157.2565Tb铽158.966Dy镝162.567Ho钬164.968Er铒167.269Tm铥168.970Yb镱173.0471 Lu镥174.96772Hf铪178.473Ta钽180.94774W钨183.875Re铼186.20776Os锇190.277Ir铱192.278 Pt铂195.0879Au金196.96780Hg汞200.581Tl铊204.382Pb铅207.283Bi铋208.9884Po钋(209)85At 砹(201)86Rn氡(222)87Fr钫(223)88Ra镭226.03 89-103Ac-Lr锕系89Ac锕(227)90Th钍232.091Pa镤231.092U铀238.093Np镎(237)94Pu钚(239,244)95 Am镅(243)96Cm锔(247)97Bk锫(247)98Cf锎(251)99 Es锿(252)100Fm镄(257)101Md钔(258)102No锘(259) 103Lr铹(260)104Rf钅卢(257)105Db钅杜(261)106Sg钅喜(262)107Bh钅波(263)108Hs钅黑(262)109Mt钅麦(265) 110Ds钅达(266)111Rg钅仑(272)112Uub(285)113 Uut(284)114Uuq(289)115Uup(289)116Uuh(292)117 Uus(*)/*尚未被发现*/118Uuo(293)?6?7?6?7各个元素的读音氢(qīng)氦(hài)锂(lǐ)铍(pí)硼(p?0?0ng)碳(tàn)氮(dàn)氧(yǎng)氟(fú)氖(nǎi)钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín)硫(liú)氯(lǜ)氩(yà)钾(jiǎ)钙(gài)钪(kàng)钛(tài)钒(fán)铬(g?0?9)锰(měng)铁(tiě)钴(gǔ)镍(ni?0?9)铜(t?0?7ng)锌(xīn)镓(jiā)锗(zhě)砷(shēn)硒(xī)溴(xiù)氪(k?0?9)铷(rú)锶(sī)钇(yǐ)锆(gào)铌(ní)钼(mù)锝(d?0?0)钌(liǎo)铑(lǎo)钯(pá)银(yín)镉(g?0?0)铟(yīn)锡(xī)锑(tī)碲(dì)碘(diǎn)氙(xiān)铯(s?0?9)钡(b?0?9i)镧(lán)铪(hā)钽(tǎn)钨(wū)铼(lái)锇(?0?0)铱(yī)铂(b?0?7)金(jīn)汞(gǒng)铊(tā)铅(qiān)铋(bì)钋(pō)砹(ài)氡(dōng)钫(fāng)镭(l?0?0i)锕(ā)钅卢(lú)钅杜(dù)钅喜(xǐ)钅波(bō)钅黑(hēi)钅麦(mài)钅达(dá)钅仑(lún)镧(lán)铈(shì)镨(pǔ)钕(nǚ)钷(pǒ)钐(shān)铕(yǒu)钆(gá)铽(t?0?9)镝(dí)钬(huǒ)铒(ěr)铥(diū)镱(yì)镥(lǔ)锕(ā)钍(tǔ)镤(pú)铀(y?0?7u)镎(ná)钚(bù)镅(m?0?0i)锔(jū)锫(p?0?0i)锎(kāi)锿(āi)镄(f?0?9i)钔(m?0?0n)锘(nu?0?6)铹(láo)小结:其实大多数元素的读音比较好读,只要读半边就可以了。
初三化学20个元素表口诀【初三化学元素表概述】初三化学课程中,元素是基础知识的重要组成部分。
掌握元素的性质、用途和记忆方法对学生的学习有着至关重要的作用。
今天,我们将学习20个常见元素的名称、符号以及相关性质和应用。
【20个元素的名称和符号】1.氢(H)2.氦(He)3.锂(Li)4.铍(Be)5.硼(B)6.碳(C)7.氮(N)8.氧(O)9.氟(F)10.氖(Ne)11.钠(Na)12.镁(Mg)13.铝(Al)14.硅(Si)15.磷(P)16.硫(S)17.氯(Cl)18.氩(Ar)19.钾(K)20.钙(Ca)【元素性质及应用】1.氢:最轻的元素,具有可燃性,用于制备氨、烃类化合物等。
2.氦:惰性气体,可用于保护气、制冷剂等。
3.锂:活泼金属,用于制备锂电池、合金等。
4.铍:硬质金属,用于制造轴承、合金等。
5.硼:半导体材料,用于制备硼半导体器件等。
6.碳:形成无数有机化合物,用于燃料、化学品、碳素材料等。
7.氮:大气中最丰富的元素,用于制备氮肥、合成纤维等。
8.氧:支持燃烧,人体呼吸,用于制备氧化物等。
9.氟:活泼非金属,用于制备氟化物、制冷剂等。
10.氖:惰性气体,用于保护气、照明等。
11.钠:活泼金属,用于制备钠电池、合金等。
12.镁:轻质金属,用于制造轻合金、烟花等。
13.铝:活泼金属,用于制备铝电池、合金等。
14.硅:半导体材料,用于制备硅器件、太阳能电池等。
15.磷:制备磷肥、火柴等,对人体有益。
16.硫:制备硫酸、硫化物等,对人体有毒。
17.氯:制备氯化物、氯气等,用于消毒、漂白等。
18.氩:惰性气体,用于保护气、焊接等。
19.钾:用于制备钾肥、合金等。
20.钙:人体必需元素,用于制备钙化合物、补钙产品等。
【元素记忆口诀】1.氢氦锂铍硼,碳氮氧氟硫。
2.钠镁铝硅磷,钾钙镁铁锂。
3.氢氦锂铍硼,氮氧氟氖氩。
4.钾钙镁铁锌,银汞铂金钛。
【总结】通过本篇文章,我们对初三化学20个元素进行了简要的了解。
化学口诀姓名:班级:座号:化学元素周期表读音1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài)23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo)46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán)58铈(shì)59镨(pǔ)60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè)66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū)70镱(yì)71镥(lǔ)72铪(h ā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(t ā)82铅(qiān)83铋(bì)84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā)90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná)94钚(bù)95镅(méi)96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104 (lú)105 (dù)106 (xǐ)107 (bō)108 (hēi)109 (mài)110 (dá)111 (lún)口诀A、按周期分:第一周期:氢氦----------------------------------------侵害第二周期:锂铍硼碳氮氧氟氖----------------鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩----------------那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰--------------------嫁改康太反革命铁钴镍铜锌镓锗--------------------铁姑捏痛新嫁者砷硒溴氪--------------------------------生气休克第五周期:铷锶钇锆铌----------------------------如此一告你钼锝钌------------------------------------不得了铑钯银镉铟锡锑--------------------老把银哥印西堤碲碘氙------------------------------------地点仙第六周期:铯钡镧铪--------------------------------(彩)色贝(壳)蓝(色)河钽钨铼锇--------------------------------但(见)乌(鸦)(引)来鹅铱铂金汞砣铅------------------------一白巾供它牵铋钋砹氡--------------------------------必不爱冬(天)第七周期:钫镭锕------------------------------------防雷啊!侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。