碳、硅、硼
- 格式:ppt
- 大小:7.16 MB
- 文档页数:5

第十七章碳,硅,硼基本要求:1、掌握碳的单质,氧化物,碳酸,碳酸盐的结构和性质。
2、掌握单质硅,氧化物与硅酸的性质和结构。
3、掌握硼的单质,氢化物,含氧化合物的结构和性质,掌握缺电子原子的结构特点。
我们对卤素元素作了较系统的讨论,对ⅥA,ⅤA族阐述的重点只是本周期的一些常见元素——氧,硫,氮,磷。
本章包括ⅥA碳,硅,锗,锡,铅组成及ⅢA硼,铅,镓,铟,铊组成。
对这两族,在本章只重点学习碳,硅,硼这三个非金属元素,对其它金属放在以后学习。
碳是第二周期元素,我们仍应注意它在族中的特殊表现,硼的价电子数(3个)少于价电子层轨道数(4个),它是具有这种特征的唯一非金属元素,常称为缺电子原子,由此带来一系列性质表现。
学习时应注意。
我们一再指出,学习元素知识应注意运用对比方法,寻找知识间的异同点。
本章里,碳和硅虽然是同族元素,我们不妨找它们间的相同点。
相反,硼和硅虽非同族元素,我们力求寻找它们间的相似处,便于学习,掌握。
§17-1 概述对ⅥA—ⅤA一些元素的性质及其递变规律总结如下:1-1、形成原子晶体从ⅥA—ⅤA族,非金属但是多为双原子或多原子的有限分子,组成分子晶体,而C,Si,B都能形成原子间共价结合的庞大分子,组成原子晶体。
金刚石是碳的同素异形体之一,具有典型的原子晶体结构,其中每个C原子以共价键(sp3)和其他4个C原子键合,构成坚固的,连续的网状骨架结构。
碳的另一种同素异形体石墨,它的性质和金刚石有很大差别,石墨很软,能导电;而金刚石很硬,不导电截然相反。
石墨的这些性质完全由它的晶体结构所决定,石墨晶体中,C原子的4个价电子轨道仅3个参与了杂化,形成的3个sp2杂化轨道与相邻3个C原子的相应轨道构成σ单键,排列在一个平面,再引伸开去便成六角平面的网状结构,整个晶体中这种互相平行的许多平面,构成了层状结构。
另外,C原子还剩有一个未杂化的P电子,这些P轨道垂直分布于平面上下,并可以象金属晶体中的自由电子那样,自由表示,而层间地在层间宽广范围内流动,构成极多个C原子间相互重叠的离域ヰ键,用ヰxx作用力是范德华力。

一、实验目的1. 了解碳、硅、硼三种元素的基本性质。
2. 掌握碳、硅、硼的化学反应规律。
3. 学习实验操作技能,提高实验分析能力。
二、实验原理碳、硅、硼是化学元素周期表中相邻的三种元素,它们在自然界中广泛存在,具有不同的物理和化学性质。
本实验通过观察碳、硅、硼的燃烧、反应等现象,了解它们的性质。
三、实验材料与仪器1. 实验材料:碳(石墨)、硅(石英砂)、硼(硼砂)、氧气、酒精灯、试管、镊子、烧杯、试管夹等。
2. 实验仪器:分析天平、电子显微镜、光谱仪等。
四、实验步骤1. 碳的燃烧实验(1)将少量碳(石墨)放入试管中,用酒精灯点燃。
(2)观察燃烧现象,记录燃烧温度、火焰颜色、燃烧产物等。
(3)将燃烧后的产物放入烧杯中,加入适量水,观察溶解情况。
2. 硅的燃烧实验(1)将少量硅(石英砂)放入试管中,用酒精灯点燃。
(2)观察燃烧现象,记录燃烧温度、火焰颜色、燃烧产物等。
(3)将燃烧后的产物放入烧杯中,加入适量水,观察溶解情况。
3. 硼的燃烧实验(1)将少量硼(硼砂)放入试管中,用酒精灯点燃。
(2)观察燃烧现象,记录燃烧温度、火焰颜色、燃烧产物等。
(3)将燃烧后的产物放入烧杯中,加入适量水,观察溶解情况。
4. 碳、硅、硼的反应实验(1)将碳、硅、硼分别与氧气反应,观察反应现象。
(2)将反应产物进行光谱分析,确定反应产物。
五、实验结果与分析1. 碳的燃烧实验结果:(1)燃烧温度:约3000℃;(2)火焰颜色:蓝色;(3)燃烧产物:二氧化碳。
2. 硅的燃烧实验结果:(1)燃烧温度:约1700℃;(2)火焰颜色:无色;(3)燃烧产物:二氧化硅。
3. 硼的燃烧实验结果:(1)燃烧温度:约300℃;(2)火焰颜色:无色;(3)燃烧产物:三氧化二硼。
4. 碳、硅、硼的反应实验结果:(1)碳与氧气反应:生成二氧化碳;(2)硅与氧气反应:生成二氧化硅;(3)硼与氧气反应:生成三氧化二硼。
六、实验结论1. 碳、硅、硼在燃烧过程中分别生成二氧化碳、二氧化硅、三氧化二硼;2. 碳、硅、硼在氧气中燃烧时,燃烧温度、火焰颜色、燃烧产物均有所不同;3. 本实验通过观察碳、硅、硼的燃烧现象,了解了它们的基本性质。


碳硅硼实验报告实验目的通过碳硅硼实验,探索碳、硅、硼元素在化学实验中的性质和用途。
实验材料1.碳元素样本2.硅元素样本3.硼元素样本4.化学实验器材:试管、试剂瓶等5.实验平台和工具实验步骤1.准备工作–检查所需材料和器材的完整性和可用性。
–穿戴实验室所需的安全防护用品,如实验室服、手套和护目镜。
2.实验准备–将碳元素样本放置在试管中,并加热。
–观察并记录碳元素在加热过程中的变化。
3.实验观察–观察碳元素在加热过程中的变化,如颜色、形态等。
–记录观察结果并进行分析。
4.实验准备–将硅元素样本放置在试管中,并加入酸性溶液。
–观察并记录硅元素在酸性溶液中的反应。
5.实验观察–观察硅元素在酸性溶液中的反应情况,如气体产生、颜色变化等。
–记录观察结果并进行分析。
6.实验准备–将硼元素样本放置在试管中,并加入氧化剂。
–观察并记录硼元素在氧化剂中的反应。
7.实验观察–观察硼元素在氧化剂中的反应情况,如火焰颜色、气体产生等。
–记录观察结果并进行分析。
实验结果与分析碳元素实验结果与分析在加热过程中,碳元素发生燃烧反应,产生火焰和黑色烟雾。
这是因为碳在高温下与氧气反应,生成二氧化碳。
由于燃烧反应需要足够的氧气供应,所以需加热较长时间碳样本才能完全燃烧。
硅元素实验结果与分析硅元素与酸性溶液反应生成硅酸,同时会释放出气体,通常是二氧化硅气体。
酸性溶液的反应可以用来检测硅的存在,并用于工业和实验室中的硅分析。
硼元素实验结果与分析在氧化剂的作用下,硼元素会生成独特的绿色火焰。
这种火焰颜色可以用来检测硼的存在,并在实验室中用于硼的定性和定量分析。
结论通过碳硅硼实验,我们发现了碳、硅、硼元素在化学实验中的性质和用途。
碳元素在加热时会发生燃烧反应,硅元素与酸性溶液反应生成硅酸,硼元素在氧化剂的作用下会生成独特的绿色火焰。
注意事项1.在实验过程中要严格遵守实验室安全规定,做好安全防护措施。
2.实验结束后要对实验器材进行清洁,并按照相关规定进行废弃物处理。

碳硅硼的实验报告
《碳硅硼实验报告》
实验目的:通过实验观察碳、硅和硼在不同条件下的性质和反应,探究它们在
化学反应中的作用。
实验材料:碳粉、硅粉、硼粉、试管、酒精灯、试管夹、试管架、磁力搅拌器、酒精灯、试管架、试管夹、试管刷、滤纸、蒸馏水。
实验步骤:
1. 将碳粉、硅粉和硼粉分别放入不同的试管中。
2. 在每个试管中加入少量蒸馏水,并用试管架夹住试管。
3. 将试管放置在酒精灯上加热,观察试管中物质的变化。
4. 用磁力搅拌器搅拌试管中的物质,观察其反应情况。
实验结果:
1. 碳粉在加热后产生气体,放置在试管口会发生明亮的火花,表明碳粉具有易
燃性。
2. 硅粉在加热后没有明显变化,但在加热后与氧气反应会产生硅酸盐。
3. 硼粉在加热后产生明亮的火花,表明硼粉也具有易燃性。
实验结论:
1. 碳在加热条件下具有易燃性,可与氧气反应产生二氧化碳。
2. 硅在加热条件下与氧气反应产生硅酸盐,具有一定的化学活性。
3. 硼在加热条件下也具有易燃性,产生明亮的火花。
通过本次实验,我们对碳、硅和硼在不同条件下的性质和反应有了更深入的了解,这对我们进一步研究它们在化学反应中的作用具有重要意义。
希望通过不
断的实验探究,我们能够更好地理解和应用这些化学元素。

碳硅硼14-1 通性一、碳、硅、硼的基本性质碳、硅、硼的基本性质性质碳硅硼元素符号原子序数原子量价电子构型常见氧化态共价半径/pm离子半径/pm M 4+M 3+第一电离能/(kJ/mol) 第一电子亲合能/(kJ/mol) 电负性(Pauling 标度)C612.012s22p 2+2 ,+477151086.5121.92.5Si1428.093s23p20 ,+411741786.6133.61.8B510.812s22p 10 ,+320800.726.732.0二、电子构型和成键特征碳在元素周期表中位于非金属性最强的卤素元素和金属性最强的碱金属之间。
它的价电子层结构为2s 2 2p2,在化学反应中它既不容易失去电子,也不容易得到电子,难以形成离子键,而是形成特有的共价键,它的最高共价数显然为 4 。
碳原子以sp 3 杂化,可以生成 4 个δ键,形成正四面体构型。
例如金刚石、甲烷CH4等;碳原子以sp 2 杂化,生成 3 个δ键, 1 个π键,平面三角形构型。
例如石墨、C2H4等;碳原子以sp 杂化,生成 2 个δ键、2 个π键,直线形构型。
例如CO 2、HCN 、C2H2等;碳原子以sp 杂化,生成 1 个δ键, 1 个π键,1 个配位π键和 1 对孤对电子对,直线型构型。
例如CO 。
碳原子不仅仅可以形成单键、双键和叁键,碳原子之间还可以形成长长的直链、环形链、支链等等。
纵横交错,变幻无穷,再配合上氢、氧、硫、磷、和金属原子,就构成了种类繁多的碳化合物。
硅通常以sp3杂化,生成4 个δ键,但由于其原子半径较大,不易形成π键,但可用3d 价轨道,以sp3d2 杂化形成配位数为 6 的δ键,如SiF62- 。
或与PO43-类似形成d-p π键,如SiO42-。
B 原子的价电子结构是2s22p1 ,它能提供成键的电子是2s 1 2p x1 2p y1,还有一个P 轨道是空的。
B 原子的价电子数少于价层轨道数,在成键时,价电子未被充满,所以 B 原子是缺电子原子,容易形成多中心键。


碳硅硼实验报告引言最近,我们进行了一项关于碳硅硼的实验,在本实验中,我们研究了这三种元素在不同条件下的特性和应用。
以下是实验的过程、结果和相关讨论。
实验目的本实验的目的是比较碳、硅和硼在不同环境中的性质和反应,以深入理解它们的化学行为和可能的应用。
我们将通过分析实例来评估它们在生活和工业中的潜力。
实验步骤和结果1. 实验一:燃烧测试我们使用一小块纯碳、硅和硼制成的样本进行了燃烧测试。
结果显示,碳燃烧形成CO2气体,硅燃烧生成SiO2气体,而硼燃烧则形成B2O3气体。
这些结果反映了它们不同的化学性质和氧化能力。
2. 实验二:溶解性测试我们将碳、硅和硼分别加入酸性溶液中,并观察它们的溶解情况。
结果显示,碳在酸性环境中不溶解,而硅和硼却与酸反应产生相应的化合物。
这表明碳与硅、硼的化学性质有所不同,也证实了硅和硼的应用潜力。
3. 实验三:导电性测试我们使用实验仪器测试了碳、硅和硼的导电性。
结果显示,碳是一个良好的导体,可以传导电流。
而硅和硼则具有较差的导电性,表明它们更适合作为绝缘材料使用。
这揭示了碳和硅、硼在电子学领域的不同应用。
讨论和应用根据实验结果,我们可以得出以下结论和应用建议:1. 碳的化学性质稳定,能够燃烧并生成二氧化碳。
它是生物体的基本组成部分之一,也用于制作材料和燃料。
2. 硅具有良好的耐热性和耐腐蚀性。
它在电子行业中被广泛应用于制造半导体和太阳能电池板。
3. 硼具有很高的硬度,可以广泛用于制造陶瓷材料、金属合金和防护材料。
总结通过这项实验,我们深入了解了碳、硅和硼在不同条件下的化学行为和应用潜力。
这些元素在生活和工业中扮演着重要角色,并且有望在未来的研究和应用中继续发挥重要作用。
进一步的实验和研究将有助于揭示碳硅硼的更多特性和用途,为科学发展提供更多的可能性。
参考资料:- “Introduction to Carbon,” Royal Society of Chemistry.- “Silicon,” Jefferson Lab.- “Boron,” University of Waterloo.。


第14章 碳、硅、硼14.1. 对比等电子体CO 与N 2的分子结构及主要物理、化学性质。
解:CO 和N 2是等电子体(14e ),分子轨道能级图相似,分子中都有三重键:∶N ≡N ∶、C O δ+δ-∶∶,键能相近。
一般条件下,两种物质都是气体,很少溶于水;熔、沸点,临界压力,临界温度等一些物理性质也相似。
但CO 和N 2分子中三重键特点并不完全相同,N 2分子中负电荷分布是对称的,而CO 却是不对称的。
C 原子略带负电荷,再加上C 的电负性比N 小,因此CO 比N 2较易给出电子对向过渡金属原子(离子)配位,除形成σ―配键外,还有π―反馈键形成,故生成的配合物较稳定。
而N 2的配位能力远不如CO ,分子氮配合物远不如羰基化合物稳定。
所以CO 的键能虽比N 2略大,但化学性质却比N 2要活泼,不象N 2那样“惰性”。
14.2 概述CO 的实验室制法及收集方法,写出CO 与下列物质起反应的方程式并注明反应的条件:(1)Ni ;(2)CuCl ;(3)NaOH ;(4)H 2 ;(5)PdCl 2 解:CO 的实验室制法:HCOOH浓H 2SO 42O用排水集气法收集。
(1)Ni + 4CO100 -250atm 423 -493KNi(CO)4(2)(3)CO + NaOH HCOONa1.01×103kPa473K(4)CO + 3H 2CH 4 + H 2O Fe 、Co 、Ni523K,101kPa(5) CO + PdCl 2 + H 2O === Pd ↓ + CO 2 + 2HCl14.3. 某实验室备有CCl 4、干冰和泡沫灭火器(内为Al 2(SO 4)3和NaHCO 3),还有水源和砂。
若有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火;(3)黄磷着火; (4)油着火; (5)木器着火。
解:14.4. 标准状况时,CO 2的溶解度为170 mL / 100g 水:(1)计算在此条件下,溶液中H 2CO 3的实际浓度。
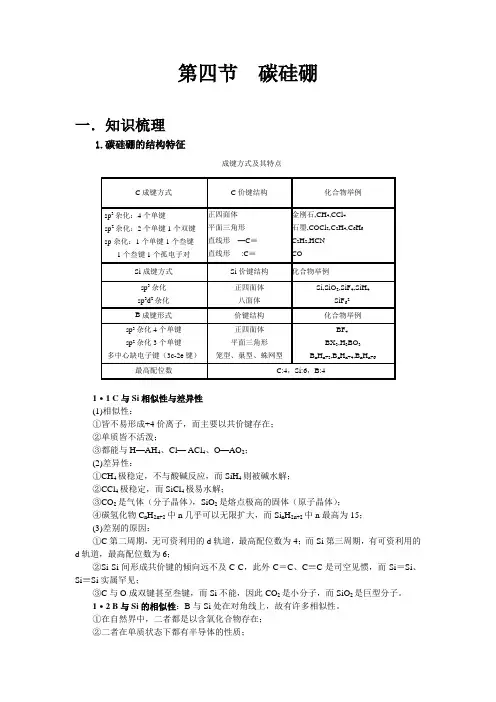
第四节碳硅硼一.知识梳理1.碳硅硼的结构特征成键方式及其特点1·1 C与Si相似性与差异性(1)相似性:①皆不易形成+4价离子,而主要以共价键存在;②单质皆不活泼;③都能与H—AH4、Cl— ACl4、O—AO2;(2)差异性:①CH4极稳定,不与酸碱反应,而SiH4则被碱水解;②CCl4极稳定,而SiCl4极易水解;③CO2是气体(分子晶体),SiO2是熔点极高的固体(原子晶体);④碳氢化物C n H2n+2中n几乎可以无限扩大,而Si n H2n+2中n最高为15;(3)差别的原因:①C第二周期,无可资利用的d轨道,最高配位数为4;而Si第三周期,有可资利用的d轨道,最高配位数为6;②Si-Si间形成共价键的倾向远不及C-C,此外C=C、C≡C是司空见惯,而Si=Si、Si≡Si实属罕见;③C与O成双键甚至叁键,而Si不能,因此CO2是小分子,而SiO2是巨型分子。
1·2 B与Si的相似性:B与Si处在对角线上,故有许多相似性。
①在自然界中,二者都是以含氧化合物存在;②二者在单质状态下都有半导体的性质;③B-O键和Si-O键都很稳定;④氢化物多种多样,都有挥发性,且可自燃(在空气中),并能水解;⑤卤化物均易水解;⑥H3BO3、H4SiO4都是弱酸,都能形成多酸盐,结构都很复杂⑦氧化物都能熔解金属氧化物,生成特殊颜色的盐2.碳硅硼的单质2·1 碳的同素异形体碳有三种同素异形体:金刚石、石墨、碳原子簇(富勒烯)。
(1)金刚石:金刚石是巨型共价分子,碳原子以sp3杂化轨道成键,形成空间网状结构,是原子晶体,属立方晶系面心立方晶体,C-C键能为345.6kJ.mol-1。
分子中无自由运动的电子,是绝缘体;(2)石墨:又称“黑铅”,碳原子以sp2杂化方式成键,形成层状结构,属于混合型晶体,层与层间以分子间力结合。
无定形碳和碳黑都是石墨微晶。
石墨软,能导电,属于导体,高熔点、高沸点,这些性质都与其独特的结构相关。
碳硅硼碳硅硼是一种新兴的材料,由碳、硅和硼三种元素组成。
它具有独特的化学和物理特性,因此在许多领域有广泛的应用潜力。
本文将介绍碳硅硼的特点、制备方法以及应用领域。
特点碳硅硼具有以下几个特点:1.高熔点:碳硅硼的熔点高于许多传统材料,使其在高温环境下表现出色。
这也使得碳硅硼在高温合金、耐火材料等领域有广泛的应用。
2.优异的机械性能:碳硅硼具有良好的硬度、强度和刚性,使其在材料加工、磨削等工艺中表现出色。
它还具有较低的热膨胀系数,使其在高温下保持稳定性。
3.优良的耐腐蚀性:碳硅硼具有很高的抗氧化和耐腐蚀性能,使其在化工、电子等领域中有广泛的应用。
4.良好的导电性:碳硅硼不仅具有良好的电导性,还具有较低的电阻率。
这使得碳硅硼在电子器件、导电材料等领域有着广泛的应用。
制备方法碳硅硼的制备方法主要有以下几种:1.卡诺合成法:卡诺合成法是一种常用的制备碳硅硼的方法。
该方法通过将硅烷和烷基三硼合成气分解,生成碳硅硼材料。
2.溶胶-凝胶法:溶胶-凝胶法是一种将溶液中的硅和碳源进行缩合反应,生成碳硅硼凝胶。
随后,通过热处理将凝胶转化为固态材料。
3.化学气相沉积法:化学气相沉积法是一种通过在高温环境下将碳、硅和硼化合物浓度控制在合适的范围内,生成碳硅硼薄膜的方法。
应用领域碳硅硼在许多领域有广泛的应用,以下是其中一些主要领域:1.化工:碳硅硼具有优异的耐腐蚀性能,可以用于储罐、管道、阀门等化工设备的制造。
它还可以用于催化剂的支撑材料。
2.电子:碳硅硼具有良好的导电性能,可以用于电子器件、电极材料等。
它还可以用于制备半导体材料、太阳能电池等。
3.耐火材料:碳硅硼具有高熔点和优异的耐高温性能,可以用于耐火砖、耐火涂料等耐高温材料的制备。
4.陶瓷:碳硅硼可以用于制备高性能陶瓷材料,如陶瓷刀具、陶瓷轴承等。
总结起来,碳硅硼是一种具有独特特性的新型材料,具有高熔点、优异的机械性能、耐腐蚀性和导电性。
它的制备方法多样,并在化工、电子、耐火材料和陶瓷等领域有广泛的应用。
铁板元素含量铁板元素含量铁板即钢板,是以钢材为主要原料,经挤压成型制造的一种金属板材。
钢板的主要特点是具有良好的力学性能、耐腐蚀性能和可焊接性能。
其中,铁板的元素含量对其机械性能有重要影响。
铁板的元素含量主要包括铁、碳、硅、锰、铬、锌、硼、镍、钛、钡、铝、钙等。
铁含量:铁是钢材的主要元素,其含量与钢材的强度有关。
通常,钢材中的铁含量大于90%,尤其是结构钢,铁含量一般在98%以上。
碳含量:碳是钢材中最重要的有色元素,其含量与钢材的强度和韧性相关。
通常,钢材中的碳含量一般在0.2%-2.0%之间,耐热钢中的碳含量低于0.15%。
硅含量:硅是钢材中重要的稀有元素,其含量与钢材的强度有关。
通常,钢材中的硅含量小于0.5%,耐热钢中的硅含量一般为0.15%-0.20%。
锰含量:锰是钢材中重要的微量元素,其含量与钢材的加工性能有关。
通常,钢材中的锰含量一般低于0.5%,耐热钢中的锰含量一般为0.30%-0.50%。
铬含量:铬是钢材中重要的微量元素,其含量与钢材的抗锈蚀性能有关。
通常,钢材中的铬含量一般低于0.4%,耐热钢中的铬含量一般为0.15%-0.20%。
锌含量:锌是钢材中重要的微量元素,其含量与钢材的抗腐蚀性能有关。
通常,钢材中的锌含量一般小于0.2%,耐热钢中的锌含量一般为0.15%-0.20%。
硼含量:硼是钢材中重要的微量元素,其含量与钢材的强度和韧性有关。
通常,钢材中的硼含量一般小于0.2%,耐热钢中的硼含量低于0.10%。
镍含量:镍是钢材中重要的微量元素,其含量与钢材的强度和韧性有关。
通常,钢材中的镍含量一般低于1.0%,耐热钢中的镍含量一般为0.10%-0.20%。
钛含量:钛是钢材中重要的微量元素,其含量与钢材的强度有关。
通常,钢材中的钛含量一般低于0.7%,耐热钢中的钛含量一般为0.25%-0.50%。
钡含量:钡是钢材中重要的稀有元素,其含量与钢材的强度有关。
通常,钢材中的钡含量一般小于0.2%,耐热钢中的钡含量一般为0.08%-0.15%。
初中常见化学元素符号顺口溜
1. 氢是H氧是O,氮N磷P不用愁,氢像个小瘦子,氧像个大气球。
2. 碳C钾K真奇妙,钠Na钙Ca好记牢,碳像小黑粒,钾像个调皮猴。
3. 镁Mg铝Al很友好,锌Zn铁Fe到处有,镁像个小银块,铝像个小薄片。
4. 硫S氟F氯Cl,就像一群小淘气,硫像个黄疙瘩,氟像个小恶魔。
5. 氦He氖Ne氩Ar,都是气体像大侠,氦像个小轻球,氖像个小红灯。
6. 硅Si硼B不复杂,锂Li铍Be也没啥,硅像个小沙粒,硼像个小硬球。
7. 锰Mn铜Cu很特殊,汞Hg金Au很炫酷,锰像个小黑块,铜像个小铜币。
8. 银Ag铂Pt高大上,锡Sn铅Pb很平常,银像个小月亮,铂像个小贵族。
9. 氢H氢,像根针,扎进化学元素心。
10. 氧O氧,像个圈,圈住万物活力添。
11. 氮N氮,像个蛋,隐藏能量不一般。
12. 碳C碳,像煤炭,燃烧起来火光灿。
13. 钾K钾,像个钾,活泼得像个小哪吒。
14. 钠Na钠,像个娃,入水就会起水花。
15. 镁Mg镁,像美眉,闪亮登场放光辉。
16. 铝Al铝,像小驴,轻巧好用有潜力。
17. 锌Zn锌,像颗星,化学世界亮晶晶。
18. 铁Fe铁,像老铁,坚韧不拔不妥协。
第四章碳·硅·硼周期系第14族元素碳(Carbon)、硅(Silicon)和第13族硼(Boron),它们均属于非金属元素。
碳是有机世界的主角;硅是无机世界的主角。
近半个世纪以来,对硼化学研究有了重大的突破,它几乎可以与碳化学媲美。
特别是在癌症治疗方面,利用10B同位素可以俘获中子,是一个值得重视的研究动向。
即让10B、11B的混合物集中在脑癌部分,然后用中子照射颅骨,这两种同位素在肿瘤部位发生核反应,便会产生辐射,於是从里向外杀死癌细胞。
因此,作为脑癌的一种化学疗法颇有前途。
配合本章教学的媒体为4.1 概述碳和硅位于IVA族,显然在性质上有一定的相似性,与硅原子相比较,由于碳原子的半径特别小,而电负性颇大,于是在性质上的差异悬殊。
尽管硼和硅不在同一族,然而它们在周期表中处于对角线位置,表现在化学性质上有许多相似之处。
4.1.1 元素的基本性质表4—1碳、硅、硼的一些基本性质4.1.2 成键特征碳的价电子层结构为2s22p2,硅为3s23p2,当它们形成化合物时如CCl4、SiCl4等,中心原子采取sp3杂化,有四个等价的sp3杂化轨道(即成键轨道),它们拥有四个价电子,因此,成键轨道数目等于其价电子数目,称为等电子原子。
硼的价电子层结构为2s22p1,它形成化合物时如BF3,中心原子采取sp2几何形状为四面体形,硼原子有四个sp3杂化轨道(成键轨道),但它仅仅只有三个价电子,凡是价电子数目小于成键轨道数目,称为缺电子原子。
譬如F3BL、L=NH3、N(CH3)3、(CH3)2O等,均以四面体方向成键,F3BL中L的孤对电子给予硼原子上的空轨道,以配键结合。
由于硼具有缺电子原子的特性,导致硼原子与硼原子可以形成多中心键,硼酸的水溶液为一元酸。
当然,在元素周期中除了硼具有缺电子原子的特性,还有铝、铍等。
碳与硼都处于第二周期,在一般的化合物中,它们的最大配位数是4。
碳与硅虽然位于同一族,但是它们的成键特点差别较大。