初中化学必背基础知识点100题(20200514001100)
- 格式:pdf
- 大小:29.67 KB
- 文档页数:5

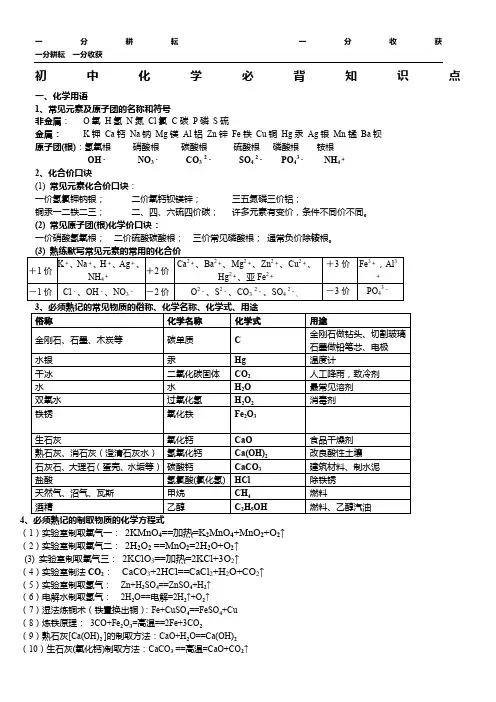
初中化学必背知识点一分耕耘一分收获初中化学必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg 汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OHNO3CO32、化合价口诀(1)常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。
(2)常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
(3)熟练默写常见元素的常用的化合价+1价-1价K、Na、H、Ag、NH4+++++---2铁锈生石灰熟石灰、消石灰(廓清石灰水)氧化铁氧化钙氢氧化钙Fe2O3CaOCa(OH)2CaCO3HClCH4C2H5OH食物干燥剂改良酸性土壤修建资料、制水泥除铁锈燃料燃料、乙醇汽油石灰石、大理石(蛋壳、水垢等)碳酸钙盐酸天然气、沼气、瓦斯酒精4、必须熟记的制取物质的化学方程式氢氯酸(氯化氢)甲烷乙醇SO42-PO43-NH4+(1)实验室制取氧气一:2KMnO4 (2)尝试室制取氧气二:2H2O2△K2MnO4+MnO2+O2↑催化剂MnO22H2O+O2↑(3)实验室制取氧气三:2KClO32KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑△(5)尝试室制取氢气:Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑Ca、Ba、Mg、Zn、Cu2、+3价Fe,Al3Hg、亚FeO2、S2、CO32、SO42----、2+2+2+2+3+-+2价-2价(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理:3CO+Fe2O3高温2+2++3-Fe+3CO2高温Cl、OH、NO3---3价PO4(9)生灰水[Ca(OH)2]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3CaO+CO2↑二.金属活动性顺序:金属举动性由强至弱:K Ca Na Mg Al,Zn Fe Sn Pb (H),Cu Hg Ag Pt Au。

初中化学必背基础知识点86题1、分子是保持化学性质的最小微粒。
原子是化学变化中的最小微粒。
物理变化中,原子可分为原子核、电子;也可分质子、中子、电子。
2、元素是具有相同核电荷数(即质子数)的同一类原子的总称。
3、分子和原子的主要区别是在化学反应中,分子可分,原子不可分。
4、元素的化学性质主要决定于原子的最外层电子数。
5、在原子中,质子数= 核电荷数= 核外电子数。
6、相对原子质量= 质子数+ 中子数7、镁离子和镁原子具有相同的质子数或核电荷数。
8、地壳中含量最多的元素是氧元素。
最多的金属元素是铝元素。
9、决定元素的种类是质子数或核电荷数。
10、空气是混合物。
11、煤、石油、天然气都是混合物,三大化石燃料,不可再生能源。
12、溶液都是混合物。
例如:稀硫酸、食盐水、石灰水等。
13、氧化物是由两种元素组成的,其中一种是氧元素的化合物。
14、化学变化的本质特征是有新物质生成。
15、燃烧、铁生锈、食物变质等都是化学变化。
16、化学反应的基本类型是化合反应、分解反应、置换反应、复分解反应。
17、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au18、具有还原性的物质是H2、C、CO。
其中属于单质的是C、H2。
属于化合物的是CO。
19、燃烧、缓慢氧化、自燃的相同点是都是氧化反应。
20、在化学反应前后,肯定不变的是原子的种类和数目、元素的种类、反应前后物质总质量。
肯定变化的是物质的种类和分子的种类。
21、2H2表示两个氢分子;2H表示两个氢原子;2H+表示两个氢离子。
22、溶液都是均一、稳定的混合物。
溶液中各部分的性质相同。
溶液不一定是无色的。
23、溶液在稀释前后保持不变的是溶质的质量。
24、 酸的pH<7;如:HCl 、H 2SO 4、CO 2通入水中;碱的pH>7;如:NaOH 、Ca (OH )2、CaO 溶于水、Na 2O 溶于水、Na 2CO 3 中性溶液pH=7。

化学常识100条1.化学变化的特征是有新物质生成。
2.物理变化只是物质的状态、形状等发生改变,没有新物质生成。
3.分子是保持物质化学性质的最小粒子。
4.原子是化学变化中的最小粒子。
5.元素是具有相同核电荷数(即质子数)的一类原子的总称。
6.地壳中含量最多的元素是氧,其次是硅、铝、铁。
7.地壳中含量最多的金属元素是铝。
8.人体中含量最多的元素是氧。
9.人体中含量最多的金属元素是钙。
10.组成物质的基本成分是元素。
11.物质由分子、原子、离子等微观粒子构成。
12.分子由原子构成。
13.水由水分子构成。
14.铁由铁原子构成。
15.氯化钠由钠离子和氯离子构成。
16.分子在不断地运动。
17.分子间有间隔。
18.温度升高,分子运动速率加快。
19.压强增大,分子间间隔变小。
20.混合物由两种或两种以上物质组成。
21.纯净物由一种物质组成。
22.单质是由同种元素组成的纯净物。
23.化合物是由不同种元素组成的纯净物。
24.氧化物是由两种元素组成,其中一种是氧元素的化合物。
25.化学式表示物质的组成。
26.相对原子质量是以一种碳原子质量的1/12 为标准,其他原子的质量与它相比较所得到的比。
27.相对分子质量是化学式中各原子的相对原子质量的总和。
28.在化合物中,各元素正负化合价的代数和为零。
29.元素的化学性质主要由原子的最外层电子数决定。
30.金属元素的原子最外层电子数一般少于4 个。
31.非金属元素的原子最外层电子数一般多于4 个。
32.稀有气体元素的原子最外层电子数一般为8 个(氦为2 个)。
33.原子的核外电子是分层排布的。
34.原子结构示意图可以表示原子的核电荷数、电子层数以及各层上的电子数。
35.燃烧是可燃物与氧气发生的一种发光、放热的剧烈的氧化反应。
36.燃烧需要同时满足三个条件:可燃物、与氧气接触、温度达到着火点。
37.灭火的原理是破坏燃烧的条件,即清除可燃物、隔绝氧气、降低温度至着火点以下。
38.缓慢氧化是进行得很缓慢,甚至不容易被察觉的氧化反应。

初中化学必背知识点打印版一、化学用语。
1. 元素符号。
- 前20号元素:氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)。
- 常见金属元素:铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、金(Au)、汞(Hg)等。
2. 化学式。
- 单质化学式。
- 金属单质:用元素符号表示,如铁(Fe)、铜(Cu)等。
- 固态非金属单质:一般用元素符号表示,如碳(C)、硫(S)等;但碘(I₂)除外。
- 稀有气体:用元素符号表示,如氦气(He)、氖气(Ne)等。
- 气态非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如氢气(H₂)、氧气(O₂)、氮气(N₂)等。
- 化合物化学式。
- 书写原则:正价在前,负价在后,根据化合物中正负化合价代数和为零的原则确定原子个数比。
- 例如:水(H₂O),其中氢元素化合价为 + 1,氧元素化合价为 - 2;氯化钠(NaCl),钠元素化合价为+1,氯元素化合价为 - 1。
3. 化学方程式。
- 书写原则。
- 一是必须以客观事实为基础;二是要遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
- 例如:- 镁在空气中燃烧:2Mg + O₂{点燃}{===}2MgO。
- 实验室制取氧气:- 加热高锰酸钾:2KMnO₄{}{===}K₂MnO₄+MnO₂+O₂↑。
- 过氧化氢分解:2H₂O₂{MnO_2}{===}2H₂O+O₂↑。
- 化学方程式的意义。
- 质的方面:表示反应物、生成物和反应条件。
如氢气和氧气在点燃条件下反应生成水。
- 量的方面:- 宏观上:表示反应物、生成物之间的质量比。
在2H₂+O₂{点燃}{===}2H₂O中,氢气、氧气和水的质量比为4:32:36 = 1:8:9。
- 微观上:表示反应物、生成物之间的粒子个数比。
初中化学必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH-NO3-CO32-SO4 2-PO43-NH4+2、化合价口诀(1) 常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4==加热=K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2 ==MnO2=2H2O+O2↑(3) 实验室制取氧气三:2KClO3==加热=2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气:2H2O==电解=2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理:3CO+Fe2O3=高温==2Fe+3CO2(9)熟石灰[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ==高温=CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al ,Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态),除了有颜色的固体,其他固体一般为白色。

初中化学必考知识点初中化学必考知识点初中化学必考知识点1 一、初中化学常见物质的分类1、单质:非惰性气体一般由两个原子组成:F2,O2,H2,Cl22、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI二、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。
三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;2、由于跟水反响而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反响而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;2、由于风化而减少的:碳酸钠晶体。
四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,假设木条复燃,那么是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,假设不变浑浊,那么是氢气.3、二氧化碳:通入澄清的石灰水,假设变浑浊那么是二氧化碳.4、氨气:潮湿的紫红色石蕊试纸,假设试纸变蓝,那么是氨气.5、水蒸气:通过无水硫酸铜,假设白色固体变蓝,那么含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/参加锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,假设产生白色沉淀,那么是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把潮湿的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,假设产生蓝色沉淀那么是铜离子13、铁离子:滴加氢氧化钠溶液,假设产生红褐色沉淀那么是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,假设产生气泡那么变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,假设产生气泡那么含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,假设产生白色沉淀,那么含有NaCl。

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧H氢N氮Cl氯C碳P磷S硫金属: K钾Ca钙 Na钠 Mg镁Al铝 Zn锌Fe铁Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32-SO4 2- NH4+2、(1)常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2)常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二:2H2O2===2H2O+O2↑(3)实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2(Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K CaNa MgAl ,Zn FeSnPb (H) ,Cu Hg AgPtAu。
(按5个一句顺序背诵)钾钙钠镁铝 ,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态 1、黑色固体:炭粉、铁粉CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。

2020年中考化学必考备100个化学常识知识汇总19.“钢精”是铝的俗称。
20.被人们称为“生命元素”、“思维元素”的是磷。
21.世界上第一座人造核反应堆是以费米为首的科学家在美国建造的。
22.在水玻璃的水溶液里投入铁、镍、铜等化合物的小粒晶体时,就可以很快地“生长”成为“水底花园”。
快速“生长”的主要原因是生成半透膜。
23.俗话说“真金不怕火炼”,可黄金放在王水中也会溶解。
有一种塑料在王水中也满不在乎,这种“塑料王”是聚四氟乙烯。
24.氟元素从发现到制得历经18年,且曾有“死亡元素”之称。
25.苹果能防牙病主要是因为它含有氟元素。
26.越王勾践剑千年不锈是因为表面有一层0.2毫米厚的氧化铬层。
27.医用石膏是用石灰石制得的。
28.现在科学家已制得了一种生物自毁塑料,是在塑料中加入了淀粉,它在自然中,可被动物吞食,被以淀粉为食的细菌分解。
29.人在饮酒后乙醇会在人体的肝部转化,滴酒不能沾的人可能缺少乙醇转化酶。
30.太阳现在的平均密度比水的大。
31.食用醋中醋酸的含量介于3-5%。
32.“非典”时期,人们常用的“84”消毒液的主要成分是NaClO。
33.医疗上治疗骨折时用来制作石膏绷带的物质是2CaSO4·H2O 。
34.误食钡盐,急救方法之一是用Na2SO4的稀溶液洗胃。
35.引起粗盐潮解的物质是MgCl2 。
36.小苏打食品厂制糕点时需要用到。
37.厨房中常用的调味品—味精,其主要成份的化学名称是谷氨酸。
38.人体容易患甲状腺肿是由于体内缺少碘元素所致。
39.医疗上用作X射线透视肠胃的内服药剂,俗称“钡餐”,其化学名称是BaSO4。
40.制造普通铅笔蕊的物质是石墨粉和粘土粉的混合。
41.碘洒和红汞是不能一起使用的,二者反应生成有毒的HgI2 。
42.能够做电视机荧光材料的物质是ZnS 。
43.埋木桩前,将埋入地下的一段表面用火微微烧焦,是因为碳在常温下化学性质不活泼。
44.报纸不能用来包装食品,除因可能带有病菌外,还因报纸上带有铝元素。

初中化学100个知识点化学是一门充满神奇和趣味的学科,它在我们的日常生活中无处不在。
对于初中生来说,掌握好化学的基础知识至关重要。
下面就为大家总结 100 个初中化学的知识点,希望能对大家的学习有所帮助。
1、化学变化:生成了新物质的变化。
如燃烧、生锈等。
2、物理变化:没有生成新物质的变化。
如蒸发、凝固等。
3、物理性质:不需要发生化学变化就能表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度等。
4、化学性质:在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性等。
5、蜡烛燃烧实验:火焰分为外焰、内焰、焰心,外焰温度最高。
6、吸入空气与呼出气体的比较:呼出气体中氧气含量减少,二氧化碳和水蒸气含量增多。
7、固体药品通常保存在广口瓶中,液体药品通常保存在细口瓶中。
8、取用固体药品一般用药匙,块状药品可用镊子夹取。
9、取用少量液体药品用胶头滴管,取用较多量液体药品用倾倒法,瓶塞要倒放。
10、量取液体体积时,量筒必须放平,视线要与量筒内液体凹液面的最低处保持水平。
11、酒精灯的火焰分为外焰、内焰和焰心,外焰温度最高,加热时用外焰。
12、给物质加热时,试管外壁不能有水,先预热,再集中加热。
13、玻璃仪器洗涤干净的标准是:仪器内壁附着的水既不聚成水滴,也不成股流下。
14、空气的成分按体积计算,大约是氮气 78%、氧气 21%、稀有气体 094%、二氧化碳 003%、其他气体和杂质 003%。
15、氮气是一种无色、无味、难溶于水的气体,化学性质不活泼。
16、氧气是一种无色、无味、不易溶于水的气体,能支持燃烧,具有氧化性。
17、氧气的检验方法:将带火星的木条伸入集气瓶中,如果木条复燃,证明是氧气。
18、实验室制取氧气的方法:加热高锰酸钾、加热氯酸钾和二氧化锰的混合物、分解过氧化氢溶液。
19、催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
20、电解水实验:正极产生氧气,负极产生氢气,体积比约为1:2。

初中化学必考知识点(全)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初中化学必考知识点(全))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初中化学必考知识点(全)的全部内容。
中考化学必考知识点1.【物理变化和化学变化】判断方法:化学变化的特征是有新物质生成。
所谓新物质:通过将变化前后物质种类主要是化学式进行比较,两者不一致,其中不一致者即为新物质。
没有新物质生成的是物理变化。
诸如玻璃破碎等形状改变的、或者形如干冰升华水结冰等状态的改变的都是物理变化。
2.有新物质生成的是化学变化。
化学变化常伴有的现象是:燃烧发光,象碳在氧气中燃烧发出白光,硫在氧其中发出蓝紫色火焰、在空气中发出淡兰色火焰,磷燃烧冒出白烟,铁在氧气中燃烧火星四射,铝、镁燃烧发出耀眼白光,氢气燃烧淡兰色火焰,一氧化碳、甲烷燃烧蓝色火焰,并且都放出热量.化学变化常还伴有的现象是:有沉淀生成.诸如不溶于酸的白色盐沉淀氯化银和硫酸钡;溶于酸的白色盐沉淀碳酸钙和碳酸钡;溶于酸的白色碱沉淀氢氧化镁、蓝色碱沉淀氢氧化铜、红色碱沉淀氢氧化铁、绿色碱沉淀氢氧化亚铁。
化学变化还可能伴有的现象是:溶液变色问题.石蕊溶液与酸溶液变红色,遇碱溶液变成蓝色;酚酞溶液与酸溶液不变色,遇碱溶液变红色。
酸性溶液有:盐酸、硫酸、硝酸、氯化铵、硝酸铵、硫酸铵。
碱性溶液有:氢氧化钠、氢氧化钙、氢氧化钾、碳酸钠、碳酸钾。
3.物理性质包括:色、态、味、沸点、熔点、硬度、密度、溶解性、挥发性、导电导热性、延展性。
4.化学性质包括:可燃性、助燃性、稳定性、活泼性、氧化性、还原性、酸性、碱性、毒性、腐蚀性。

初中化学基础百题(附详细答案)初中化学基础百题【物质的变化】1.下列变化属于化学变化的是()A .蜡烛受热融化B .瓦斯爆炸C .自行车轮胎爆炸D .空气制氧气2.下列变化过程中只发生物理变化的是() A .铜制品在潮湿的空气中变成铜绿 B .用燃烧法区别羊毛和合成纤维 C .以大米、高粱、小麦等粮食为原料酿酒D .气球充气过多爆炸3.下列变化中属于物理变化的是() A .融雪剂NaCl 使冰雪融化 B .用食醋除去暖水瓶中的水垢 C .火箭点火 D .喜庆节日燃放烟花 4.下列只发生物理变化的是( )A .①② B.①④ C .②③ D.③④5.下列各图所示的变化中,属于物理变化的是()A .带火星的木条复燃B .水的蒸发C .硫在氧气中燃烧D .将鸡蛋壳放入白醋中【物质的性质】6.下列有关对应物质的性质属于化学性质的是( )A.能导电B.硬度最大C.常温下呈气态D.会生锈 7.下列物质的用途与化学性质无关的是()A .氧气可以供给呼吸B .二氧化碳用作气体肥料C .金刚石用于划玻璃D .稀有气体用作焊接金属的保护气8.下列物质的用途与化学性质无关的是()A .用水灭火B .用煤炭发电C .用食醋水垢D .用干冰人工降雨【物质的分类】9.下列物质属于纯净物的是()A.粗盐B.纯净的盐酸C.面碱D.草木灰10.目前,国家食品监督检验部门检出某“返青粽叶”包装的粽子中含有硫酸铜,若食用这样的粽子会有害健康。
硫酸铜属于()A.有机物B.混合物C.金属单质D.盐11.下列物质中属于单质的是()A.水B.空气C.氧气D.二氧化碳12.下列物质不属于有机物的是()A.碳酸钙B.葡萄糖 C.甲烷 D.淀粉13.下列烧杯中盛装的溶液属于碱溶液的是()14.实验室有四个药品橱,已存放如下药品,实验室新购进的活性炭,应将它存放在( )15.下列物质中,属于溶液的是( )A.糖水B.牛奶C.米粥D.豆浆16.物质都是由微粒构成的。
初中化学必背基础知识点86题1、分子是保持化学性质的最小微粒。
原子是化学变化中的最小微粒。
物理变化中,原子可分为原子核、电子;也可分质子、中子、电子。
2、元素是具有相同核电荷数(即质子数)的同一类原子的总称。
3、分子和原子的主要区别是在化学反应中,分子可分,原子不可分。
4、元素的化学性质主要决定于原子的最外层电子数。
5、在原子中,质子数= 核电荷数= 核外电子数。
6、相对原子质量= 质子数+ 中子数7、镁离子和镁原子具有相同的质子数或核电荷数。
8、地壳中含量最多的元素是氧元素。
最多的金属元素是铝元素。
9、决定元素的种类是质子数或核电荷数。
10、空气是混合物。
11、煤、石油、天然气都是混合物,三大化石燃料,不可再生能源。
12、溶液都是混合物。
例如:稀硫酸、食盐水、石灰水等。
13、氧化物是由两种元素组成的,其中一种是氧元素的化合物。
14、化学变化的本质特征是有新物质生成。
15、燃烧、铁生锈、食物变质等都是化学变化。
16、化学反应的基本类型是化合反应、分解反应、置换反应、复分解反应。
17、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au18、具有还原性的物质是H2、C、CO。
其中属于单质的是C、H2。
属于化合物的是CO。
19、燃烧、缓慢氧化、自燃的相同点是都是氧化反应。
20、在化学反应前后,肯定不变的是原子的种类和数目、元素的种类、反应前后物质总质量。
肯定变化的是物质的种类和分子的种类。
21、2H2表示两个氢分子;2H表示两个氢原子;2H+表示两个氢离子。
22、溶液都是均一、稳定的混合物。
溶液中各部分的性质相同。
溶液不一定是无色的。
23、溶液在稀释前后保持不变的是溶质的质量。
24、 酸的pH<7;如:HCl 、H 2SO 4、CO 2通入水中;碱的pH>7;如:NaOH 、Ca (OH )2、CaO 溶于水、Na 2O 溶于水、Na 2CO 3 中性溶液pH=7。
(完整版)初三化学全册必背知识点(精华)初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三:2KClO3===2KCl+3O2↑(4)实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑ (6)电解水制取氢气:2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取办法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取办法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜群、状态1、黑群固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红XXX固体:Cu、Fe2O3、红磷▲硫磺:淡黄群▲绿XXX:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜群:含Cu2+的溶液呈蓝XXX(如CuSO4溶液);含Fe2+的溶液呈浅绿群(如FeCl2溶液);含Fe3+的溶液呈棕黄群(如FeCl3溶液),其余溶液普通为无群。