〖精选4套试卷〗北京市门头沟区2020年高一(上)化学期末预测试题
- 格式:doc
- 大小:558.00 KB
- 文档页数:24

2019-2020学年北京市高一(上)期末化学试卷一、选择题(共18小题,每小题3分,满分54分)1.(3分)当光束通过下列分散系时,能观察到丁达尔效应的是()A.NaCl溶液B.水C.Fe(OH)3胶体D.CuSO4溶液2.(3分)下列说法中不正确的是()A.生铁是铁的一种合金B.合金是混合物C.一般地说合金的熔点比它的各成分金属的熔点都高D.铝制餐具不宜用来蒸煮或长期存放酸性或碱性食物3.(3分)下列化学用语正确的是()A.CO2的结构式O═C═OB.H2SO4的电离方程式为:H2SO4=2H++S﹣+O4﹣C.Cl﹣的离子结构示意图为D.用电子式表示氯化钠的形成过程:4.(3分)氯水中含有多种成分,因而具有多重性质。
根据氯水分别与如图四种物质发生的反应(a、b、c、d重合部分代表物质间反应,且氯水足量),能证明氯水有漂白性的是()A.a B.b C.C D.d5.(3分)N A表示阿伏加德罗常数的值,下列判断正确的是()A.在常温常压下,48g氧气和臭氧的混合气体含氧原子数是3N AB.标准状况下,22.4LSO3中含有的原子数目为3N AC.1molCl2参加反应转移电子数一定为2N AD.lmolNa2O2与水充分反应转移的电子数为2N A6.(3分)若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是()A.NH4+、SO42﹣、CO32﹣、K+B.Na+、Ba2+、Ca2+、HCO3﹣C.Mg2+、SO42﹣、K+、Cl﹣D.K+、Cl﹣、Na+、SO42﹣7.(3分)下列离子反应方程式正确的是()①碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O②碳酸镁与稀硫酸:MgCO3+2H+═H2O+CO2↑+Mg2+③醋酸与大理石:2CH3COOH+CaCO3═Ca2++2CH3COO﹣+H2O+CO2↑④向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42﹣刚好沉淀完全:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓⑤Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2OA.①②③④⑤B.②③④⑤C.②③④D.①③④8.(3分)下列叙述不正确的是()选项被提纯物质杂质除杂试剂或方法A FeCl3溶液FeCl2通入适量Cl2B Cl2H2O (蒸气)通入浓硫酸中C铜粉铁粉加入过量盐酸并过滤D CO2HCl通入饱和的碳酸钠溶液中A.A B.B C.C D.D9.(3分)运用元素周期律分析下面的推断,其中不正确的是()A.锂(Li)与水反应比钠与水反应剧烈B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂D.HBrO4的酸性比HIO4的酸性强10.(3分)为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是()A.NaOH溶液[Ba(OH)2溶液]B.FeSO4溶液(KSCN溶液)C.KI(淀粉溶液)D.Na2SO3溶液(BaCl2溶液)11.(3分)下列实验,能达到实验目的的是( ) ABCD观察钾元素的焰色实验室制备Fe (OH )2制备氧化钠 比较NaHCO 3和Na 2CO 3溶解度A .AB .BC .CD .D12.(3分)下列关于钠及其化合物的叙述正确的是( ) A .钠能与硫酸铜溶液反应置换出红色的铜B .在Na 2O 2与水的反应中,氧化产物与还原产物物质的量之比为1:4C .相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1D .等质量的Na 2O 与Na 2O 2投入等量且足量水中充分反应后所得溶液物质的量浓度相等 13.(3分)某同学在研究前10号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O 点代表氢元素。

北京市2020年高一上学期化学期末考试试卷(II)卷姓名:________ 班级:________ 成绩:________一、选择题 (共16题;共47分)1. (3分) (2017高一上·洛阳期末) 朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是()A . 空气中的小水滴颗粒大小约为10﹣9m~10﹣7mB . 光是一种胶体C . 雾是一种胶体D . 发生丁达尔效应2. (3分) (2016高一上·邢台期末) 化学与生活密切相关,下列应用中利用了物质氧化性的是()A . 明矾净化水B . 用很稀的高锰酸钾溶液消毒C . 食醋除水垢D . 二氧化硫漂白草帽3. (3分) (2018高一上·宝坻期末) 将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。
下列说法错误的是()A . 可以求出合金中镁的质量B . 氢氧化钠溶液浓度为3mol/LC . 可以求出沉淀的最大质量D . 不能求出硝酸的物质的量浓度4. (3分) (2016高二下·黑龙江期末) 使用胆矾(CuSO4•5H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是()A . 将胆矾加热除去结晶水后,称取16g溶解在1L水中B . 称取25g胆矾溶于水,然后将此溶液稀释至1LC . 称取25g胆矾溶解在1L水里D . 将16g胆矾溶于水,然后将此溶液稀释至1L5. (3分)下列说法错误的是()A . 除去MgCl2溶液中少量的FeCl3 ,可选用MgCO3B . 等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者C . NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS﹣的水解程度增大,pH增大D . 用饱和氯化铵溶液可以清洗金属表面的锈迹6. (3分)下列混合物能用过滤法分离的是()A . 汽油和水B . 食盐和蔗糖C . 泥沙和食盐D . 铜粉和铝粉7. (3分) (2016高一上·河北期中) 重金属离子具有毒性.实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+ ,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙废液中可能含有的离子是()A . Cu2+和SO42﹣B . Cu2+和Cl﹣C . K+和SO42﹣D . Ag+和NO3﹣8. (3分) (2018高一下·襄阳期末) 设NA为阿伏加德罗常数值。

北京市2020年高一上学期化学期末考试试卷姓名:________ 班级:________ 成绩:________一、单选题 (共21题;共45分)1. (2分) (2018高一下·哈尔滨期中) 空气是人类生存所必需的重要资源。
为改善空气质量而启动的“蓝天工程”得到了全民的支持。
下列措施不利于“蓝天工程”建设的是()A . 推广使用燃煤脱硫技术,防治SO2污染B . 实施绿化工程,防治扬尘污染C . 研制开发燃料电池汽车,消除机动车尾气污染D . 加大石油、煤炭的开采速度,增加化石燃料的供应量2. (2分) (2017高一上·黄冈期末) 下列物质变化或操作过程中发生化学变化的是()A . 硅胶作袋装食品的干燥剂B . 氯气作自来水杀菌消毒剂C . 用铂丝蘸取碳酸钠溶液在酒精灯外焰上灼烧D . 用蒸馏的方法除去自来水中的Cl﹣3. (2分) (2016高一上·泉州期中) 下列说法正确的是()A . 金属氧化物一定是碱性氧化物B . 只含有一种元素的物质一定是单质C . 胶体与溶液的本质区别在于是否有丁达尔现象D . 化学反应中元素的化合价都没变化的为非氧化还原反应4. (2分)下列关于硅单质及其化合物的说法正确的是()①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③高纯度的硅单质广泛用于制作光导纤维④陶瓷是人类应用很早的硅酸盐材料A . ①②B . ②③C . ①④D . ③④5. (2分)下列叙述中,正确的是()A . 常温下铝和浓硫酸、浓硝酸不反应B . 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多C . 合金的熔点一般比组成它的各成分的熔点都高D . 工业上常利用铝热反应冶炼难熔的金属,如钒6. (2分) (2016高一下·汕头期中) 进行化学实验时应强化安全意识.下列做法正确的是()A . 金属钠着火时使用泡沫灭火器灭火B . 用试管加热碳酸氢钠固体时使试管口竖直向上C . 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D . 蒸馏时应先向冷凝管中通入冷凝水再加热7. (2分) (2017高一上·德州期中) 下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是()A . AB . BC . CD . D8. (2分) (2017高二上·宜宾期中) 下列各溶液中,有关离子的物质的量浓度关系正确的是()A . 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c (OH﹣)=c(H+)+c(HC2O4﹣)+c(H2C2O4)B . 饱和碳酸钠溶液中:c(Na+)=2c(CO32﹣)C . 饱和食盐水中:c(Na+)+c (OH﹣)=c(Cl﹣)+c(H+)D . 50℃时,pH=12的NaOH溶液中:c(OH﹣)=1.0×10﹣2 mol•L﹣19. (2分) (2017高一上·福州期末) 下表各选项中,不能利用置换反应通过Y得到W的一组化合物是()A . AB . BC . CD . D10. (2分) (2020高二上·新宁期末) 下列离子方程式正确的是()A . 硫酸钠溶液和氯化钡溶液反应:Ba2++SO42-=BaSO4↓B . 铜和硝酸银溶液反应:Cu+Ag+=Cu2++AgC . 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑D . 碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O11. (2分) (2016高一下·营山期末) 下列叙述中正确的是()A . 由碳元素组成的物质一定是纯净物B . 金刚石和石墨由相同的元素组成,因此它们具有相同的性质C . 石墨转变为金刚石的反应属于氧化还原反应D . C60是新发现的一种碳单质12. (2分) (2020高一上·石嘴山期末) 设NA为阿伏加德罗常数值,下列有关叙述正确的是()A . 将78Na2O2与过量H2O反应转移的电子数为NAB . 2molSO2与1molO2反应生成的SO3分子数为2NAC . 标准状况下,2.24L SO3中所含原子数为0.4NAD . 1molCl2参加反应转移电子数一定为2NA13. (2分) (2017高一上·武汉期末) 下列试剂的贮存方法正确的是()①NaOH溶液应保存在带有磨口玻璃塞的试剂瓶中;②氯水应保存在棕色试剂瓶中,最好是现用现配;③液溴保存在带有胶塞的试剂瓶中,用水封;④Na2SO3应密封保存,防止被空气中的氧气氧化;⑤浓盐酸和浓氨水都具有挥发性,因此装有二者的试剂瓶应放在同一贮存柜中.A . ①②④B . ②③⑤C . ②④D . ③⑤14. (2分)(2018·东城模拟) 下列实验、现象与结论相符的是()A . AB . BC . CD . D15. (2分)实验桌上放有托盘天平、研钵、三脚架、泥三角、蒸发皿、坩埚、干燥器、酒精灯、火柴、烧杯、量筒100mL、容量瓶、药匙、玻璃棒、石棉网、胶头滴管、坩埚钳。

2024届北京市门头沟区高一化学第一学期期末检测模拟试题注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折暴、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、下列有关溶液配制说法错误的是( )A.称取12.5 g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500 mL,所得溶液物质的量浓度为0.1 mol·L-1B.取58.5 g NaCl固体放入1 L水中完全溶解,所得NaCl溶液的物质的量浓度为1 mol·L-1C.将100 g 5%的食盐水加热蒸发掉50 g水后(无NaCl析出),所得溶液中NaCl的质量分数为10%D.将浓度2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1 mol·L-12、下列物质中,不能电离出酸根离子的是()A.Na2O B.KMnO4C.NH4NO3D.CaCl23、密度为0.910 g·cm-3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定4、下列关于电解质的判断中,正确的观点是()A.在熔融状态下能导电的物质B.在水溶液或熔融状态下能导电的物质C.在水溶液或熔融状态下能导电的化合物D.在水溶液和熔融状态下都能导电的化合物5、下列物质中,属于纯净物的是()①陶瓷②水泥③玻璃④漂白粉⑤胆矾⑥氯水⑦液氯A.①③⑤B.②④⑥C.⑤⑦D.⑥⑦6、古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )A.丝绸B.中草药叶C.茶D.瓷器7、一定条件下,一种反应物过量,另一种反应物可以完全反应的是A.过量的水与氯气B.过量的氢氧化钠与二氧化硅C.过量的二氧化锰与浓盐酸D.过量的氨水与氢氧化铝8、下列实验操作正确的是A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中B .在进行蒸馏操作中,加热一段时间后发现忘加碎瓷片,应采取的正确操作是立即补加C .实验时常把氢氧化钠固体放在托盘天平左盘的滤纸片上进行称量D .对盛有氢氧化铁胶体的U 形管通一会儿直流电后,连接电源正极的电极附近颜色逐渐加深9、下列各组离子在指定条件下能大量共存的是( )A .无色溶液中:Na +、Cu 2+、Cl ﹣、NO 3﹣B .澄清透明溶液中:Mg 2+、Na +、SO 42﹣、Cl ﹣C .强酸性溶液中:Na +、AlO 2﹣、OH ﹣、SO 32﹣D .强碱性溶液中:Fe 3+、Ca 2+、NO 3﹣、SCN ﹣10、若某原子的摩尔质量为Mg·mol -1,则一个该原子的真实质量是A .MgB .1M gC .23M6.0210⨯g D .236.0210M ⨯g11、下列物质在水溶液中的电离方程式书写错误的是( )A .NaHCO 3=Na ++H ++23CO -B .NH 4NO 3=43+NH NO +-C .NaHSO 4=Na ++H ++24SO -D .Ba(OH)2=Ba 2++2OH ﹣12、下列实验操作中错误的是A .蒸馏操作时,向蒸馏液体中加入几块沸石,以防止暴沸B .蒸发操作时,当混合物中出现大量晶体时停止加热,用余热烘干C .分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从上口倒出D .萃取操作时,选用酒精作为萃取剂从溴水中萃取溴13、在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是() A .Fe B .Cu C .Fe 和Cu D .Mg 和Cu14、阿伏加德罗常数的值为N A ,下列说法正确..的是A .标准状况下,2.24LSO 3中含有0.1N A 个分子B .常温常压下,80g 氩气含有的分子数为N AC .在标准状况下,22.4LCO 2和CO 混合气体的分子总数为N AD .2mol/L 的CaCl 2溶液中Cl -的数目为4N A15、下列关于合金的说法正确的是A .合金属于金属单质B .多数合金的熔点高于组成它的成分金属C .合金不属于金属材料D .合金的硬度一般比各成分金属大16、下列溶液中的离子—定能大量共存的是A.含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+B.在加入铝粉能产生氢气的溶液中:NH4+、Na+、SO42-、CO32-C.酸性溶液中:Ba2+、NO3-、K+、AlO2-D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-17、将一小块钠投入到下列溶液中,既能生成气体,又能生成蓝色沉淀的是()A.氯化镁溶液B.氢氧化钡溶液C.硫酸铜溶液D.氯化钙溶液18、砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是()A.砹是有色固体B.非金属性:At<IC.HAt非常稳定D.I2能从砹的可溶性盐溶液中置换出At219、已知SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将0.09molCl2通入100mL 含a molNaI与a mol Na2SO4的混合溶液中,有0.25a mol的NaI 被氧化(不考虑Cl2与I2之间的反应),则下列说法正确的是A.物质的还原性Iˉ >SO32ˉB.NaI 与Na2SO3的物质的量浓度为0.08mol/LC.通入0.09molCl2发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18ClˉD.若再通入0.07molCl2,恰好能将NaI与Na2SO3完全氧化20、下列关于自然界中氮循环示意图(如图)的说法错误的是()A.氮元素只被氧化B.豆科植物根瘤菌固氮属于自然固氮C.其它元素也参与了氮循环D.含氮无机物和含氮有机物可相互转化21、下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是A.AlCl3B.FeCl2C.FeCl3D.CuCl222、有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。
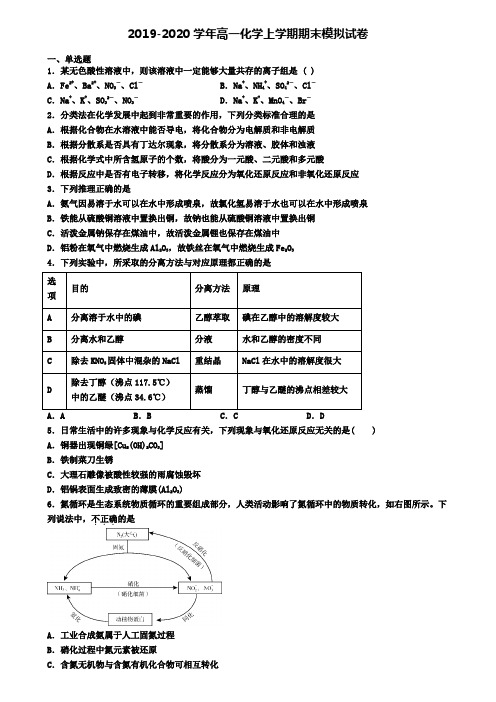
2019-2020学年高一化学上学期期末模拟试卷一、单选题1.某无色酸性溶液中,则该溶液中一定能够大量共存的离子组是 ( )A.Fe2+、Ba2+、NO3-、Cl-B.Na+、NH4+、SO42-、Cl-C.Na+、K+、SO32-、NO3-D.Na+、K+、MnO4-、Br-2.分类法在化学发展中起到非常重要的作用,下列分类标准合理的是A.根据化合物在水溶液中能否导电,将化合物分为电解质和非电解质B.根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液C.根据化学式中所含氢原子的个数,将酸分为一元酸、二元酸和多元酸D.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应3.下列推理正确的是A.氨气因易溶于水可以在水中形成喷泉,故氯化氢易溶于水也可以在水中形成喷泉B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜C.活泼金属钠保存在煤油中,故活泼金属锂也保存在煤油中D.铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O34.下列实验中,所采取的分离方法与对应原理都正确的是选项目的分离方法原理A 分离溶于水中的碘乙醇萃取碘在乙醇中的溶解度较大B 分离水和乙醇分液水和乙醇的密度不同C 除去KNO3固体中混杂的NaCl 重结晶NaCl在水中的溶解度很大D 除去丁醇(沸点117.5℃)中的乙醚(沸点34.6℃)蒸馏丁醇与乙醚的沸点相差较大5.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )A.铜器出现铜绿[Cu2(OH)2CO3]B.铁制菜刀生锈C.大理石雕像被酸性较强的雨腐蚀毁坏D.铝锅表面生成致密的薄膜(Al2O3)6.氮循环是生态系统物质循环的重要组成部分,人类活动影响了氮循环中的物质转化,如右图所示。
下列说法中,不正确...的是A.工业合成氨属于人工固氮过程B.硝化过程中氮元素被还原C.含氮无机物与含氮有机化合物可相互转化D.反硝化过程有助于稳定N2在大气中的含量7.用N A表示阿伏加德罗常数的值,下列叙述正确的是A.标准状况下,22.4LH2O含有的分子数为N AB.标准状况下,22.4LCO2和O2混合气体中含氧原子数为2N AC.常温常压下,7.8g Na2O2固体中含有的阴离子数为0.2 N AD.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为N A8.下列物质在一定条件下能够导电,但不是电解质的是A.铝 B.熔融氯化钠 C.H2SO4 D.蔗糖9.在通常条件下,NO2和SO2可以很容易发生反应生成NO和SO3。

2020-2021学年北京门头沟区大峪中学高一化学期末试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列物质与水反应不属于氧化还原反应的是A.NO2 B.CaO C.Cl2 D.Na2O2参考答案:B2. 现有三组溶液:①汽油和氯化钠溶液②碘与CCl4溶液③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液C. 蒸馏、萃取、分液D. 分液、蒸馏、萃取参考答案:D①汽油不溶于水,汽油和氯化钠溶液可以通过分液分离;②碘与四氯化碳的沸点相差较大,分离碘与CCl4溶液可以通过蒸馏;③溴易溶在有机溶剂中,氯化钠和单质溴的水溶液可以通过萃取分离,答案选D。
3. 科学家联合小组宣布合成出114 号元素的一种同位素,该同位素原子的质量数为298。
以下叙述不正确的是( )A. 该元素属于第七周期B. 该元素为金属元素,性质与82Pb 相同C. 该元素位于第ⅣA 族D. 该同位素原子含有114 个电子,184 个中子参考答案:B【分析】根据每周期元素的种数,可知每周期最后一种稀有气体元素的原子序数分别是:2、10、18、36、54、86、118,114号元素在118号的左边,根据元素周期表中周期和族的划分,可知114号元素位于第七周期ⅣA族。
【详解】A项、114号元素位于第七周期ⅣA族,故A正确;B项、该元素处于第七周期ⅣA族,同主族自上而下金属性增强,同族的Pb为金属元素,故该元素为金属元素,与Pb的化学性质相似,故B错误;C项、114号元素位于第七周期ⅣA族,故C正确;D项、元素原子序数为114号,则原子质子数为114,则该同位素原子含有114个电子,中子数为298-114=184,故D正确。
故选B。
【点睛】本题考查结构性质位置关系,掌握根据原子序数确定位置的方法,根据原子序数确定在周期表的位置是解答关键。
北京门头沟区永定中学 2020-2021学年高一化学上学期期末试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列有关物质分类或归类正确的一组是()①液氯、干冰、碘化银均为化合物②氢氟酸、盐酸、水玻璃均为混合物③明矾、小苏打、次氯酸均为电解质④牛奶、豆浆、漂粉精均为胶体⑤Na2O、Na2CO3、Na2SiO3均为钠盐A.①②B.②③ C.③④ D.②③⑤参考答案:B2. 如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是()A.Cl2(饱和食盐水)无色喷泉B.NH3(H2O含石蕊)蓝色喷泉C.HCl(H2O含石蕊)红色喷泉D.SO2(NaOH溶液)无色喷泉参考答案:A【考点】实验装置综合.【分析】能形成喷泉,圆底烧瓶中的气体应易溶或能烧杯中的液体发生反应,结合选项中对应物质的性质解答.【解答】解:A.因NaCl溶液抑制Cl2的溶解,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,故A错误;B.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因氨水溶液显碱性,石蕊遇碱变蓝,故形成蓝色喷泉,故B正确;C.氯气与与水反应生成酸,石蕊遇酸变红,可形成红色喷泉,故C正确;D.因SO2与NaOH溶液反应生成生成盐和水,溶液为无色,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成无色喷泉,故D正确.故选A.3. 下列关于胶体的叙述不正确的是()A 光线透过胶体时,胶体中可发生丁达尔效应B 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同C Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的D 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间参考答案:B略4. 在PH = 1无色透明溶液中能大量共存的离子组是(考察离子共存的知识)A. Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-C. Ba2+、K+、S2-、Cl - D.Cu2+、Na+、NO3-、SO42-参考答案:B略5. 烃类分子中碳原子的结合方式是A.形成2至4个共价键B.形成非极性键C.形成四对共用电子对D.全部形成单键参考答案:C略6. 如图所示装置,正放在桌面上,适用于从Y 口进入的操作是A.瓶内盛一定量的浓硫酸,用于干燥气体B.X 口接量筒,瓶内盛满水,用于测量难溶于水的气体的体积C.瓶内盛一定量的饱和NaHCO3溶液,用于除去CO2中混有的杂质气体D.用排空气法收集O2、CO2等气体参考答案:B【名师点晴】本题主要考查“万能装置”的多种功能,如收集气体、洗涤气体、贮存气体、干燥气体等,考查学生根据气体的性质进行灵活运用解题的能力。
北京市2020-2021年高一上学期化学期末考试试卷(II)卷姓名:________ 班级:________ 成绩:________一、单选题 (共16题;共16分)1. (1分) (2018高一上·广西月考) 实验室中的药品常按物质的性质、类别等有规律地摆放。
现有部分药品按某种规律摆放在实验桌上,如下图。
做“硫酸的性质”的实验时,某同学取用BaCl2 溶液后,应把它放回的位置是()A . AB . BC . CD . D2. (1分)下列实验仪器需要垫石棉网加热的是()A . 蒸馏烧瓶B . 坩埚C . 蒸发皿D . 试管3. (1分) (2015高一上·石嘴山月考) 不能直接使用观察法得出结论是()A . 氯气是呈黄绿色的气体B . 氯气有强烈的刺激性C . 氯气有毒D . 氯水中含有氯气分子4. (1分)(2020·合肥模拟) 化学与人类社会生产、生活有着密切联系。
下列叙述中正确的是()A . “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化B . 高温或日常用的消毒剂可使禽流感病毒蛋白质变性C . 苹果放在空气中久置变黄和纸张久置变黄原理相似D . 燃煤中加入CaO主要是为了减少温室气体的排放5. (1分)下列叙述正确的是()A . 1molNaOH的摩尔质量为40gB . 64gSO2中含有1molO2C . 1molN2的体积约为22.4LD . 0.5molCO2约含有3.01×1023个CO2分子6. (1分)下列说法正确的是()A . 铁是位于第四周期第ⅧB族元素,是一种重要的过渡元素B . 四氧化三铁是氧化铁和氧化亚铁组成的混合物C . 14克铁粉和7克硫粉混合后高温下充分反应能生成21克硫化亚铁D . 铁在溴蒸气中点燃可生成FeBr37. (1分) (2018高一上·温州期中) 下列说法不正确的是()A . 焰色反应体现了元素的物理性质B . 用盐酸酸化的BaCl2溶液检验待测溶液中是否存在SO42-C . 有色玻璃是某些胶态金属氧化物分散到玻璃中制成D . 用原子吸收光谱确定物质中含有哪些金属元素8. (1分) (2019高三上·蚌埠期中) 下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是()A . 用装置①配制250 mL0.1 mol.L-1的NaOH溶液B . 用装置②制备少量Fe(OH)2固体C . 用装置③验证乙烯的生成D . 用装置④制取少量乙酸乙酯9. (1分)在原电池和电解池的电极上所发生的反应,属于氧化反应的是()A . 原电池的正极和电解池的阳极所发生的反应B . 原电池的正极和电解池的阴极所发生的反应C . 原电池的负极和电解池的阳极所发生的反应D . 原电池的负极和电解池的阴极所发生的反应10. (1分) (2016高一上·海南期末) 在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中一定不存在的金属离子是()A . Fe2+和Cu2+B . Fe3+C . Cu2+D . Fe2+11. (1分) (2016高一上·会宁期中) 下列条件中,两种气体所含原子数一定相等的是()A . 同质量、不同密度的N2和COB . 同温度、同体积的H2和N2C . 同体积、同密度的C2H6和NOD . 同压强、同体积的N2O和CO212. (1分)下列有关工业生产的叙述正确的是()A . 合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B . 联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠C . 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量D . 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室13. (1分) (2018高二下·广州期中) 下列化学反应中,H2SO4作为氧化剂的是()A . 2NaOH+H2SO4=Na2SO4+2H2OB . C+2H2SO4(浓) CO2↑+2SO2+2H2OC . BaCl2+H2SO4=BaSO4↓+2HClD . CuO+H2SO4=CuSO4+H2O14. (1分) (2017高二上·双流期中) 下列有关方程式书写正确的是()A . 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH﹣═H2OB . H2S在水溶液中的电离:H2S+H2O⇌H3O++HS﹣C . 甲烷的燃烧热为890.3 kJ•mol﹣1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ•mol﹣1D . NH4HCO3溶于过量的NaOH溶液中:HCO32﹣+OH﹣═CO32﹣+H2O15. (1分) (2016高三上·新疆期中) 将X气体通入Y溶液中,实验结果与预测的现象一致的组合是()X气体Y溶液预测的现象①CO2饱和Na2CO3溶液白色沉淀析出②SO2Ba(NO3)2溶液白色沉淀析出③Cl2AgNO3溶液白色沉淀析出④NH3AlCl3溶液白色沉淀析出A . 只有①②③B . 只有①②④C . 只有①③④D . ①②③④16. (1分) (2018高二上·江苏期末) 下列有关氨或铵盐的说法不正确的是()A . NH3属于弱电解质B . 可用湿润的红色石蕊试纸检验氨气C . 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl-)D . 常温时,0.1mol·L-1NH4Cl溶液加水稀释,的值不变二、填空题 (共1题;共4分)17. (4分) (2019高一上·鹤岗期中)(1)Ⅰ.3.01×1022个OH-的物质的量为________mol;这些OH-与________molNH3的质量相等,与________g Na+含有的离子数相同。
2019-2020学年高一化学上学期期末模拟试卷一、单选题1.下列除杂过程中,所选用的试剂或方法不正确的是A.Na2CO3固体中混有NaHCO3:充分加热固体混合物B.FeCl2溶液中混有FeCl3:加入过量的铁粉,过滤C.Fe2O3固体中混有Al2O3:加入足量的盐酸,过滤D.FeCl3溶液中混有FeCl2:通入足量的Cl22.已知2SO2(g)+O2(g) 2SO3(g)(正反应放热)。
若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是 ( )A.若降低温度,可以加快反应速率 B.使用催化剂是为了加快反应速率C.在上述条件下,SO2能完全转化为SO3 D.达到平衡时,SO2和SO3的浓度一定相等3.小宋想用生活中常见物质做丁达尔现象的实验,下列液体中一定不会有现象的是( )A.鸡蛋清 B.稀米汤 C.豆浆 D.食醋4.已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+=Fe3++Ge3+①;Sn2++2Fe3+=2Fe2++Sn4+②由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+5.高铁酸钠 (Na2FeO4)是一种高效的饮用水处理剂,可由下列方法制得:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 关于该反应,下列说法正确的是A.Fe(OH)3中铁元素化合价为+3,只有氧化性B.反应中 NaClO 是氧化剂,NaCl 是氧化产物C.反应中每生成1 mol Na2FeO4,转移6 mol电子D.Na2FeO4具有强氧化性,能消毒杀菌6.下列关于Na2CO3和NaHCO3的说法中,不正确...的是A.焰色反应均为黄色B.溶解度:Na2CO3>NaHCO3C.可以用加热的方法除去Na2CO3固体中的NaHCO3杂质D.物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多7.关于氨的喷泉实验形成的原理解释正确的是A.氨水呈碱性 B.氨气极易溶于水,烧瓶内外形成压强差C.氨气易液化 D.氨气溶于水后形成的溶液易挥发8.下列除杂的实验过程不正确的是( )A.除去CO2中少量CO:通过灼热的CuO后收集气体B.除去BaSO4中少量BaCO3:加足量的稀盐酸,过滤、洗涤、干燥C.除去KCl溶液中的少量MgCl2:加入适量的NaOH溶液,过滤、蒸发、结晶D.除去Cu中的少量CuO:加足量的稀盐酸,过滤、洗涤、干燥9.下列关于Na2O和Na2O2的说法中,不正确...的是A.均含-2价的氧元素 B.焰色反应均为黄色C.与水反应均生成NaOH D.与二氧化碳反应均生成Na2CO310.生活中的下列物质,属于硅酸盐产品的是A.陶瓷 B.水晶 C.玛瑙 D.沙子11.已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。
若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是A.只用盐酸一种试剂就可以确定该固体M的具体成分B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3C.用pH试纸检验,若pH=7,则固体M一定是Na2SO4D.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO412.下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是A.AlCl3 B.FeCl2 C.FeCl3 D.CuCl213.某同学设计完成了以下两个实验:①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。
继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。
继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。
下列说法不正确的是A.实验①生成HIO3时发生的反应为:I2+5Cl2+6H2O=2HIO3+10HClB.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2D.由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3>Cl2>HIO314.13C - NMR (核磁共振)、15N- NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich 等人为此获得2002年诺贝尔化学奖。
下面有关13C、15N叙述正确的是()A.13C 与15N 有相同的中子数B.13C与12C是同一种核素C.15N2 与14N2互为同位素D.13C60与金刚石互为同素异形体15.在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6 mol·L-1HCl 100 mL,使天平达到平衡。
分别向两烧杯中加入不超过5 g 的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为()A.1∶1 B.24∶27 C.12∶9 D.32∶3316.用等质量的金属钠进行下列实验,产生氢气最多的是( )A.将钠放入足量的稀盐酸中B.将钠放入足量的稀硫酸中C.将钠放入足量的硫酸氢钠溶液中D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中17.下列实验现象和结论相符的是( )18.下列反应产生氢气的物质的量最多的是A.足量的Mg与0.5mol·L-1的稀硝酸200mLB.足量的Cu与5mol·L-1的硫酸400mLC.足量的Al与0.3mol·L-1的氢氧化钠溶液200mLD.足量的Mg与0.5mol·L-1的稀盐酸200mL19.钠与水反应的现象和钠的下列性质无关的是A.钠的熔点较低B.钠的密度小于水C.钠的硬度较小D.钠的还原性强20.向50 mL 14.0 mol•L﹣1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24 L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为A.6.4 g B.12.8 g C.19.2 g D.38.4 g21.下列离子方程式正确的是A.向FeCl3溶液中加入过量铁粉:Fe3++Fe===2Fe2+B.铜溶于稀硝酸:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2OC.向稀硫酸中加入 Ba(OH)2溶液:Ba2++OH-+H++SO42-===BaSO4↓+H2OD.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+22.盛放金属钠固体的试剂瓶上应贴的危险化学品标志是A.A B.B C.C D.D23.下列离子反应方程式,书写正确的是A.向碳酸钠溶液中加醋酸CO32-+2H+=H2O+CO2↑B.向稀硫酸溶液中投入铁粉2Fe+6H+=2Fe3++3H2↑C.向盐酸中投入碳酸钙CO32-+2H+=H2O+CO2↑D.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O24.利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1 000 mL,假如其他操作均是正确无误的,下列情况会引起配制溶液的浓度偏高的是( )A.称取碳酸钠晶体100 gB.定容时,俯视观察刻度线C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗D.定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线25.下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是A.Cu+H 2SO4CuSO4+SO2↑+H2OB.CH 3COOH+Ca(ClO)2HClO+Ca(CH3COO)2C.I 2+NaClO3NaIO3+Cl2D.HCl+MnO 2MnCl2+Cl2↑+H2O二、填空题26.现有下列物质:①NaCO3•10H2O晶体②铜③硫酸溶液④CO2 ⑤NaHSO4固体⑥Ba(OH)2固体⑦红褐色的氢氧化铁胶体⑧氨水⑨稀硝酸⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有__________________(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式___________________________________。
(3)制取⑦的化学方程式___________________________;将⑥的溶液滴加到⑤的溶液中至恰好完全沉淀时的离子方程式______________。
(4)17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为______。
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为_______L。
三、推断题27.已知A为金属单质,下列物质相互转化如图所示:试回答:(1)写出B的化学式____,D的化学式__________。
(2)写出由E转变成F的化学方程式____。
(3)向G溶液加入A的有关离子反应方程式______________________。
(4)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式____________,______________。
四、综合题28.实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2等)制备碱式硫酸铁[Fe a(OH)b (SO4)c]溶液,并测定其组成。
(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3转化为 Fe a(OH)b (SO4)c。
若溶液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。
一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。
另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。
求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。
(请写出计算过程)五、实验题29.Ⅰ.下列混合物的分离或提纯,应选用下述方法的哪一种?________(填序号)A.分液B.过滤C.萃取D.蒸馏E.蒸发结晶F.灼热氧化G.加热分解①分离CC14和H2O_______ ②从碘水中提取碘________③分离酒精和水的混合物______ ④除去NaCl中所含的少量KNO3________⑤除去澄清石灰水中悬浮的CaCO3__________⑥分离固体NH4Cl和NaCl________Ⅱ. 现实验室需用质量分数为98%、密度为1.84g.cm﹣3的浓硫酸的体积配制450 mL 1 mol·L-1的稀硫酸。