普通化学_第五章_物质结构基础
- 格式:pdf
- 大小:1.89 MB
- 文档页数:77


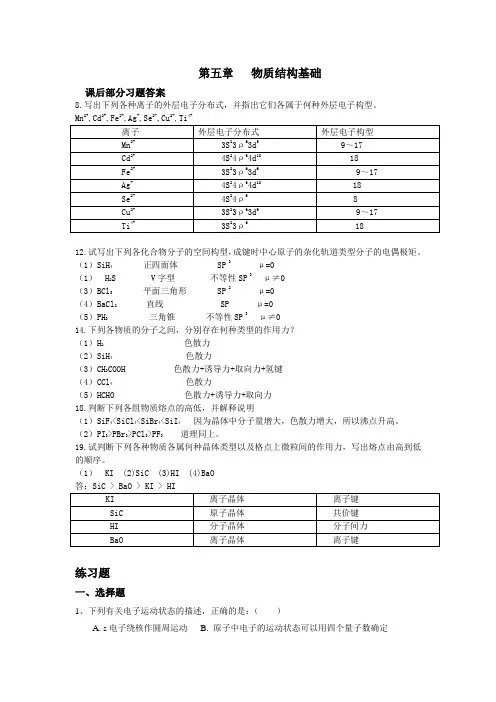
第五章物质结构基础课后部分习题答案8.写出下列各种离子的外层电子分布式,并指出它们各属于何种外层电子构型。
2+2+2++2-2+4+12.试写出下列各化合物分子的空间构型,成键时中心原子的杂化轨道类型分子的电偶极矩。
(1)SiH4正四面体 SP 3μ=0(1)H2S V字型不等性SP 3 μ≠0(3)BCl3平面三角形 SP 2μ=0(4)BaCl2 直线 SP μ=0(5)PH3 三角锥不等性SP 3 μ≠014.下列各物质的分子之间,分别存在何种类型的作用力?(1)H2 色散力(2)SiH4 色散力(3)CH3COOH 色散力+诱导力+取向力+氢键(4)CCl4 色散力(5)HCHO 色散力+诱导力+取向力18.判断下列各组物质熔点的高低,并解释说明(1)SiF4<SiCl4<SiBr4<SiI4因为晶体中分子量增大,色散力增大,所以沸点升高。
(2)PI3>PBr3>PCl3>PF3道理同上。
19.试判断下列各种物质各属何种晶体类型以及格点上微粒间的作用力,写出熔点由高到低的顺序。
(1)KI (2)SiC (3)HI (4)BaO练习题一、选择题1、下列有关电子运动状态的描述,正确的是:()A. s电子绕核作圆周运动B. 原子中电子的运动状态可以用四个量子数确定C. p 电子绕核走“8”字D. 电子在固定的轨道上不停地自旋 2、核外电子运动的特征是:( )A. 绕核高速旋转B. 具有无穷大的动能C. 有确定的运转轨道D. 具有波粒二象性 3、近代原子结构理论中的原子轨道是指:( )A. 电子绕核运动的轨迹B. 波函的平方2||ψ C. 电子云 D. 波函数ψ4、主量子数为3的电子层中:( )A. 只有s 和p 轨道B. 只有s 、p 和d 轨道C. 只有s 轨道D. 有s 、p 、d 和f 轨道 5、下列各组量子数取值合理的是:( )A. n=2 l =1 m=0 m s =0B. n=7 l =1 m=0 m s =+21C. n=3 l =3 m=2 m s =-21 D. n=3 l =2 m=3 m s =-21 6、钠原子1s 轨道能级E 1s,Na 与氢原子1s 轨道能级E 1s,H 的相对高低为:( )A. E 1s,Na =E 1s,HB. E 1s,Na <E 1s,HC. E 1s,Na >E 1s,HD. 无法比较 7、下列用量子数描述的、可以容纳电子数最多的电子亚层是:( )A. n=2,l =1B. n=3,l =2C. n=4,l =3D. n=5,l =0 8、决定多电子原子系统原子轨道能级大小的量子数是:( )A. n 和mB. l 和mC. n 和m sD. n 和l 9、屏蔽效应所起作用是:( )A. 对核电荷的增强作用B. 对核电荷的抵消作用C. 正负离子间的吸引作用D. 电子层的排斥作用二、填空题1、波函数ψ是描述 数学函数式,它和 是同义词,|ψ|2的物理意义是 ,电子云是 的形象化表示。



第1章热化学与能源一、判断题:1、热的物体比冷的物体含有更多的热量。
(×)2、热是一种传递中的能量。
(√)3、同一体系同一状态可能有多个热力学能。
(×)4、体系的焓值等于恒压反应热。
(×)5、最稳定单质的焓值等于零。
(×)6、由于C a C O3分解是吸热的,所以它的标准摩尔生成焓为负值。
(×)7、体系的焓等于体系的热量(×)8、实验测定得到的反应热数据都是恒压反应热。
(×)二、计算题:1、某汽缸中有气体1.20L,在97.3 kPa下气体从环境中吸收了800J的热量后,在恒压下体积膨胀到1.50L,试计算系统的内能变化ΔU。
ΔU = q + w = q – pΔV= 800 – 97.3×103 ×(1.50 - 1.20) 10-3= 770 J2、根据Δf H mΘ的值,计算下列反应的Δr H mΘ(298K ) 是多少:(1)4NH3(g)+ 3 O2(g)= 2N2(g)+ 6 H2O(g);4NH3(g)+ 3 O2 = 2N2 + 6 H2O(g)Δf H mΘ/ kJ·mol-1- 46.11 0 0 - 241.818Δr H mΘ= 6×(- 241.818)- 4×(- 46.11) = -1266 kJ·mol-1(2)CH4(g) + H2O(g)= CO(g)+ 3 H2(g)。
Δr H mΘ= 206 kJ·mol-1第2章化学反应的基本原理一、判断题:1、放热反应均是自发反应。
(×)2、ΔS为负值的反应均不能自发进行。
(×)3、冰在室温下自动融化成水,是熵增加起了主要作用。
(√)4、因为∆G TΘ= -RTlnKΘ,所以温度升高,平衡常数减小。
(×)5、质量作用定律适用于任何化学反应。
(×)6、反应速率常数取决于反应温度,与反应物浓度无关。


普通化学复习要点绪论1.化学的定义:化学是在原子和分子水平上研究物质的组成、结构和性质及其变化规律和变化过程中能量关系的科学2.化学的分支学科:无机化学:无机物有机化学:碳氢化合物及衍生物分析化学:测量和表征物理化学:所有物质系统高分子化学:高分子化合物若干新分支:环境化学、核化学等等3.化学的地位和作用:(1)是解决食物短缺问题的主要学科之一(2)化学化学继续推动材料科学发展(3)化学是提高人类生存质量和生存安全的有效保障(4)化学在能源和资源的合理开发和高效安全利用中起关键作用(5)化学是生命科学的重要支柱第1章热化学与能源1.几个基本概念(1)系统与环境系统:作为研究对象的那一部分物质和空间。
开放系统:有物质和能量交换封闭系统:只有能量交换隔离系统:无物质和能量交换环境:系统之外,与系统密切联系的其它物质和空间。
(2)相:系统中任何物理和化学性质完全相同的、均匀部分称为相。
根据相的概念,系统可分为单相(均匀)系统;多相(不均匀)系统相与相之间有明确的界面思考:O(l), H2O(g)和H2O(s)同时共存时系统1)101.325kPa,273.15K(0°C)下,H2中的相数为多少。
答:1)在此条件下,存在3相(气、液、固各一相;(s)分解为CaO (s)和CO2(g)并达到平衡的系统中的相数。
2) CaCO3答: 2)3相(气体1相,固体2相)(3)状态函数性质可分为两类:广度性质:其量值具有加和性,如体积、质量等强度性质:其量值不具有加和性,如温度、压力等。
思考:力和面积是什么性质的物理量?它们的商即压强(热力学中称为压力)是强度性质的物理量。
由此可以得出什么结论?答:力和面积都是广度性质的物理量。
结论是两个广度性质的物理量的商是一个强度性质的物理量。
(4)过程与途径系统状态发生任何的变化称为过程;实现一个过程的具体步骤称途径。
思考:过程与途径的区别设想如果你要把20 °C的水烧开,要完成“水烧开”这个过程,你可以有多种具体的“途径”:如可以在水壶中常压烧;也可以在高压锅中加压烧开再降至常压。

课程简介课程编码:JCB010A43课程名称:普通化学英文名称:General Chemistry周学时:4学时学分:4学分先修课程:无授课对象:一年级学生开课单位:基础部自然科学教研室授课教师:缪瑞课程简介:普通化学是高等学校工程技术专业必修的一门基础课。
本课程简明地阐述了化学基本原理和基本知识。
理论部分重视联系生产和科研实际,元素和化合物部分侧重基本知识、反应规律和重要应用的论述。
本课程的教学目的:1、学生初步掌握化学热力学、化学平衡、化学反应速率、水化学、基础电化学、近代物质结构等基本概念和基本理论。
2、培养学生运用上述理论去掌握无机化学中有关元素和化合物的基本知识。
通过对整个课程的学习提高对一般无机化学问题进行理论分析和解决的能力。
为以后学习后继课程及新理论、新实验技术打下必要的化学基础。
3、培养学生正确的学习和研究方法。
教材及参考书:1、教材:《普通化学》第五版浙江大学普通化学教研组编,高等教育出版社出版;面向21世纪课程教材;普通高等教育"九五"国家教委重点教材。
《普通化学实验》第三版浙江大学普通化学教研组编,高等教育出版社出版。
2、参考书:⑴、傅献彩主编大学化学(上、下册)北京高等教育出版社,1999。
⑵、华彤文,杨俊英,陈景祖等普通化学原理(第二版)北京北京大学出版社,1993。
⑶、严宣申,王长富普通无机化学北京大学出版社,1987。
教师教学及科研简历:缪瑞,1982年毕业于天津大学化学工程系。
曾主讲《普通化学》、《有机化学》、《化学与环保》、《环境保护概论》、《生活中的自然科学》等课程。
课程教学大纲第一部分:教学要求一、授课对象:工科类一年级本科学生。
二、先修课程:无三、学分学时分配:本课程4学分,总学时为60学时,讲课时数:46学时,实验时数:14学时。
第二部分:教学内容一、教学目的和基本要求本课程是高等学校工程技术专业必修的一门基础课。
普通化学简明地阐述了化学基本原理和基本知识。


绪论化学是一门既古老又年轻的科学化学是研究和创造物质的科学,同工农业生产和国防现代化,同人民生活和人类社会等都有非常密切的关系。
化学是一门中心性的、实用的和创造性的科学,主要是研究物质的分子转变规律的科学。
化学与物理一起属于自然科学的基础学科。
研究现状(2000年)化合物>2000万种时间分辨率:1 fs空间分辨率:0.1nm分析所需最小量:10-13 g。
1. 化学的定义与分支学科定义:化学是在原子和分子水平上研究物质的组成、结构和性质及其变化规律和变化过程中能量关系的科学化学的分支学科无机化学:无机物有机化学:碳氢化合物及衍生物分析化学:测量和表征物理化学:所有物质系统高分子化学:高分子化合物若干新分支:环境化学、核化学等等2. 化学的地位和作用⏹化学仍是解决食物短缺问题的主要学科之一⏹化学继续推动材料科学发展⏹化学是提高人类生存质量和生存安全的有效保障⏹化学在能源和资源的合理开发和高效安全利用中起关键作用⏹化学是生命科学的重要支柱3. 学习的目的、内容和要求学习目的1.了解当代化学学科的概貌2.用化学的观点分析、认识生活和工作中的化学问题学习内容1.理论化学:两条“主线”2.应用化学:化合物知识;化学在相关学科中的应用3.实验化学学习要求1.辨证的思维2.发展的眼光3.实践的方法第一章热化学与能源引言反应的热效应:化学反应时所放出或吸收的热叫做反应的热效应,简称热效应或反应热。
热化学:研究化学反应中热与其他能量变化的定量关系的学科叫做热化学。
能源:指能向人们提供能量的自然资源。
例如:燃料燃烧所产生的热量和化学反应中所发生的能量转换和利用都是能源的问题。
本章首先重点讨论如何用实验方法测量化学反应的热效应和如何从理论上计算化学反应的热效应这两个问题,最后适当介绍能源中的燃料。
1.1 反应热效应的测量一、基本概念1.反应的热效应: 化学反应时所放出或吸收的热叫做反应的热效应,简称热效应或反应热。
《普通化学》课程教学大纲英文名称:General Chemistry课程编码:总学时:32 实验学时:6 学分:2适用对象:水利类、生态类、土建类、机械及材料类等理工科专业本科生开课单位:理学院大纲主撰人:大纲审核人:制定时间:2014年9月使用教材与参考书:《普通化学》(第六版),浙江大学普通化学教研组编,高等教育出版,2011《大学化学》韩选利,张思敬,张凤云编,高等教育出版社,2005《普通化学实验》,李聚源主编,化学工业出版社,2007一、课程性质、目的和任务《普通化学》是理工科本科生必修的基础课程之一,课程内容主要包括物质结构理论基础、化学热力学、化学反应的基本规律与工程实际密切有关的重要元素和化合物、新技术、新材料等基本知识。
通过该门课程的学习,使学生了解近代化学的基本理论,具备化学基本实验技能,培养学生正确的学习和研究方法,为以后的学习和工作提供必要的化学基础,同时树立辩证唯物主义世界观。
二、教学内容及要求第1章化学的发展授课学时: 1基本要求:1-1 大学化学课程简介1-2 化学分支学科的形成与发展1-3 现代化学的发展1-4 课程学习方法及与专业关系重点:课程学习方法及与专业关系难点:课程学习方法及与专业关系第2章物质结构基础授课学时:2基本要求:2-1 了解原子核外电子运动的特征(量子化、波粒二象性、统计性);2-1 了解波函数、四个量子数和电子云的基本概念;2-3 了解s、p、d 波函数和电子云的角度分布示意图;2-4 掌握周期系元素的原子核外电子分布的一般规律及其与周期表的关系;2-5 理解元素按s、p、d (或d、ds)、f分区的情况,原子、离子、分子、金属晶体;2-6了解原子结构,分子结构和晶体结构等。
重点:四个量子数;原子和离子的电子分布式;核外电子分布与周期系的关系;杂化轨道理论与分子空间构型的关系;分子间力和氢键对物质性质的影响;原子、离子、分子、金属晶体的特征;晶体结构与物质性质的关系;配合物的组成及命名。