中学化学教学中渗透STEM理念的教学设计+——以_人工固氮技术——合成氨_为例
- 格式:pdf
- 大小:1.25 MB
- 文档页数:5

人工固氮技術——合成氨一、教材分析和建議本課題圍繞著合成氨的反應原理以及實現工業化生產的有關問題展開討論,幫助學生瞭解合成氨工業生產的主要原理和過程,認識並體會由實驗室研究到工業化生產所需要經歷的過程。
教科書的設計是,為了說明如何將大氣中的氮固定下來這一中心問題,首先,呈現問題提出的背景,也就是人們為什麼要想方設法地將大氣中的氮固定下來,直接的原因是滿足人類對氮肥、硝酸等含氮化合物的需要,間接的原因是地殼中氮元素的含量少、分佈不均;緊接著的問題是如何將大氣中的氮固定下來,指出合成氨在科學上和技術上的突破。
最後,討論和評價並引發思考合成氨工業發展所面臨的新問題。
這種設計整體上體現了技術實踐中問題解決不斷迴圈發展的一般過程,如下頁圖所示。
教學建議如下:1. 注意引導學生思考人工固氮技術——合成氨對於人類社會發展的重要意義,體現化學與技術發展的社會需求導向,並對技術生產評價標準的多元化有一個初步的認識。
說明在化學研究中,有些課題是屬於學術研究的熱點和重點,但不一定是技術研究開發的熱點和重點,技術研究往往要解決實際生產和生活中的具體問題,是受社會需求驅動的,這一點貫穿於整個教科書體系的設計中。
另外,化學技術創新往往要落實在一種產品的生產上,合成氨就是這方面的典型代表。
在課題1瞭解化工生產過程中的基本問題的基礎上,引導學生思考將實驗室研究轉化成實際生產時面臨的一些問題,展示由一種原理上可行的設想轉變成實際生產過程中人們所要付出的艱苦努力。
對於有志於理工科的學生來說,在培養科學技術素養的同時不斷提高人文素養;對於有志於人文學科的學生來說,要幫助他們形成對於科學技術在社會發展中重要作用的正確認識。
例如,可以結合對哈伯其人其事(見教學資源)的分析評價,請同學們討論和交流各自的看法。
2. 通過實驗學習合成氨的反應原理,利用化學反應速率、化學平衡移動原理分析和討論合成氨的適宜反應條件。
由於氮氣具有特殊的穩定性,合成氨是人工固定氮的一種方法,但反應條件比較苛刻。

課題2 人工固氮技術---合成氨相關素材一、哈伯和哈伯法合成氨19世紀以前,一些有遠見的化學家指出:考慮到將來的糧食問題,為了使子孫後代免於饑餓,我們必須寄希望於科學家能實現大氣固氮。
因此將空氣中豐富的氮固定下來並轉化為可被利用的形式,在20世紀初成為一項受到眾多科學家注目和關切的重大課題。
哈伯就是從事合成氨的工藝條件試驗和理論研究的化學家之一。
利用氮、氫為原料合成氨的工業化生產曾是一個較難的課題,從第一次實驗室研製到工業化投產,約經歷了150年的時間。
1795年有人試圖在常壓下進行氨合成,後來又有人在50個大氣壓下試驗,結果都失敗了。
19世紀下半葉,物理化學的巨大進展,使人們認識到由氮、氫合成氨的反應是可逆的,增加壓力將使反應推向生成氨的方向:提高溫度會將反應移向相反的方向,然而溫度過低又使反應速度過小;催化劑對反應將產生重要影響。
這實際上就為合成氨的試驗提供了理論指導。
當時物理化學的權威、德國的能斯特就明確指出:氮和氫在高壓條件下是能夠合成氨的,並提供了一些實驗數據。
法國化學家勒夏特列第一個試圖進行高壓合成氨的實驗,但是由於氮氫混和氣中混進了氧氣,引起了爆炸,使他放棄了這一危險的實驗。
在物理化學研究領域有很好基礎的哈伯決心攻克這一令人生畏的難題。
哈伯首先進行一系列實驗,探索合成氨的最佳物理化學條件。
在實驗中他所取得的某些數據與能斯特的有所不同,他並不盲從權威,而是依靠實驗來檢驗,終於證實了能斯特的計算是錯誤的。
在一位來自英國的學生洛森諾的協助下,哈伯成功地設計出一套適合於高壓實驗的裝置和合成氨的工藝流程,這流程是:在熾熱的焦炭上方吹入水蒸汽,可以獲得幾乎等體積的一氧化碳和氫氣的混和氣體。
其中的一氧化碳在催化劑的作用下,進一步與水蒸汽反應,得到二氧化碳和氫氣。
然後將混和氣體在一定壓力下溶於水,二氧化碳被吸收,就制得了較純淨的氫氣。
同樣將水蒸汽與適量的空氣混和通過紅熱的炭,空氣中的氧和碳便生成一氧化碳和二氧化碳而被吸收除掉,從而得到了所需要的氮氣。


人工固氮技术——合成氨【老师】学过生物,同学们都知道氮是植物体内蛋白质、核酸和叶绿素的组成元素,蛋白质是细胞原生质的重要成分,核酸是合成蛋白质的必要成分,在植物生长发育过程中,细胞分裂和新细胞的形成必须要有蛋白质,而光合作用则离不开叶绿素,因此在缺氮的的情况下,植物的生长发育会迟缓或停滞,因此,每到农作物生长的季节农民就会给农作物施肥,促进农作物的生长,以提高其产量。
【老师】同学们知道常给农作物施的化肥有哪些吗?【学生】有尿素、硫酸铵、硝酸铵、碳铵等。
【老师】好,回答的很好,我们生活中最常见的化肥有尿素和碳铵,看来同学们对种植农作物还是有一定的了解的。
可能同学们不知道,给农作物提供营养的主要是肥料中的氮元素。
而在地壳中氮的含量只有0.04%,而这是远远不能满足植物生长需要的,而在大气中氮的含量有78%,只有大豆、蚕豆等根部有根瘤菌的豆科植物才能把空气中的氮转化为氮的化合物吸收,但是大多数植物不能直接吸收氮气,只能吸收氮的化合物,所以,必须将氮气转化为氮的化合物才能被植物吸收,因此将游离的氮转化为化合态氮的方法叫氮的固定,【板书】人工固氮技术——合成氨【板书】氮的固定:将游离的氮转化为化合态氮的方法【老师】请大家看一下这张图,这是自然界中氮的循环图,要怎样才能有效的利用自然界中的氮来生产氮的化合物,请同学们将书翻到第九页,结合思考与交流——事实2部分,考虑一下(停顿20s的时间),现在同学们随老师来一起看一下自然界中的氮是怎样循环的:从图中我们可以看出自然界中氮的循环主要由大气中的氮提供的,大气中的氮通过雷电作用、人工固氮、根瘤菌的固氮作用等不同的路径被固定,形成各种铵盐,部分铵盐被植物吸收转化成蛋白质,进一步参与循环,而部分铵盐会被细菌分解,分解之后的铵盐中的氮元素又回到大气当中。
被植物吸收的铵盐部分会被动物进一步吸收,部分在植物死后被细菌分解,动物吸收的铵盐也在动物死后也被细菌分解,最后氮元素又回到了大气当中。
人工固氮技术---合成氨教学目的:1.利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题;2.了解合成氨的主要原理、原料、重要设备、流程和意义。
教学重点、难点:利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题。
探究建议:参观化工厂或观看有关的影像资料片,考察企业的选址情况,收集产品的生产原理、原料利用率、能耗、投资和成本核算等资料,撰写考察报告。
课时划分:一课时教学过程:[课堂作业]1.合成氨工业对化学工业和国防工业有重要的意义,对我国实现农业现代化起着重要的作用。
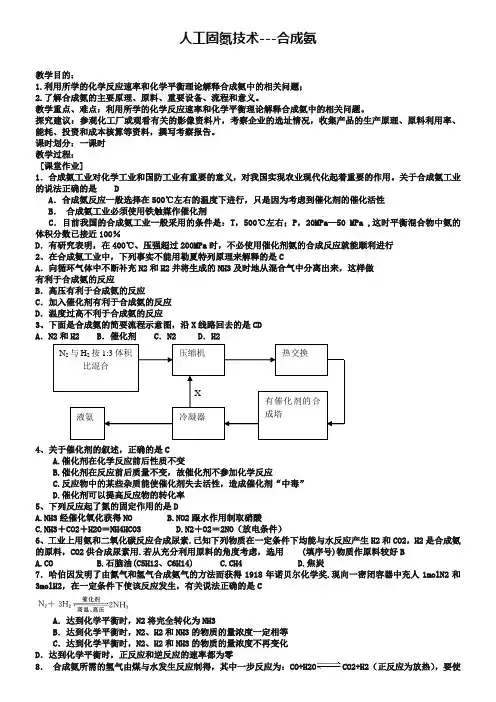
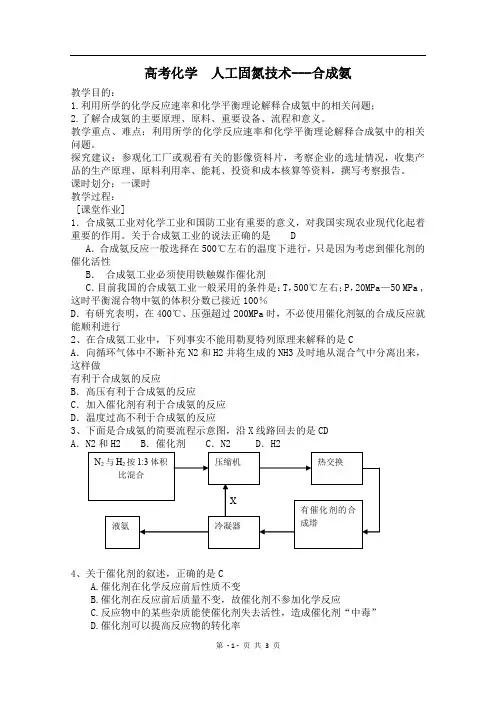
关于合成氨工业的说法正确的是 DA .合成氨反应一般选择在500℃左右的温度下进行,只是因为考虑到催化剂的催化活性B . 合成氨工业必须使用铁触媒作催化剂C .目前我国的合成氨工业一般采用的条件是:T ,500℃左右;P ,20MPa —50 MPa ,这时平衡混合物中氨的体积分数已接近100%D .有研究表明,在400℃、压强超过200MPa 时,不必使用催化剂氨的合成反应就能顺利进行2、在合成氨工业中,下列事实不能用勒夏特列原理来解释的是CA .向循环气体中不断补充N2和H2并将生成的NH3及时地从混合气中分离出来,这样做有利于合成氨的反应B .高压有利于合成氨的反应C .加入催化剂有利于合成氨的反应D .温度过高不利于合成氨的反应3、下面是合成氨的简要流程示意图,沿X 线路回去的是CDA .N2和H2B .催化剂C .N2D .H24、关于催化剂的叙述,正确的是CA.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.反应物中的某些杂质能使催化剂失去活性,造成催化剂“中毒”D.催化剂可以提高反应物的转化率5、下列反应起了氮的固定作用的是DA.NH3经催化氧化获得NOB.NO2跟水作用制取硝酸C.NH3+CO2+H2O =NH4HCO3D.N2+O2=2NO (放电条件)6、工业上用氨和二氧化碳反应合成尿素.已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用.若从充分利用原料的角度考虑,选用 (填序号)物质作原料较好BA.COB.石脑油(C5H12、C6H14)C.CH4D.焦炭7.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生,有关说法正确的是CA .达到化学平衡时,N2将完全转化为NH3B .达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等C .达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化D .达到化学平衡时,正反应和逆反应的速率都为零8. 合成氨所需的氢气由煤与水发生反应制得,其中一步反应为:CO+H2O CO2+H2(正反应为放热),要使CO转化率提高,可采用下列措施中的ACA. 增大水蒸气的浓度B. 增大CO的浓度C. 降低温度D. 增大压强9、实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:NaNO2+NH4Cl=NaCl + NH4NO2NH4NO2 N2↑+2H2O。

人工固氮技术——氨合成(教学设计)【教学内容分析】本节课内容选自人教版高中化学选修2《化学与技术》第一单元课题二,教科书以体现社会需求为导向,以化学研究基础上的技术发展为总体设计思想,合成氨这种人工固氮技术,不仅为解决人类吃饭问题做出了贡献,而且,它也是近代化学工业发展的基础。
学习这部分内容,有利于帮助学生意识到,当反应从实验室进入实际生产,会遇到很多难题。
本节课内容是必修1中关于氨的相关知识的延伸,是对化学反应速率和化学平衡理论的综合应用,围绕着合成氨的反应原理以及实现工业化生产的有关问题,让学生学会将理论知识应用到生产生活中,教师要通过设计学生活动,帮助学生形成分析问题的方法,并给学生创设新的问题情境,使学生运用方法,形成独立分析问题、解决问题的能力。
【学生情况分析】本节课内容为高二年级学生所学,此时期学生的思维已从感性阶段上升到理性阶段,有将理论知识应用到实际生产生活中的欲望。
在此之前,学生已经掌握了氨的化学性质,化学反应速率和化学平衡理论的相关知识,但是还没有将所知识应用于实际问题的经验,因此学生缺少理论与实际相结合的方法。
本节课重在帮助学生形成方法,而不是只教会学生具体的知识。
在学生形成方法的基础上,给学生创设独立演练的机会,学会分析问题、解决问题。
【教学目标】1.知识与技能:(1)掌握合成氨的化学反应原理(2)能够利用化学反应速率,化学平衡移动原理分析和讨论合成氨适宜反应条件。
(3)了解“哈伯—波施法”合成氨的化学史2.过程与方法:通过将理论知识应用于实际生产这一过程,学会具体问题具体分析的方法,能够从多方面因素考虑,提高分析问题、解决问题的能力,同时体会同学之间合作、交流、讨论的重要性。
3.情感态度与价值观:(1)通过了解氨合成的化学史,体会科学精神,培养科学态度和品质。
(2)了解氨合成的重要价值,感受化学学科为人类进步做出的重大贡献。
【教学重点】合成氨的反应原理、合成氨的适宜条件【教学难点】合成氨的适宜条件【教学用具】器材:硬质试管(带塞子)、注射器、导管、铁丝绒、pH试纸药品:氮气、氢气【教学方法】多媒体教学法、讨论法、讲述法【教学流程】【板书设计】原料制备合成条件环境保护。

课题2 人工固氮技术---合成氨相关素材一、哈伯和哈伯法合成氨19世纪以前,一些有远见的化学家指出:考虑到将来的粮食问题,为了使子孙后代免于饥饿,我们必须寄希望于科学家能实现大气固氮。
因此将空气中丰富的氮固定下来并转化为可被利用的形式,在20世纪初成为一项受到众多科学家注目和关切的重大课题。
哈伯就是从事合成氨的工艺条件试验和理论研究的化学家之一。
利用氮、氢为原料合成氨的工业化生产曾是一个较难的课题,从第一次实验室研制到工业化投产,约经历了150年的时间。
1795年有人试图在常压下进行氨合成,后来又有人在50个大气压下试验,结果都失败了。
19世纪下半叶,物理化学的巨大进展,使人们认识到由氮、氢合成氨的反应是可逆的,增加压力将使反应推向生成氨的方向:提高温度会将反应移向相反的方向,然而温度过低又使反应速度过小;催化剂对反应将产生重要影响。
这实际上就为合成氨的试验提供了理论指导。
当时物理化学的权威、德国的能斯特就明确指出:氮和氢在高压条件下是能够合成氨的,并提供了一些实验数据。
法国化学家勒夏特列第一个试图进行高压合成氨的实验,但是由于氮氢混和气中混进了氧气,引起了爆炸,使他放弃了这一危险的实验。
在物理化学研究领域有很好基础的哈伯决心攻克这一令人生畏的难题。
哈伯首先进行一系列实验,探索合成氨的最佳物理化学条件。
在实验中他所取得的某些数据与能斯特的有所不同,他并不盲从权威,而是依靠实验来检验,终于证实了能斯特的计算是错误的。
在一位来自英国的学生洛森诺的协助下,哈伯成功地设计出一套适合于高压实验的装置和合成氨的工艺流程,这流程是:在炽热的焦炭上方吹入水蒸汽,可以获得几乎等体积的一氧化碳和氢气的混和气体。
其中的一氧化碳在催化剂的作用下,进一步与水蒸汽反应,得到二氧化碳和氢气。
然后将混和气体在一定压力下溶于水,二氧化碳被吸收,就制得了较纯净的氢气。
同样将水蒸汽与适量的空气混和通过红热的炭,空气中的氧和碳便生成一氧化碳和二氧化碳而被吸收除掉,从而得到了所需要的氮气。
人工固氮技术——合成氨一、教材分析和教学设想化学选修四中我们已经学过化学反应的方向、限度、速率和化学平衡四部分的内容。
化学反应的方向和限度,化学反应速率的知识,分别从化学热力学角度介绍化学反应方向的判据以及浓度、温度等外界条件对化学平衡的影响,从化学动力学角度介绍影响化学反应速率的因素并进行定量研究和理性分析。
而在实际生产中,从化学热力学角度实现高转达化率所需的条件往往与从化学动力学角度实现高速率所需的条件相互矛盾。
为了以较高速率获得较好的转化率,人们通常对这两方面的研究结果进行综合分析,即进行反应条件的优化。
本节内容就是对前两部分知识的综合应用,以工业合成氨为例探究化学反应条件优化的选择方法,体现化学反应的方向、限度、速率等理论在优化选择化学反应条件方面的作用,使学生了解化学理论的学习对生产实际的指导作用。
本节课的教学设想为:在教学过程中,为学生提供关于合成氨反应的热力学、动力学实验数据,使他们能够利用这些资料就合成氨反应的热力学、动力学问题分别展开讨论,初步尝试利用理论分析化工生产中的实际问题,引导学生考虑合成氨生产中动力、设备、材料生产效率等因素;再结合生产中的数据向学生介绍合成氨的实际生产条件,对合成氨的适宜条件进行选择,使他们在解决实际问题的过程中提升对化学反应的价值的认识;课堂中通过“动手”“动脑”“动口”等师生互动的方法来完成教与学的任务,达成教与学的目标。
二、教学设计思路三、教案课题化学反应条件的优化——工业合成氨授课人倪霞教学知识与技能否自发进行△S=·K-1·mol-1请根据正反应的焓变和熵变分析298K下合成氨反应能否自发进行。
△H-T△S=·mol-1-298K×(·K-1·mol-1)<0298K时,合成氨反应是可以自发进行的。
一般的研究思路:第一步是进行化学热力学分析,判断反应的方向,合成氨反应的限度【活动探究】请同学们根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨的合成【板书】一、合成氨反应的限度【讲述】如图2-4-3所示,在不同反应温度、压强下反应达平衡时,平衡混合物中氨含量的测定结果与上述理论分析结果一致。
高考化学 人工固氮技术---合成氨教学目的:1.利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题;2.了解合成氨的主要原理、原料、重要设备、流程和意义。
教学重点、难点:利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题。
探究建议:参观化工厂或观看有关的影像资料片,考察企业的选址情况,收集产品的生产原理、原料利用率、能耗、投资和成本核算等资料,撰写考察报告。
课时划分:一课时教学过程:[课堂作业]1.合成氨工业对化学工业和国防工业有重要的意义,对我国实现农业现代化起着重要的作用。
关于合成氨工业的说法正确的是 DA .合成氨反应一般选择在500℃左右的温度下进行,只是因为考虑到催化剂的催化活性B . 合成氨工业必须使用铁触媒作催化剂C .目前我国的合成氨工业一般采用的条件是:T ,500℃左右;P ,20MPa —50 MPa ,这时平衡混合物中氨的体积分数已接近100%D .有研究表明,在400℃、压强超过200MPa 时,不必使用催化剂氨的合成反应就能顺利进行2、在合成氨工业中,下列事实不能用勒夏特列原理来解释的是CA .向循环气体中不断补充N2和H2并将生成的NH3及时地从混合气中分离出来,这样做有利于合成氨的反应B .高压有利于合成氨的反应C .加入催化剂有利于合成氨的反应D .温度过高不利于合成氨的反应3、下面是合成氨的简要流程示意图,沿X 线路回去的是CDA .N2和H2B .催化剂C .N2D .H24、关于催化剂的叙述,正确的是CA.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.反应物中的某些杂质能使催化剂失去活性,造成催化剂“中毒”D.催化剂可以提高反应物的转化率5、下列反应起了氮的固定作用的是DA.NH3经催化氧化获得NOB.NO2跟水作用制取硝酸C.NH3+CO2+H2O=NH4HCO3D.N2+O2=2NO(放电条件)6、工业上用氨和二氧化碳反应合成尿素.已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用.若从充分利用原料的角度考虑,选用 (填序号)物质作原料较好BA.COB.石脑油(C5H12、C6H14)C.CH4D.焦炭7.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生,有关说法正确的是CA.达到化学平衡时,N2将完全转化为NH3B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化D.达到化学平衡时,正反应和逆反应的速率都为零8.合成氨所需的氢气由煤与水发生反应制得,其中一步反应为:CO+H2OCO2+H2(正反应为放热),要使CO转化率提高,可采用下列措施中的ACA. 增大水蒸气的浓度B. 增大CO的浓度C. 降低温度D. 增大压强9、实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:NaNO2+NH4Cl=NaCl + NH4NO2NH4NO2 N2↑+2H2O。

课题2 人工固氮技术-------合成氨 教案教学目标1. 使学生理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.了解合成氨生产的一般流程和反应原理、反应条件等。
3.介绍合成氨,体现化工生产的过程,体现实验室研究与实际生产之间转化过程。
教学过程:一、氮的固定1、定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2、方法:氨的固定主要方法有:(1)人工合成氨:化学固氨法。
其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。
常温常压下进行。
成本低、转化率高、效率高。
3、工业应用: 模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。
二、合成氨的反应原理【实验】分析P11的实验,结合有关物质的物理、化学性质总结试管口处湿润的PH 试纸的变化,推测有关反应。
【师生】1、加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色2.用氢气和氨气合成氨的反应式是N 2+3H 2 催化剂 高温高压 2NH 3 ,属放热反应。
3、工业上,采用以铁为主的催化剂,在400~500℃和10Mp a ~30 Mp a 的条件下合成氨。
【阅读】P12科学史话,结合已学化学平衡知识分析下面的问题(1)合成氨中,催化剂的主要作用是什么?答案:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件是什么?答案:以铁为主的催化剂,在400~500℃和10Mp a ~30 Mp a 的条件(3)选择适宜生产条件的原则是什么?提示:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,为什么不采用尽可能高的压强?通常采用10MPa~300MPa 的压强? 提示:会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度会使平衡向右移动,但为什么温度要保持在400~500℃左右?答案:合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于2N 、2H 转化为3NH ;但降温必然减缓了反应速率,影响单位时间产率。

第一单元走进化学工业课题2 人工固氮技术——合成氨教学目标:知识与技能:1.掌握氮的固定的概念,了解工业合成氨对人类社会发展的意义。
2.利用化学反应速率和化学平衡理论解释合成氨中的相关问题。
3.了解合成氨的主要原理、原料、典型设备、流程和意义。
过程与方法:1.通过查阅资料了解工业合成氨的反应原理,并利用所学化学反应速率,化学平衡移动原理分析和讨论合成氨适宜反应条件。
2.结合合成氨的基本生产过程及合成氨工业发展,理解实际生产中问题。
情感态度与价值观:1.能够说出环境污染的主要方面及防止污染的一些措施,增强环境意识,作环境保护的宣传者、行动者。
2.树立合理利用自然资源、节约能源的观点,激发学习工业化学的兴趣,培养创新精神。
教材分析:本节教材的内容:本节教材是高中化学选修二第一章第二节《人工固氮技术—合成氨》的内容,合成氨工业对化学工业、国防工业和我国实现农业现代化具有重要意义,是重要的化学工业之一;同时,氨气、氢气合成氨反应也是一个学生熟悉的、典型的平衡体系。
本节主要通过合成氨的反应原理、原料气的制备和净化,主要生产过程及相应设备。
在化学工业中,需要化学与技术的结合,本节以此为研究对象有利于学生应用化学平衡理论和化学反应速率理论尝试综合选择化工生产的适宜条件,从而体会化学热力学理论和化学动力学理论对生产实践的指导作用。
本节教材的地位及作用:本节学生已在化学必修课中,学过NH3性质,有关氨的用途也已学过,通过“化学反应的快慢和限度”的学习,已经了解了化学反应速率的相关知识并建立了化学平衡的概念。
在本课题学习中,面对合成氨的实际生产问题,通过对合成氨最佳条件的探究,进一步理解化学反应速率和化学平衡移动原理是选择合成氨生产条件的主要依据,同时也提供给学生一条综合运用化学原理和其他生产因素分析和解决实际问题的途径,使他们已有的知识得到拓展和应用,并体会到化学理论对生产实践的指导作用。
教学重点:合成氨的反应原理、合成氨生产的适宜条件。
在初中化学教学中渗透 STS 理念--基于“化学肥料”的两种
教学设计对比研究
潘程
【期刊名称】《化学教与学》
【年(卷),期】2014(000)011
【摘要】初中化学与生活实际联系紧密,在教学中可以渗透 STS 教学理念,通过情境创设及问题设置让学生感受到化学的价值和魅力。
选取“化学肥料”作为案例,通过对比以知识为核心的常规教学设计与融入 STS 理念的教学设计,探讨基于STS 理念的初中化学教学方法。
【总页数】4页(P12-14,23)
【作者】潘程
【作者单位】南京市第二十九中学南京石头城 210036
【正文语种】中文
【中图分类】G633.8
【相关文献】
1.中学化学教学中渗透STEM理念的教学设计r——以"人工固氮技术——合成氨"为例 [J], 吴晓红;田小兰
2.基于STEM理念的初中化学教学设计——以\"配制一定溶质质量分数的氯化钠
溶液\"为例 [J], 张军
3.基于绿色化学理念在初中化学实验教学中的渗透研究 [J], 罗成
4.基于STEM理念的化学教学模式的探究——以初中"化学肥料"的教学设计为例[J], 钟文莉;许应华
5.初中化学教学中STEM理念渗透探究 [J], 龚金辉
因版权原因,仅展示原文概要,查看原文内容请购买。
说课列位专家、评委、同行,大家下午好,我是09级化教2班董蓉,我今天说课的内容是人教版选修2第一章第二课题《人工固氮技术——合成氨》,我将从以下几个方面进行我的说课。
一、教材分析《人工固氮技术——合成氨》那个课题是围绕着合成氨的反映原理和实现工业化生产的问题展开讨论,帮忙学生了解合成氨工业生产的主要原理和进程,熟悉体会由实验室研究到工业化生产所需要经历的进程。
教科书的设计是为了说明如何将大气中的氮固定下来这一中心问题,第一,呈现问题提出的背景,也就是人们为何要想方设法地将大气中的氮固定下来,直接的原因是知足人类对氮肥、硝酸等含氮化合物的需要,间接地原因是地壳中氮元素的含量少,散布不均;紧接着的问题是如何将大气中的氮固定下来,指出合成氨在科学上和技术上的冲破,最后,讨论和评价并引发试探合成氨工业进展所面临的新问题,这种设计整体上表现了技术实践中问题解决不断循环进展的一般进程。
二、教学目标教学目标包括三个方面:1.知识与技术目标①了解合成氨对人类社会进展的重要意义;②利用所学的化学反映速度和化学平衡理论解释合成氨中的相关问题;③了解合成氨的主要原理、原料、重要设备、流程和意义。
2.进程与方式目标①通过学习合成氨反映原理,利用化学反映速度、化学平衡移动原理分析和讨论合成氨适宜反映条件。
②结合合成氨的大体生产进程及合成氨工业进展,理解实际生产中的问题。
3.情感态度与价值观目标①能够说出环境污染的主要方面及避免污染的一些办法,增强环境意识,做环境保护的宣传者、行动者。
②通过本课题的学习,说明工业生产中加速反映、提高原料利用率、节约能源及环境保护的一些办法和方式。
三、教学重难点基于我对本节课教材价值的熟悉,和学生实际学习能力的了解,我确立本节课的重点是合成氨的反映原理,合成氨生产的适宜条件;教学难点第合成氨生产的适宜条件。
四、教学方式我将通过如下教学方式进行教学:1.情景激学法,通过联系旧知识和生活实际导入课题,让学生通过回顾植物体内蛋白质的重要组成元素——氮元素,再联系农作物的肥料,以提起学生学习本节课的兴趣。
课题2 人工固氮技术---合成氨相关素材一、哈伯和哈伯法合成氨19世纪以前,一些有远见的化学家指出:考虑到将来的粮食问题,为了使子孙后代免于饥饿,我们必须寄希望于科学家能实现大气固氮。
因此将空气中丰富的氮固定下来并转化为可被利用的形式,在20世纪初成为一项受到众多科学家注目和关切的重大课题。
哈伯就是从事合成氨的工艺条件试验和理论研究的化学家之一。
利用氮、氢为原料合成氨的工业化生产曾是一个较难的课题,从第一次实验室研制到工业化投产,约经历了150年的时间。
1795年有人试图在常压下进行氨合成,后来又有人在50个大气压下试验,结果都失败了。
19世纪下半叶,物理化学的巨大进展,使人们认识到由氮、氢合成氨的反应是可逆的,增加压力将使反应推向生成氨的方向:提高温度会将反应移向相反的方向,然而温度过低又使反应速度过小;催化剂对反应将产生重要影响。
这实际上就为合成氨的试验提供了理论指导。
当时物理化学的权威、德国的能斯特就明确指出:氮和氢在高压条件下是能够合成氨的,并提供了一些实验数据。
法国化学家勒夏特列第一个试图进行高压合成氨的实验,但是由于氮氢混和气中混进了氧气,引起了爆炸,使他放弃了这一危险的实验。
在物理化学研究领域有很好基础的哈伯决心攻克这一令人生畏的难题。
哈伯首先进行一系列实验,探索合成氨的最佳物理化学条件。
在实验中他所取得的某些数据与能斯特的有所不同,他并不盲从权威,而是依靠实验来检验,终于证实了能斯特的计算是错误的。
在一位来自英国的学生洛森诺的协助下,哈伯成功地设计出一套适合于高压实验的装置和合成氨的工艺流程,这流程是:在炽热的焦炭上方吹入水蒸汽,可以获得几乎等体积的一氧化碳和氢气的混和气体。
其中的一氧化碳在催化剂的作用下,进一步与水蒸汽反应,得到二氧化碳和氢气。
然后将混和气体在一定压力下溶于水,二氧化碳被吸收,就制得了较纯净的氢气。
同样将水蒸汽与适量的空气混和通过红热的炭,空气中的氧和碳便生成一氧化碳和二氧化碳而被吸收除掉,从而得到了所需要的氮气。
人工固氮技术——合成氨一、教材分析和建议本课题围绕着合成氨的反应原理以及实现工业化生产的有关问题展开讨论,帮助学生了解合成氨工业生产的主要原理和过程,认识并体会由实验室研究到工业化生产所需要经历的过程。
教科书的设计是,为了说明如何将大气中的氮固定下来这一中心问题,首先,呈现问题提出的背景,也就是人们为什么要想方设法地将大气中的氮固定下来,直接的原因是满足人类对氮肥、硝酸等含氮化合物的需要,间接的原因是地壳中氮元素的含量少、分布不均;紧接着的问题是如何将大气中的氮固定下来,指出合成氨在科学上和技术上的突破。
最后,讨论和评价并引发思考合成氨工业发展所面临的新问题。
这种设计整体上体现了技术实践中问题解决不断循环发展的一般过程,如下页图所示。
教学建议如下:1. 注意引导学生思考人工固氮技术——合成氨对于人类社会发展的重要意义,体现化学与技术发展的社会需求导向,并对技术生产评价标准的多元化有一个初步的认识。
说明在化学研究中,有些课题是属于学术研究的热点和重点,但不一定是技术研究开发的热点和重点,技术研究往往要解决实际生产和生活中的具体问题,是受社会需求驱动的,这一点贯穿于整个教科书体系的设计中。
另外,化学技术创新往往要落实在一种产品的生产上,合成氨就是这方面的典型代表。
在课题1了解化工生产过程中的基本问题的基础上,引导学生思考将实验室研究转化成实际生产时面临的一些问题,展示由一种原理上可行的设想转变成实际生产过程中人们所要付出的艰苦努力。
对于有志于理工科的学生来说,在培养科学技术素养的同时不断提高人文素养;对于有志于人文学科的学生来说,要帮助他们形成对于科学技术在社会发展中重要作用的正确认识。
例如,可以结合对哈伯其人其事(见教学资源)的分析评价,请同学们讨论和交流各自的看法。
2. 通过实验学习合成氨的反应原理,利用化学反应速率、化学平衡移动原理分析和讨论合成氨的适宜反应条件。
由于氮气具有特殊的稳定性,合成氨是人工固定氮的一种方法,但反应条件比较苛刻。