高中常见的强电解质和弱电解质精选文档
- 格式:docx
- 大小:51.74 KB
- 文档页数:5


考点20 强电解质弱电解质【知识梳理】一、强电解质与弱电解质1.强电解质:(1)概念:在水溶液中能够完全电离的电解质。
(2)常见的强电解质①强酸:H2SO4、HCl、HNO3等。
①强碱:NaOH、KOH等。
①绝大多数盐。
(3)电离方程式中用“===”表示完全电离,写出下列物质的电离方程式:①H2SO4:H2SO4===2H++SO2-4。
①Ba(OH)2:Ba(OH)2=== Ba2++2OH-。
①CaCl2:CaCl2===Ca2++2Cl-。
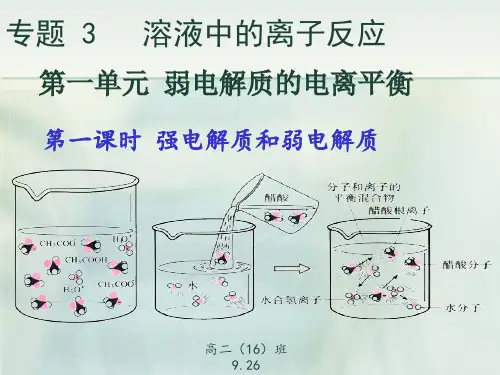
2.弱电解质(1)概念:在水溶液中不能完全电离的电解质。
(2)常见的弱电解质①弱酸:H2CO3、CH3COOH等。
①弱碱:NH3·H2O等。
①H2O。
(3)电离方程式中用“”表示不能完全电离,写出下列物质的电离方程式:①CH3COOH:CH3COOH CH3COO-+H+。
①NH3·H2O:NH3·H2O NH+4+OH-。
3.电解质的强弱与溶液的导电能力及电解质的溶解度都没有必然联系,只与电离程度有关。
某些难溶(或微溶)于水的盐(如AgCl、BaSO4等),其溶解度很小,但其溶于水的部分是完全电离的,它们仍属于强电解质。
电解质溶液的导电能力与自由离子的浓度和离子所带的电荷数有关。
强电解质溶液的导电能力不一定强。
二、强电解质与弱电解质比较1.强电解质和弱电解质的比较强电解质弱电解质电离条件溶于水或熔融状态溶于水或熔融状态电离程度完全电离部分电离电离过程不可逆过程可逆过程溶液中微粒只有电解质电离出的阴、阳离子、溶剂分子,不存在电解质分子既有电解质电离出的阴、阳离子、溶剂分子,还存在电解质分子实例多数盐(包括难溶盐)、强酸、强碱等弱酸、弱碱、水例1.(2022·浙江·余姚市高风中学高一阶段练习)下列物质中是弱电解质的是A.Cu B.CH3COOH C.CO2D.CH4【答案】B【解析】A.Cu是单质,既不是电解质也不是非电解质,A正确;B.CH3COOH为弱电解质,B错误;C.CO2为非电解质,C错误;D .CH 4是非电解质,D 错误; 故选A 。


强电解质和弱电解质[教学重点]1、掌握强、弱电解质的概念及弱电解质的电离平衡。
2、了解电解质强弱与导电能力的一般关系。
[重点讲解]一、强电解质和弱电解质(一)电解质1、定义:凡是在水溶液里或熔化状态下能导电的化合物实质:在水溶液或熔化状态下能电离出自由移动的离子的化合物。
注意:(1)电解质和非电解质研究范畴均是化合物。
(2)某些化合物溶于水后其水溶液能导电但不一定是电解质。
例:SO3溶于水后可以与水反应生成H2SO4而导电,但SO3为非电解质。
(3)离子化合物呈固态,共价化合物呈液态虽然是电解质但不导电,因为没有自由移动的离子。
(4)电解质和电解质的水溶液不同,前者为纯净物,后者为混合物。
2、中学常见的电解质酸、碱、大多数盐(中学所学)均是电解质。
3、电解质导电(1)原因:形成自由移动的离子。
(2)导电能力:相同条件下与溶液中的离子浓度大小有关。
(二)强电解质和弱电解质1、比较:强电解质弱电解质电离程度全部部分电离方程式:H2SO4=2H++SO42-NaHCOO3=Na++HCO3-NaHSO4=Na++H++SO42-溶质微粒离子分子为主,离子为辅实例强酸:HCl,HNO3,H2SO4弱酸:HF,HClO,HCOOH,H2CO3HBr,HI等CH3COOH,,H2S,H2SO3,H2SiO3,H2O,H3PO4等强碱:KOH,NaOH,Ba(OH)2弱碱:NH3·H2O,Al(OH)3Ca(OH)2等不溶性碱大多数盐:NaClBaSO4AgCl等注意:强弱电解质的判断依据是,该电解质溶解后电离是否完全而不是该溶液中的离子浓度大小。
例:BaSO4虽难溶于水,但溶解的部分完全电离,所以是强电解质。
2、弱电解质的电离平衡(1)概念:在一定条件下弱电解质的电离速率与结合速率相等时,电离过程就达到了平衡状态,叫做电离平衡状态。
(2)特点:等,V电离=V结合;定,离子浓度和分子浓度不变;动,动态平衡;变,条件改变电离平衡发生移动,电离为吸热过程。

高中化学学习材料唐玲出品专题一强电解质和弱电解质(一课时)考纲要求:1、了解电解质和非电解质的概念。
2:了解强电解质和弱电解质的概念。
3、了解电解质溶液的导电性。
4、能正确书写电离方程式。
考点精讲与例题:考点一:电解质和非电解质1:电解质:电解质包括的物质:2:非电解质:非电解质常见的物质:例1:判断下列说法中正确的是()①氯气的水溶液导电,所以氯气是电解质。
②二氧化碳的水溶液能导电,二氧化碳是电解质。
③硫酸钡的水溶液不导电,但是硫酸钡是电解质。
④氯化钠溶液的水溶液能导电,氯化钠溶液是电解质。
A、①③B、③C、①③④D、都不正确思考:判断电解质和非电解质的方法是:。
考点二:强电电解质与弱电解质3:强电解质:强电解包括的物质有:强电解质在水溶液存在的形式:4:弱电解质:。
弱电解质包括的物质有:弱电解质在溶液中存在的形式5:电离:电解:例2:下列说法正确的是()A.氯化钠溶液在电流作用下电离成钠离子和氯离子B.强电解质溶液不一定比弱电解质的导电性强C.共价键的极性强的化合物一定是强电解质D.强、弱电解质的导电性只由它们的浓度决定例3:下列说法正确的是()A.强电解质一定是离子化合物 B.含有强极性键的化合物不一定是强电解质C.强电解质的饱和溶液一定是浓溶液D.强电解质在水中一定能全部溶解思考:判断电解质强弱的标准:例4:写出下列物质的电离方程式:H 2SO 4 Ba(OH)2 NaHCO 3NaHSO 4(水溶液中) CH 3COOH NH 3·H 2OH 2CO 3 NaHSO 4 (熔化状态下) Fe (OH )3考点三:溶液导电性6、影响电解质溶液导电性的因素:例5:把0.05 mol NaOH 固体分别加入到100 mL 下列液体中,溶液的导电能力变化最小的是( )A . 自来水B . 0.5 mol / L 盐酸C . 0.5 mol / L HAc 溶液D . 0.5 mol / L KCl 溶液强化训练:1、(2000上海7)下列物质的水溶液能导电,但属于非电解质的是( )A.CH 3CH 2COOHB.Cl 2C.NH 4HCO 3 D .SO 22、(2003试测题(试验修订)5)在溶液导电性实验装置里,分别注入20 mL 4 mol ·L -1的醋酸和20 mL4 mol ·L -1的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则( )A.灯光明暗程度不变B.灯光变暗C .灯光变亮 D.灯光明暗程度变化不明显3、下列不属于电离方程式的是 ( )A 、2 H 2O H 3O ++OH -B 、H 2O H ++OH -C 、CH 3COOH +H 2O CH 3COO -+H 3O +D 、CH 3COOH +NaOH==CH 3COONa +H 2O4、相同温度下,下列溶液导电性最强的是( )A. 1 L 0.1 mol ·L -1醋酸B.0.1 L 0.1 mol ·L -1硫酸溶液C. 0.5 L 0.1 mol ·L -1盐酸D. 2L 0.1 mol ·L -1亚硫酸溶液5、下列物质属于非电解质的是( )A 、液态汞B 、液态氨C 、硫酸钡D 、硝酸6、下列电离方程式正确的是 ( )A.H 3PO 43H + + PO 43-B.CaCO 3Ca 2+ + CO 32- C.NaHS Na + + H + + S 2- D . Al(OH)3H 2O + AlO 2- + H +7、醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流强度I 随加入氨水的体积V 的变化曲线是( )8、等物质的量下列各状态的电解质,自由离子数由大到小的排列顺序是 ( )①熔融的NaHSO 4 ②NaHSO 4水溶液 ③NaHCO 3水溶液 ④H 2CO 3溶液A 、①②③④B 、 ④②③①C 、②③①④D 、 ②①③④V IO A V I O B V I O C V I O D参考答案:例1:B例2:B例3:B例4:略例5:B强化训练:1、D2、C3、D4、B5、B6、D7、B8、C。

强电解质和弱电解质的概念(一)强电解质和弱电解质的概念强电解质的定义和特点•强电解质是指在溶液中能够完全离解的物质,产生大量的离子。
•强电解质在水溶液中的离子浓度非常高,导电性能强。
•强电解质溶液能够形成高浓度的离子,产生明显的电导效应。
强电解质的例子•盐酸(HCl):盐酸分子可完全离解为氢离子(H+)和氯离子(Cl-),产生强酸性溶液。
•硝酸(HNO3):硝酸分子可完全离解为氢离子(H+)和硝酸根离子(NO3-),产生强酸性溶液。
•高浓度的氢氧化钠(NaOH):氢氧化钠分子可完全离解为钠离子(Na+)和氢氧根离子(OH-),产生强碱性溶液。
弱电解质的定义和特点•弱电解质是指在溶液中只能部分离解的物质,产生少量的离子。
•弱电解质在水溶液中的离子浓度较低,导电性能相对弱。
•弱电解质溶液中离子的生成与离解过程达到一定的平衡状态。
弱电解质的例子•乙酸(CH3COOH):乙酸分子只能部分离解为氢离子(H+)和乙酸根离子(CH3COO-),产生弱酸性溶液。
•碳酸(H2CO3):碳酸分子只能部分离解为氢离子(H+)和碳酸根离子(HCO3-),产生弱酸性溶液。
•氨水(NH3):氨水分子只能部分离解为氨离子(NH4+)和氢氧根离子(OH-),产生弱碱性溶液。
强电解质和弱电解质的区别•全部离解程度不同:强电解质完全离解,产生大量离子;弱电解质只部分离解,产生少量离子。
•导电性能差异:强电解质的水溶液导电性能较强,弱电解质的水溶液导电性能相对较弱。
•离子浓度差异:强电解质的水溶液离子浓度较高,弱电解质的水溶液离子浓度相对较低。
强电解质和弱电解质的概念和特点对于理解化学反应、酸碱中和、电解质溶液的性质等方面都具有重要意义。
我们在实际应用中需要根据反应需求选择合适的电解质类型,以达到预期的效果。

所有高中会出现的强电解质:
1、强酸:HCl H2SO4硫酸 HNO3硝酸 HBr氢溴酸 HI氢碘酸 HCLO4高氯酸
2、强碱:NaOH KOH Ba(OH)2氢氧化钡 Ca(OH)2氢氧化钙
3、绝大多数盐:高中见到的盐全部是强的电解质
金属化合物:a、氧化物:氧化钙CaO 氧化钠Na2O 氧化镁MgO 氧化Al2O3 氧化锌 ZnO 氧化盐铁FeO 氧化铁Fe2O3 氧化铜CuO 氧化汞HgO 氧化银Ag2O
b、过氧化合物:过氧化钠Na2O2
c、金属碳化物:碳化钙CaC2
d、金属硫化物:硫化钙CaS2 二硫化亚铁FeS2
弱电解质:
1、弱酸:碳酸H2CO3 亚硫酸H2SO3 醋酸CH3COOH 氢硫酸H2S 氢氟酸HF 硅酸H2SiO3 原硅酸H3SiO4 所有的有机酸
2、弱碱:一水合氨NH3.H2O 所有的除强碱的氢氧化金属R(OH)
3、水H2O也是弱电解质
非电解质:
1、非金属氧化物:二氧化碳二氧化硫一氧化碳三氧化硫二氧化氮一氧化氮
2、大多数有机物:甲烷乙醇蔗糖(有机酸和有机盐除外)
3、非金属化合物:氨气.。


专题一强电解质和弱电解质考纲要求:1、了解电解质和非电解质的概念。
2:了解强电解质和弱电解质的概念。
3、了解电解质溶液的导电性。
4、能正确书写电离方程式。
考点精讲与例题:考点一:电解质和非电解质1:电解质:电解质包括的物质:2:非电解质:非电解质常见的物质:例1:判断下列说法中正确的是()①氯气的水溶液导电,所以氯气是电解质。
②二氧化碳的水溶液能导电,二氧化碳是电解质。
③硫酸钡的水溶液不导电,但是硫酸钡是电解质。
④氯化钠溶液的水溶液能导电,氯化钠溶液是电解质。
A、①③B、③C、①③④D、都不正确注意:(1)氯气的水溶液导电,氯气是电解质吗?(2)二氧化碳的水溶液能导电,二氧化碳是电解质吗?(3)硫酸钡的水溶液不导电,氯化钡是电解质吗?思考:判断电解质和非电解质的方法是:。
考点二:强电电解质与弱电解质3:强电解质:强电解包括的物质有:强电解质在水溶液存在的形式:4:弱电解质:。
弱电解质包括的物质有:弱电解质在溶液中存在的形式5:电离:电解:例2:下列说法正确的是()A.氯化钠溶液在电流作用下电离成钠离子和氯离子B.强电解质溶液不一定比弱电解质的导电性强C.共价键的极性强的化合物一定是强电解质D.强、弱电解质的导电性只由它们的浓度决定例3:下列说法正确的是()A.强电解质一定是离子化合物 B.含有强极性键的化合物不一定是强电解质C.强电解质的饱和溶液一定是浓溶液D.强电解质在水中一定能全部溶解思考:判断电解质强弱的标准:例4:写出下列物质的电离方程式:H 2SO4Ba(OH)2NaHCO3NaHSO4(水溶液中) CH3COOH NH3·H2OH 2CO3NaHSO4(熔化状态下) Fe(OH)3Al(OH)3考点三:溶液导电性6、影响电解质溶液导电性的因素:例5:把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是()A.自来水B. 0.5 mol / L盐酸C. 0.5 mol / L HAc溶液D. 0.5mol / L KCl溶液例6:醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流强度I随加入氨水的体积V的变化曲线是()专题二弱电解质的电离平衡考纲要求:1、掌握电离平衡状态的概念。

高中常见电解质1. 什么是电解质?电解质是指能够在溶液中或熔融状态下导电的物质。
它们在水溶液中会分解成带电的离子,从而使溶液具有导电性质。
电解质的分解过程称为电离。
2. 电解质的分类电解质可以分为两类:强电解质和弱电解质。
2.1 强电解质强电解质是指在水溶液中完全电离的物质,能够产生大量的离子。
常见的强电解质包括:•酸:如盐酸(HCl)、硫酸(H2SO4)等;•碱:如氢氧化钠(NaOH)、氢氧化钾(KOH)等;•盐:如氯化钠(NaCl)、硝酸铵(NH4NO3)等。
2.2 弱电解质弱电解质是指在水溶液中只部分电离的物质,产生的离子数量较少。
常见的弱电解质包括:•部分电离的酸:如乙酸(CH3COOH)、碳酸(H2CO3)等;•部分电离的碱:如氨水(NH3·H2O)等。
3. 高中常见电解质3.1 酸酸是指能够产生氢离子(H+)的物质。
高中化学中常见的酸有:•盐酸(HCl):是一种无色、刺激性气味的强酸,可以与金属反应产生盐和氢气;•硫酸(H2SO4):是一种无色、有刺激性气味的强酸,可以与金属反应产生盐和氢气;•硝酸(HNO3):是一种无色、有刺激性气味的强酸,可以与金属反应产生盐和氢气;•醋酸(CH3COOH):是一种无色液体,呈醋味,属于弱酸。
3.2 碱碱是指能够产生氢氧根离子(OH-)的物质。
高中化学中常见的碱有:•氢氧化钠(NaOH):是一种无色晶体,易吸湿,能与酸反应生成盐和水;•氢氧化钾(KOH):是一种无色结晶或白色颗粒,能与酸反应生成盐和水;•氨水(NH3·H2O):是一种无色气味刺激的液体,是弱碱。
3.3 盐盐是由酸和碱反应生成的化合物,可以在水溶液中完全电离。
高中化学中常见的盐有:•氯化钠(NaCl):是一种无色结晶,是食盐的主要成分;•碳酸钠(Na2CO3):是一种无色结晶,常用于软化水和制备碱性溶液;•硝酸铵(NH4NO3):是一种无色结晶,常用作氮肥。
4. 电解质在生活中的应用4.1 电解质溶液的导电性电解质溶液的导电性是电解质重要的特性之一。
高中常见的强电解质和
弱电解质精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
强电解质和弱电解质
[教学重点]1、掌握强、弱电解质的概念及弱电解质的电离平衡。
2、了解电解质强弱与导电能力的一般关系。
[重点讲解]
一、强电解质和弱电解质
(一)电解质
1、定义:凡是在水溶液里或熔化状态下能导电的化合物
实质:在水溶液或熔化状态下能电离出自由移动的离子的化合物。
注意:
(1)电解质和非电解质研究范畴均是化合物。
(2)某些化合物溶于水后其水溶液能导电但不一定是电解质。
例:SO3溶于水后可以与水反应生成H2SO4而导电,但SO3为非电解质。
(3)离子化合物呈固态,共价化合物呈液态虽然是电解质但不导电,因为没有自由移动的离子。
(4)电解质和电解质的水溶液不同,前者为纯净物,后者为混合物。
2、中学常见的电解质
酸、碱、大多数盐(中学所学)均是电解质。
3、电解质导电
(1)原因:形成自由移动的离子。
(2)导电能力:相同条件下与溶液中的离子浓度大小有关。
(二)强电解质和弱电解质
1、比较:强电解质弱电解质
电离程度全部部分
电离方程式:H2SO4=2H++SO42-
NaHCOO3=Na++HCO3-
NaHSO4=Na++H++SO42-
溶质微粒离子分子为主,离子为辅
实例强酸:HCl,HNO3,H2SO4弱酸:HF,HClO,HCOOH,H2CO3
HBr,HI等
CH3COOH,,H2S,
H2SO3,H2SiO3,H2O,H3PO4等强碱:KOH,NaOH,Ba(OH)2 弱碱:NH3·H2O,Al(OH)3
Ca(OH)2等不溶性碱
大多数盐:NaCl BaSO4 AgCl等
注意:强弱电解质的判断依据是,该电解质溶解后电离是否完全而不是该溶液中的离子浓度大小。
例:BaSO4虽难溶于水,但溶解的部分完全电离,所以是强电解质。
2、弱电解质的电离平衡
(1)概念:在一定条件下弱电解质的电离速率与结合速率相等时,电离过程就达到了平衡状态,叫做电离平衡状态。
(2)特点:等,V电离=V结合;
定,离子浓度和分子浓度不变;
动,动态平衡;
变,条件改变电离平衡发生移动,电离为吸热过程。
(3)影响电离平衡移动的因素:因为电离平衡是动态平衡,其规律仍遵循化学平衡移动原理。
①浓度:改变浓度电离平衡向削弱该改变的方向移动。
加水,弱电解质电离平衡向电离方向移动,但离子浓度均减小。
②温度:因为电离过程是吸热过程,所以升高温度,弱电解质的电离平衡向电离方向移动。
(4)多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,例如,L H2S溶液中各步电离[H+]为:
[H+]=1×10-4mol/L
[H+]=1×10-13mol/L
电离难的原因为:a、一级电离出H+后,剩下的酸根阴离子带负电荷,增加了对H+的吸引力,使第二个H+离子电离困难的多;b、一级电离出的H+抑制了二级的电离。
[例题讲解]
1、把 NaOH分别加入到下列100mL溶液中,溶液的导电能力变化不大的是()
A、自来水
B、L 盐酸
C、L醋酸
D、L氯化铵
分析:电解质溶液导电能力与该溶液中的离子浓度有关,离子浓度越大,导电能力就越强,导电能力变化不大,说明该溶液中在加入NaOH前后离子浓度无显着变化。
A选项中自来水中加入NaOH后离子浓度发生显着变化。
C选项中醋酸为弱电解质,反应前离子浓度较小,加入NaOH后发生
CH3COOH+NaOH=CH3COONa+H2O反应后生成强电解质CH3COONa,离子浓度显着增大。
故A、C不选。
B、D选项中原溶液中本来就是强电解质,加入NaOH后显然发生了化学反应,但溶液仍然是强电解质的溶液,离子浓度变化不大,故符合题意。
答案:B、D
2、硫化氢的水溶液中有如下的动态平衡关系:
,在浓度为L的H2S溶液中下列各离子浓度间的关系正确的是()
A、[H+]=[HS-]+2[S2-]+[OH-]
B、2[H+]=2[HS-]+[S2-]+2[OH-]
C、[H+]=[HS-]+[S2-]
D、[S2-]+[HS-]+[H2S]=L
分析:在有关弱电解质溶液中微粒关系的分析中多从两个角度入手分析:①电量守恒,电解质溶液不显电性,故应正,负电荷所带电量总量应相等。
本题中阳离子只有H+,H+所带正电荷数应与该溶液中的阴离子(OH-,S2-,HS-)所带电荷数之和相等,所以A正确。
②质量守恒,可以是某种元素不同状态的微粒之和在平衡前后守恒,所以达到平衡后三者之和应为L。
答案:(A、D)
3、有①、②、③三瓶体积相等,浓度都是1mol/L的HCl溶液,将①加热蒸发至体积减少一半;在
③中加入少量CH 3COONa固体(加入后溶液呈强酸性);③不作改变,然后以酚酞作指示剂,用NaOH 滴定上述三种溶液,所消耗的NaOH溶液的体积是
A、①=③>②
B、③>②>①
C、③=②>①
D、①=②=③
分析:消耗NaOH的量取决于溶液中能电离的H+的物质的量,H+的物质的量减少;③中加
CH3COONa会和HCl发生反应;CH3COONa+HCl=CH3COOH+NaCl,但能电离出的H+的物质的量不变,加入NaOH后,OH-和CH3COOH电离出的H+反应,使向右移动,直到全部电离,所以消耗NaOH的体积和③一样大,故选C。
参考练习:
1、下列物质中属于电解质的是()
A、稀硫酸
B、熔融氢氧化钠
C、乙醇
D、HCl溶液
2、下列物质容易导电的是()
A、熔融的氢氧化钠
B、硝酸钾溶液
C、硫酸铜晶体
D、无水乙醇
3、某1∶1的盐酸vmL,与锌完全反应产生H2标准状况下为mmL,但反应速率太快,若要降低反应速率,使vmL盐酸仍产生mmL H2,应加入
A、NaOH
B、蒸馏水
C、NaCl晶体
D、CH3COONa
4、在氢硫酸溶液中,通入或加入少量下列物质:①O2②Cl2③SO2④CuSO4,能使溶液中的[H+]增大的是()
A、①③
B、②④
C、②③④
D、只有①
5、甲酸的下列性质中,可以证明它是弱电解质的是()
A、1mol/L甲酸溶液的[H+]约为1×10-2mol/L
B、甲酸能与水以任何比例互溶
C、10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D、在相同条件下,甲酸溶液的导电性比强酸溶液的弱
6、在物质的量浓度相等的两种一元弱酸的钠盐溶液中,分别通入适量的CO2,发生如下反应:
NaR+CO2+H2O=HR+NaHCO3
2NaR'+CO2+H2O=2HR'+Na2CO3
则HR和HR'电离出H+能力大小比较___________
参考答案:(1)B (2)AB (3)BD (4)B (5)A (6)HR'<HR。