电解CuCl2溶液阳极4OH--4e
- 格式:ppt
- 大小:1.47 MB
- 文档页数:56

电极反应方程式一、原电池电极反应方程式1.Cu─H2SO4─Zn原电池正极:2H+ + 2e- == H2↑负极:Zn—2e- == Zn2+总反应式:Zn + 2H+ == Zn2+ + H2↑2.Cu─FeCl3─C原电池正极:2Fe3+ + 2e- == 2Fe2+负极:Cu —2e- == Cu2+总反应式:2Fe3+ + Cu == 2Fe2+ + Cu2+ 3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- == 4OH-负极:2Fe—4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2F e(O H)2↓4.钢铁在潮湿的空气中发生析氢腐蚀正极:2H+ +2e- == H2↑负极:Fe —2e- == Fe2+总反应式:Fe +2H+ == Fe2+ +H2↑5.氢氧燃料电池(中性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O6.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- == 2H2O负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O7.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e- + 4OH- == 4H2O总反应式:2H2 + O2 == 2H2O8.铅蓄电池(放电)正极(PbO2) :PbO2 + 2e- + 24SO-+ 4H+ == PbSO4↓+ 2H2O负极(Pb) :Pb—2e- + 24SO-== PbSO4↓总反应式:Pb + PbO2 + 4H+ + 224SO-== 2PbSO4↓+2H2O9.Al─NaOH─Mg原电池正极:6H2O + 6e- == 3H2↑+ 6OH-负极:2Al —6e- + 8OH- == 22AlO-+ 4H2O总反应式:2Al + 2OH- + 2H2O == 22AlO-+ 3H2↑10.CH4燃料电池(碱性介质)正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4—8e- + 10OH- ==23CO-+ 7H2O总反应式:CH4 + 2O2 + 2OH- == 23CO-+ 3H2O 11.熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料):正极:O2 + 2CO2 + 4e- == 223CO-(持续补充CO2气体)负极:2CO + 223CO-—4e- == 4CO2总反应式:2CO + O2 == 2CO212.银锌纽扣电池(碱性介质)正极(Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH-负极(Zn) :Zn + 2OH-—2e- == ZnO + H2O总反应式:Zn + Ag2O == ZnO + 2Ag二、电解电极反应方程式1.电解CuCl2溶液阳极:2Cl-—2e- == Cl2↑阴极:Cu2+ + 2e- == Cu总反应式:2Cl- + Cu2+ ==== Cl2↑ + Cu2.电解精炼铜阳极(粗铜):Cu —2e- == Cu2+阴极(纯铜) :Cu2+ + 2e- == Cu总反应式:无3.电镀铜阳极(纯铜):Cu—2e- == Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu总反应式:无4.电解饱和食盐水阳极:2Cl-—2e- == Cl2↑阴极:2H2O + 2e- == H2↑ + 2OH-总反应式:2Cl- + 2H2O ==== H2↑+ Cl2↑ + 2OH-5.电解HCl溶液阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:2Cl- + 2H+==== Cl2↑ + H2↑6.电解NaOH溶液阳极:4OH-—4e- == O2↑ + 2H2O阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑+ O2↑7.电解H2SO4溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H+ +4e- == 2H2↑总反应式:2H2O ==== 2H2↑ + O2↑8.电解KNO3溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑ + O2↑9.电解CuSO4溶液阳极:2H2O—4e- == O2↑ + 4H+电解电解电解电解电解电解阴极:2Cu2+ + 4e- == 2Cu↓总反应式:2Cu2+ + 2H2O ==== 2Cu↓+ O2↑+ 4H+ 10.电解AgNO3溶液阳极:2H2O—4e- == O2↑ + 4H+阴极:4Ag+ + 4e- == 4Ag↓总反应式:4Ag+ + 2H2O ==== 4Ag↓+ O2↑ + 4H+ 11.铅蓄电池充电阳极:PbSO4—2e- + 2H2O == PbO2 +24SO-+ 4H+阴极:PbSO4 + 2e- == Pb + 24SO-总反应式:2PbSO4 + 2H2O ==== Pb + PbO2 + 4H+ +224SO-B2H6(g) + 3O2(g) ==== B2O3(s) + 3H2O(l);ΔH = - 2165 kJ·mol-1电解电解电解。

高考化学复习考点知识归类与练习电解池工作原理1.电解 (1)定义:在直流电源的作用下,电解质溶液(或熔融的电解质)在阳、阴两极分别发生氧化反应和还原反应应的过程。
(2)能量转化形式:在此过程中,将电能__能转化为___化学__能。
2.电解池的构成条件①与直流电源相连的两个电极②两个电极插入电解质溶液 (或熔融的电解质)中③形成闭合回路_。
3.电解池中电流、电子和离子的移动方向(如右下图)电流(I):从电源正极流出到阳极,经过电解质溶液,再通过阴极回到电源负极形成闭合回路。
电子:电源负极流出,阴极得电子;阳极失电子流入电源正极(“电子不下水”)---外电路。
离子:口诀:“阴阳相吸”-----阳离子移向阴极,阴离子移向阳极(“离子不上岸”)----内电路。
溶液为例):4. 电解池工作原理(以电解CuCl2总反应方程式:CuCl2=====通电Cu+Cl2↑阳极阴离子失去电子e-发生氧化反应,阴极阳离子得电子发生还原反应。
阳极反应类型口诀:“阳氧失e-”-------意思为阳极发生氧化反应失去电子。
5.电解时两极粒子放电顺序:阴离子失去电子或阳离子得到电子的过程叫放电。
离子的放电顺序取决于离子本身的性质即离子得失电子的能力,另外也与离子的浓度及电极材料有关。
(1)阴极:阴极上放电的是溶液中的阳离子,与电极材料无关。
氧化性强的先放电,放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。
若是惰性电极作阳极,则是溶液中的阴离子放电,离子还原性强的先放电,常见离子的放电顺序是注意:一般情况下,离子按上述顺序放电,但如果离子浓度相差十分悬殊,离子浓度大的也可以先放电。
如理论上H +的放电能力大于Fe 2+、Zn 2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液中,由于溶液中c (Fe 2+)或c (Zn 2+)≥c (H +),则先在阴极上放电的是Fe 2+或Zn 2+,因此阴极上的主要产物为Fe 或Zn ;但在水溶液中,Al 3+、Mg 2+、Na +等是不会在阴极上放电的。

电化学基础考题分析与解题方法一、课程标准、考试说明的要求1.了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
2.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
二、近三年高考有关电化学知识考题分析(一)原电池及原理其综合考查1、在书本锌铜原电池原理基础上稍有变化的原电池:从原电池的组成、电极反应(或原电池反应)、电流方向(或电子流向)、盐桥的作用等多方面来考查原电池的基本原理,在多年来高考题中时有出现,体现了对基础知识和能力的考查。
(见附件1)【复习建议】复习原电池要从氧化还原反应开始。
有电子转移的反应叫氧化还原反应,若能使氧化还原反应发生在两类导体的界面上,并使转移的电子从导线中流过就会有电流产生。
Zn跟稀H2SO4制H2的反应可分解为Zn-2e-=Zn2+,2H++2e-=H2↑的两个半反应。
这两个半反应就是原电池的电极反应。
真正想懂原电池等自发电池中发生的电极反应与氧化还原反应的关系。
象把FeCl3溶液与Cu的反应设计成自发电池的题目就很容易答出来。
对于各种电池中发生的电极反应和总的氧化还原反应都不要去死记硬背,都要引导学生自己分析自己写出。
2、扩展到其他自发电池:①能分析一次电池(碱性锌锰电池)、可充电电池(铅蓄电池)的充放电情况:正负极、阴阳极的判断及电极反应式。
(见附件2)②常见燃料电池(氢氧燃料电池,甲烷、乙醇等燃料电池)的正负极判断,能写出在酸性/碱性条件下的电极反应式及总反应,并能从电极反应物、得失电子判断电极反应式的正误。
(见附件3)【复习建议】教学中应把选修四第四章第2节给出的碱性锌锰电池、铅蓄电池、氢氧燃料电池的正负极材料、电极反应及总反应作为重点分析。
虽然课本中只给出氢氧燃料电池一个例子,但课本还提了一句“除氢气外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯氧外,空气中的氧气也可以作氧化剂”。


1.Cu─H2SO4─Zn原电池正极: 2H+ + 2e- H2↑负极: Zn─2e- Zn2+总反应式: Zn + 2H+ Zn2+ + H2↑Cu─CuSO4─Zn原电池正极: Cu2+ + 2e-Cu负极: Zn─2e- Zn2+总反应式: Zn + Cu2+ Zn2+ +Cu2.Cu─FeCl3─C原电池正极: 2Fe3+ + 2e- 2Fe2+负极: Cu ─ 2e- == Cu2+总反应式: 2Fe3+ + Cu 2Fe2+ + Cu2+3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- 4OH-负极:2Fe ─ 4e- = 2Fe2+总反应式:2Fe + O2 + 2H2O 2F e(O H)2↓[F e(O H)2最终转变为铁锈]4.析氢腐蚀(酸性)负极:Fe–2e-=Fe2+正极:2H++2e-=H2↑总反应:Fe+2H+=Fe2+ +H2↑5.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- 2H2O负极:2H2─4e-4H+总反应式:2H2 + O22H2O6.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:2H2─ 4e- + 4OH-4H2O总反应式:2H2 + O22H2O7.氢氧燃料电池(熔融氧化物O2-介质)正极:O2 + 4e-2O2-负极:2H2─ 4e- + 2O2-2H2O总反应式:2H2 + O22H2O8.铅蓄电池(放电)正极 (PbO2) :PbO2 + 2e- + SO42- + 4H+PbSO4↓ + 2H2O负极 (Pb) :Pb ─2e- + SO42- PbSO4↓总反应式:Pb + PbO2 + 4H+ + 2SO42- 2PbSO4↓ + 2H2O9.Al─NaOH─Mg原电池正极:2H2O + 2e-H2↑ + 2OH-负极:Al─3e- + 4OH- == AlO2- + 2H2O总反应式:2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑10.CH4燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:CH4─8e- + 10OH- CO32- + 7H2O总反应式:CH4 + 2O2 + 2OH-CO32- + 3H2O11.CH4燃料电池(酸性介质)正极:O 2 + 4H ++ 4e - 2H 2O负极:CH 4─8e - + 2H 2O CO 2 + 8H +总反应式:CH 4 + 2O 2 CO 2 + 2H 2O燃料电池(熔融氧化物O 2-介质)正极:O 2 +4e - 2O 2-负极:CH 4─8e - + 4 O 2- CO 2 + 2H 2O总反应式:CH 4 + 2O 2 CO 2 + 2H 2O 燃料电池(熔融碳酸盐介质)正极:O 2 + 2 CO 2 + 4e - 2CO 32-负极:CH 4─8e - + 4CO 32- 5CO 2+ 2H 2O总反应式:CH 4 + 2O 2 CO 2 + 2H 2O14.熔融碳酸盐燃料电池(Li 2CO 3和Na 2CO 3熔融盐作电解液,CO 作燃料):正极:O 2 + 2CO 2 + 4e - 2CO 32- (持续补充CO 2气体) 负极:2CO + 2CO 32-─4e - 4CO 2总反应式:2CO + O 2 2CO 215.银锌纽扣电池(碱性介质)正极 (Ag 2O) :Ag 2O + H 2O + 2e - 2Ag + 2OH -负极 (Zn) :Zn + 2OH -─2e - ZnO + H 2O总反应式:Zn + Ag 2O ZnO + 2Ag 电池正极 22244SOCl e Cl S SO --+=++ 负极Li - e- = Li +总反应式:4Li+2SOCl 2 = 4LiCl +S +SO 217..Li-电池r-MnO 2作正极活性材料,电解液是LiClO4正极 Li + + MnO 2 + e- = LiMnO 2负极 Li - e- = Li +总反应式:Li + MnO 2 = LiMnO 2燃料电池(碱性介质)正极:O 2 + 2H 2O + 4e - 4OH -负极:CH 3OH ─6e - + 8OH - CO 32- + 6H 2O总反应式:2CH 3OH + 3O 2 + 4OH - 2CO 32- + 6H 2O19.CH 3OH 燃料电池(酸性介质)正极:O 2 + 4H ++ 4e - 2H 2O负极:CH 3OH ─6e - + H 2O CO 2 + 6H +总反应式:CH 3OH + 2O 2 CO 2 + 2H 2O .燃料电池(碱性介质)正极:O 2 + 2H 2O + 4e - 4OH -负极:C 2H 5OH ─12e - + 16OH - 2CO 32- + 11H 2O总反应式:C 2H 5OH + 3O 2 + 4OH - 2CO 32- + 5H 2O21.氨气-氧气燃料电池(碱性介质)正极: O 2 + 2H 2O + 4e - 4OH -负极: 2NH 3 — 6e - + 6OH - = N 2 +6H 2O总反应式 4NH 3+3O 22N 2+6H 2O ,【电解电极反应式】1.电解CuCl 2溶液阳极:2Cl -─2e - Cl 2↑阴极:Cu 2+ + 2e - Cu总反应式:2Cl - + Cu 2+ Cl 2↑ + Cu2.电解精炼铜阳极(粗铜):Cu ─2e - Cu 2+阴极 (纯铜) :Cu 2+ + 2e - Cu总反应式:3.电镀铜阳极(纯铜):Cu ─2e -Cu 2+阴极(待镀金属,如Fe ):Cu 2+ + 2e -Cu 总反应式:4.电解饱和食盐水阳极:2Cl -─2e - Cl 2↑阴极:2H + + 2e - H 2↑总反应式:2Cl - + 2H 2O H 2↑ + Cl 2↑ + 2OH- 2NaCl + 2H 2O 电解2NaOH + H 2↑+ Cl 2↑7.电解H 2SO 4溶液阳极:4OH -─4e - O 2↑ + 2H 2O 阴极:4H + +4e - 2H 2↑总反应式:2H 2O 2H 2↑ + O 2↑9.电解CuSO 4溶液阳极:4OH -─4e - O 2↑ + 2H 2O 阴极:2Cu 2+ + 4e - 2Cu总反应式:2Cu 2+ + 2H 2O 2Cu + O 2↑ + 4H +10.电解AgNO 3溶液阳极:4OH -─4e - O 2↑ + 2H 2O 阴极:4Ag + + 4e -4Ag总反应式:4Ag + + 2H 2O 4Ag + O 2↑ + 4H +11.铅蓄电池充电阳极:PbSO 4─2e - + 2H 2O PbO 2 + SO 42- + 4H + 阴极:PbSO 4 + 2e - Pb + SO 42-总反应式:2PbSO 4 + 2H 2O Pb + PbO 2 + 4H + + 2SO 42- 12、Fe 3+ + 3H 2O Fe(OH)3(胶体) + 3H +13、【Al 的工业制备—电解熔融的Al 2O 3】电解Na 3AlF 62Al 2O 3 4Al+3O 2↑。
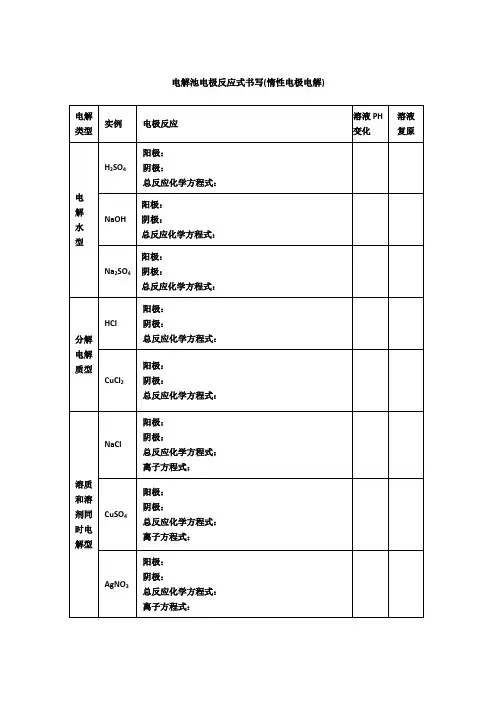
电解池电极反应式书写(惰性电极电解)电解池电极反应式书写(惰性电极电解)电解类型实例电极反应溶液PH变化溶液复原电解水型H2SO 4阳极:4OH ---4e— =O2↑+2H2O阴极:4H+ + 4e—=2H2↑总反应化学方程式:减小H2O NaOH阳极:4OH---4e— =O2↑+2H2O阴极:4H+ + 4e—=2H2↑总反应化学方程式:增大H2O Na2SO4阳极:4OH---4e— =O2↑+2H2O阴极:4H+ + 4e—=2H2↑总反应化学方程式:不变H2O分解电解质型HCl阳极:2Cl-- 2e-= Cl2↑阴极:2H+ + 2e-= H2 ↑化学方程式:减小HCl气体CuCl2阳极:2Cl -- 2e-= Cl2↑阴极:Cu2+ + 2e-= Cu化学方程式:不变加CuCl2固体溶质和溶剂同时电解型NaCl阳极:2Cl-- 2e- = Cl2 ↑阴极:2H+ + 2e-= H2↑化学方程式:2NaCl+2H2O ==== 2NaOH + Cl2↑ + H2 ↑离子方程式:2Cl-+2H2O ==== 2OH-+ Cl2↑ + H2 ↑碱性增强,PH变大HCl气体CuSO4阳极:4OH--4e - = 2H2O + O2 ↑阴极:2Cu2++ 4e- = 2Cu化学方程式:2CuSO4+2H2O==== 2Cu + O2 ↑+ H2SO4离子方程式:2Cu2++2H2O==== 2Cu + O2 ↑+ 4H+酸性增强,PH减小CuO AgNO3阳极:4OH -- 4e- = 2H2O + O2 ↑阴极:4Ag+ + 4e- = 4Ag化学方程式:4AgNO3 + 2H2O ==== 4Ag + O2↑+ 4HNO3离子方程式:4Ag+ + 2H2O ==== 4Ag + O2↑+ 4H+酸性增强,PH减小Ag2O2H2O ==== 2H2↑ + O2↑通电2H2O ==== 2H2↑ + O2↑通电2H2O ==== 2H2↑ + O2↑通电2HCl ==== H2↑ + Cl2↑总反应式:CuCl2 ==== Cu + Cl2↑通电通电通电通电通电通电通电通电。





电解硫酸铜阳极的反应
电解是一种重要的化学反应过程,通过电解可以将化学物质分解成其组成部分。
电解硫酸铜是指在硫酸铜溶液中通电,使其中的铜离子在电解负极还原成纯铜,而在阳极发生氧化反应的过程。
在电解硫酸铜的过程中,阳极上发生的反应是氧化反应。
硫酸铜溶液中的水分子在阳极上发生氧化反应,生成氧气和溶液中的氢离子。
同时,阳极上的铜离子被电解还原成纯铜,从而使溶液中的铜离子浓度减少。
电解硫酸铜的过程可以用化学方程式表示为:
在阳极上的氧化反应,2H2O(l) → O2(g) + 4H+(aq) + 4e-。
在阴极上的还原反应,Cu2+(aq) + 2e→ Cu(s)。
通过电解硫酸铜,可以获得纯度较高的铜,这在工业生产和实验室中都具有重要的应用价值。
同时,电解过程也可以帮助我们更深入地理解化学反应和电化学原理。
总之,电解硫酸铜阳极的反应是一个重要的化学过程,通过这一过程可以获得纯铜并且有助于我们对化学和电化学的理解。
2021年高二人教版化学选修4练习册:4.3.1电解原理溶液的实验探究知识点一电解CuCl21.下列说法错误的是( )A.电解质的导电过程是化学变化,而金属的导电是物理变化B.电解质溶液导电的过程,就是电解质被电解的过程C.电解质在任何条件下均可以导电D.电解质溶液导电过程中一定有新物质生成2.如图4-3-1所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的是图L4-3-1A.锌片是负极B.两个铜片上都发生氧化反应C.石墨是阴极D.两个番茄都形成原电池3.一种充电电池放电时的电极反应为H2+2OH--2e-===2H2O;NiO(OH)+H2O+e-===Ni(OH)2+OH-。
当为电池充电时,与外电源正极连接的电极上发生的反应是() A.H2O的还原B.NiO(OH)的还原C.H2的氧化D.Ni(OH)2的氧化4.如图L4-3-2所示,甲是刚浸过NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现A、B间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的________极,可发现滤纸的B极边沿附近有________色出现。
图L4-3-2知识点二酸、碱、盐溶液的电解规律5.实验室用惰性电极电解氢氧化钠溶液,下列有关描述中正确的是()A.电解时,与电源正极相连的电极上产生H2B.电解时,阳极反应是4OH--4e-===2H2O+O2↑C.在两极上放电的阴、阳离子的物质的量之比为2∶1D.电解过程中,溶液的pH不变6.用石墨作电极,电解1 mol/L下列物质的溶液,则电解前后溶液的pH保持不变的是()A.H2SO4B.NaOH C.Na2SO4D.NaCl7.用铂电极电解下列溶液时,阴极和阳极的主要产物分别为H2和O2的是()A.稀KOH溶液B.HCl溶液C.CuCl2溶液D.酸性AgNO3溶液8.某校“研究性学习小组”欲完成反应2HCl+2Ag===2AgCl+H2↑而设计了下列四个实验,你认为可行的是()图L4-3-39.关于图L4-3-4所示①、②两个装置的叙述,正确的是()图L4-3-4A.装置名称:①是原电池,②是电解池B.硫酸浓度变化:①增大,②减小C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑②中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动10.从NO-3、SO2-4、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
电解cucl2溶液的电极反应式电解CuCl2溶液,阳极C(惰性电极不参与电解),Fe为阴极(阴极一般为阳离子得电子)
就是电解电解质本身(Cu2+>H+;Cl->OH-)
电极反应式:阳极(C):2Cl- - 2e-=Cl2↑
阴极(Fe):Cu2+ + 2e-=Cu
电解方程式为:CuCl2=电解=Cu+Cl2↑
电解时电极产物的判断
①阳极产物的判断
首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电极溶解.
如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能力.阴离子放电顺序如下:
S2->I->Br->Cl->OH->SO42->NO3->F-
②阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+酸>Pb2+>Sn2+>Fe2+>Zn2+>(H+)水>Al3+>Mg2+>Na+>Ca+>K+
电解(Electrolysis)是将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加直流电压时可发生电解过程。
利用在作为电子导体的电极与作为离子导体的电解质
的界面上发生的电化学反应进行化学品的合成高纯物质的制造以及材料表面的处理的过程。
通电时,电解质中的阳离子移向阴极,吸收电子,发生还原作用,生成新物质;电解质中的阴离子移向阳极,放出电子,发生氧化作用,亦生成新物质。
例如电解熔融氯化钠。
高中化学选修四知识点(重要考点)总结!一、原电池(一)概念:化学能转化为电能的装置叫做原电池。
(二)组成条件:1. 两个活泼性不同的电极2. 电解质溶液3. 电极用导线相连并插入电解液构成闭合回路(三)电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
(四)电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑(五)正、负极的判断:1. 从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
2. 从电子的流动方向:负极流入正极3. 从电流方向:正极流入负极4. 根据电解质溶液内离子的移动方向:阳离子流向正极,阴离子流向负极5. 根据实验现象:(1)溶解的一极为负极(2)增重或有气泡一极为正极二、化学电池(一)电池的分类:化学电池、太阳能电池、原子能电池(二)化学电池:借助于化学能直接转变为电能的装置(三)化学电池的分类:一次电池、二次电池、燃料电池1. 一次电池常见一次电池:碱性锌锰电池、锌银电池、锂电池等2. 二次电池(1)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
(2)电极反应:铅蓄电池放电:负极(铅):Pb-2e- =PbSO4↓正极(氧化铅):PbO2+4H++2e- =PbSO4↓+2H2O充电:阴极:PbSO4+2H2O-2e- =PbO2+4H+阳极:PbSO4+2e- =Pb两式可以写成一个可逆反应:PbO2+Pb+2H2SO4 ⇋2PbSO4↓+2H2O(3)目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池3. 燃料电池(1)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池(2)电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。
第五部分离子反应(按字母顺序排列)Al2Al+6H+=2Al3++3H2↑ 2Al+2OH-+2H2O=2+3H2↑Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑Al2O3+6H+=2Al3++3H2O Al(OH)3+3H+=Al3++2H2O AgAg++Cl-=AgCl↓Ag++Br-=AgBr↓Ag++I-=AgI↓ Ag2CO3+2H+=2Ag++CO2↑+H2O Ag3PO4+3H+=3Ag++H3PO4BaBa2++2OH-+CO2=BaCO3↓+H2O BaCO3+2H+=Ca2++CO2↑+H2OBr2Br-+Cl2=2Cl-+Br2 4Br-+2Fe2++3Cl2=2Fe3++2Br2+6Cl-(足量Cl2)2Br-+2Fe2++2Cl2=2Fe3++Br2+4Cl-(当n(FeBr2)/n(Cl2)=1:1时)10Br-+6Fe2++8Cl2=6Fe3++5Br2+16Cl-(当n(FeBr2)/n(Cl2)=3:4时)CCO2+Ba2+ +2OH-=BaCO3↓+H2OCaCa2++2OH-+CO2=CaCO3↓+H2O Ca2++2OH-+SO2=CaSO3↓+H2O Ca2++2ClO-+SO2+H2O=CaSO4↓+HClO+H++Cl-(少量SO2)Ca2+ +2ClO-+CO2+H2O=CaCO3↓+2HClOCaCO3+2H+=Ca2++CO2↑+H2OClCl2+H2O=Cl-+H++HClO Cl2+2OH-=Cl-+ClO-+H2O Cl2+2OH-=Cl-+ClO-+H2O Cl2+2I-=2Cl-+I2Cl2+H2S=2Cl-+2H++S↓Cl2+2Fe2+=2Fe3++2Cl-(向FeBr2溶液中少量Cl2)3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl-(足量Cl2)2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl-(当n(FeBr2)/n(Cl2)=1:1时)8Cl2+6Fe2++10Br-=6Fe3++5Br2+16Cl-(当n(FeBr2)/n(Cl2)=3:4时) Cl2+2I-=2Cl-+I2 Cl2+2I-=I2+2Cl-(向FeI2溶液中通入少量Cl2)3Cl2+2Fe2++4I-=2Fe3++2I2+6Cl-(足量Cl2) 4Cl2+2Fe2++6I-=2Fe3++3I2+8Cl-(当n(FeI2)/n(Cl2)=3:4时)2Cl-+4H++MnO2=Mn2++Cl2↑+2H2O Cl-+Ag+=AgCl↓ ClO-+H+=HClO ClO-+H2OHClO+OH-CrCuCu+2Fe3+=2Fe2++Cu2+Cu2++2Na+2H2O=2Na++Cu(OH)2↓+H2↑ Cu2++H2S=2H++CuS↓ Cu2++Fe=Cu+Fe2+ Cu2++2OH-=Cu(OH)2↓CuO+2H+=Cu2++H2OCxHyOz2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2OFeFe+2H+=Fe2++H2↑ Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+ Fe2++2OH-=Fe(OH)2↓ 2Fe2++Cl2=2Fe3++2Cl-2Fe2++Br2=2Fe3++2Br- 4Fe2++O2+4H+=Fe3++2H2O12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 2Fe2++H2O2+2H+=2Fe3++2H2O Fe2++S2-=FeS↓2Fe2++Cl2=2Fe3++2Cl-(向FeBr2溶液中通入少量Cl2)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-(足量Cl2)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-(当n(FeBr2)/n(Cl2)=1:1时)6Fe2++10Br-+8Cl2=6Fe3++5Br2+16Cl-(当n(FeBr2)/n(Cl2)=3:4时)2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-(向FeI2溶液中足量Cl2)2Fe2++6I-+4Cl2=2Fe3++3I2+8Cl-(当n(FeI2)/n(Cl2)=3:4时)Fe3++3OH-=Fe(OH)3↓2Fe3++Cu=2Fe2++Cu2+ 2Fe3++Fe=3Fe2+ 2Fe3++Zn=2Fe2++Zn2+ 2Fe3++3Zn=2Fe+3Zn2+2Fe3++H2S=2Fe2++S↓+2H+ 2Fe3++S2-=2Fe2++S ↓ 2Fe3++2I-=2Fe2++I2 Fe3++3SCN-=Fe(SCN)3(红色溶液) FeO+2H+=Fe2++H2O Fe2O3+6H+=Fe3++3H2O Fe3O4+8H+=Fe2++2Fe3++4H2O FeS+2H+=Fe2++H2S↑H2OH++OH-=H2O 2H2O+2Na=2Na++2OH-+H2↑ 2H2O+2Na2O2=4Na++4OH-+O2↑ H2O+Na2O=2Na++2OH- H2O+Cl2=Cl-+H++HClOH2O2H2O2+2I-+2H+=I2+2H2O H2O2+2Fe2++2H+=2Fe3++2H2OH2O2+Cl2=2H++2Cl-+O2↑H2CO3系列[要学习网,只做中学生最喜欢、最实用的学习论坛,地址手机版地址]H3PO4系列H2S系列H2S+OH-=HS-+H2OHS-+OH-=S2-+H2O 2H2S+O2=2S↓+2H2O H2S+Cu2+=2H++CuS↓ H2S+(CH3COO)2Pb=PbS↓+2CH3COOHH2S+2OH-=S2-+2H2O 3HS-+Al3++3H2O=Al(OH)3↓+3H2S↑H2SO3系列I2I-+2Fe3+=2Fe2++I2 2I-+Cl2=2Cl-+I2 2I-+Br2=2Br-+I2 I-+Ag+=AgI↓ 2I-+H2O2+2H+=I2+2H2O5I-+IO-+6H+=3I2+3H2O I2+2OH-=I-+IO-+H2OMgMg+2H+=Mg2++H2↑ Mg2++2OH-=Mg(OH)2↓ MgCO3+2H+=Mg2++CO2↑+H2O MgO+2H+=Mg2++H2O Mg(OH)2+2H+=Mg2++2H2OMnMnO2+2Cl-+4H+=Mn2++Cl2↑+2H2ONa2Na+2H2O=2Na++2OH-+H2↑ 2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑NH3系列2AgOH=Ag2O+H2O(AgNO3溶液中加入少量氨水)2NH3·H2O+Ag+=[Ag(NH3)2]++H2O(足量氨水)4NH3·H2O+Cu2+=[Cu(NH3)4]2++4H2O(足量氨水) 4NH3·H2O+Zn2+=[Zn(NH3)4]2++4H2O(足量氨水)[要学习网,只做中学生最喜欢、最实用的学习论坛,地址手机版地址]OO2+2H2S=2S↓+2H2O O2+2S2-+4H+=S↓+2H2OO2+2HS-+2H+=S↓+2H2O O2+4Fe2++4H+=Fe3++2H2O 3O2+12Fe2++6H2O=8Fe3++4Fe(OH)3↓O3+2I-+2H+=I2+O2+H2OPPb2++S2-=PbS↓PbO2+2Cl-+4H+=Pb2++Cl2↑+2H2O (CH3COO)2Pb+H2S=PbS↓+2CH3COOHS3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S↑ S2-+2Fe3+=2Fe2++S↓SO2+Ca2++2ClO-+H2O=CaSO4↓+HClO+H++Cl-(少量SO2)SO2+2H2S=3S↓+2H2OSiZnZn+2H+=Zn2++H2↑Zn+2Fe3+=2Fe2++Zn2+(少量Zn 片) 3Zn+2Fe3+=2Fe+3Zn2+(过量Zn片) Zn2++2OH-=Zn(OH)2↓Zn2++4NH3·H2O=[Zn(NH3)4]2++4H2O(足量氨水)Zn(OH)2+2H+=Zn2++2H2O ZnO+2H+=Zn2++H2O[要学习网,只做中学生最喜欢、最实用的学习论坛,地址手机版地址]第六部分电极反应方程式一、原电池电极反应方程式1.Cu─H2SO4─Zn原电池正极:2H+ + 2e- == H2↑负极:Zn—2e- == Zn2+总反应式:Zn + 2H+ == Zn2+ + H2↑2.Cu─FeCl3─C原电池正极:2Fe3+ + 2e- == 2Fe2+负极:Cu —2e- == Cu2+总反应式:2Fe3+ + Cu == 2Fe2+ + Cu2+ 3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- == 4OH-负极:2Fe— 4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2Fe(OH)2↓4.氢氧燃料电池(中性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O5.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- == 2H2O负极:2H2 — 4e-== 4H+总反应式:2H2 + O2 == 2H2O6.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2 — 4e- + 4OH- == 4H2O总反应式:2H2 + O2 == 2H2O7.铅蓄电池(放电)正极(PbO2) :负极(Pb) :总反应式:8.Al─NaOH─Mg原电池正极:6H2O + 6e- == 3H2 ↑+ 6OH-负极:总反应式:9.CH4燃料电池(碱性介质)正极:2O2 + 4H2O + 8e- == 8OH-负极:总反应式:10.熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料):正极:负极:总反应式:2CO + O2 == 2CO211.银锌纽扣电池(碱性介质)正极(Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH- 负极(Zn) :Zn + 2OH- —2e- == ZnO + H2O总反应式:Zn + Ag2O == ZnO + 2Ag二、电解电极反应方程式1.电解CuCl2溶液阳极:2Cl- — 2e- == Cl2↑阴极:Cu2+ + 2e- == Cu总反应式:2.电解精炼铜阳极(粗铜):Cu —2e- == Cu2+阴极(纯铜) :Cu2+ + 2e- == Cu总反应式:无3.电镀铜阳极(纯铜):Cu— 2e- == Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu总反应式:无4.电解饱和食盐水阳极:2Cl- —2e- == Cl2↑阴极:2H2O + 2e- == H2↑+ 2OH-总反应式:5.电解HCl溶液阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:6.电解NaOH溶液阳极:4OH- —4e- == O2↑+ 2H2O阴极:4H2O + 4e- == 2H2↑+ 4OH-总反应式:7.电解H2SO4溶液阳极:2H2O — 4e- == O2↑+ 4H+阴极:4H+ +4e- == 2H2↑总反应式:8.电解KNO3溶液阳极:2H2O —4e- == O2↑+ 4H+阴极:4H2O + 4e- == 2H2↑+ 4OH-总反应式:9.电解CuSO4溶液阳极:2H2O—4e- == O2↑+ 4H+阴极:2Cu2+ + 4e- == 2Cu↓总反应式:10.电解AgNO3溶液阳极:2H2O— 4e- == O2↑+ 4H+阴极:4Ag+ + 4e- == 4Ag↓总反应式:11.铅蓄电池充电阳极:阴极:总反应式:B2H6(g) + 3O2(g) = B2O3(s) + 3H2O(l);ΔH = - 2165 kJ·mol-1第七部分热反应方程式CC(石墨,s) +O2(g) =CO2(g);ΔH= -393.5kJ·mol -1C(金刚石,s) +O2(g) =CO2(g);ΔH= -395.4kJ·mol -1C(金刚石,s) =C(石墨,s);ΔH= -1.90kJ·mol -1C(s) +H2O(g) =CO(g) +H2(g);ΔH= +131.3kJ·mol -1C(s) +O2(g) =CO2(g);ΔH= -393.5kJ·mol -1CaC2(s) +2H2O(l) =C2H2(g) +Ca(OH)2(s);ΔH= -127kJ·mol -1 CH4(g) +2O2(g) =CO2(g) +2H2O(l);ΔH= -890.3kJ·mol -1C2H4(g) +3O2(g) =2CO2(g) +2H2O(l);ΔH= -1411kJ·mol -1C3H8(g) +5O2(g) =3CO2(g) +4H2O(l);ΔH= -2220.0kJ·mol -1 C2H5OH(l) +3O2(g) =2CO2(g) +3H2O(l);ΔH= -1367kJ·mol -1 C6H12O6(s) +6O2(g)=6CO2(g) +6H2O(l);ΔH= -2800kJ·mol -1 HH2(g) +Cl2(g) =2HCl(g);ΔH= -184.6kJ·mol -12H2(g) +O2(g) =2H2O(g);ΔH= -483.6mol·L -12H2(g) +O2(g) =2H2O(l);ΔH= -571.6kJ·mol -12H2O(g) =2H2(g) +O2(g);ΔH= +483.6kJ·mol -12H2O(l) =2H2(g) +O2(g);ΔH= +571.6kJ·mol -1H2O(l) =H2O(g);ΔH= +44kJ·mol -1H2O(g) =H2O(l);ΔH= -44kJ·mol -1HCl(aq) +NaOH(aq) =NaCl(aq) +H2O(l);ΔH= -57.3kJ·mol -1H +(aq) +OH-(aq) =H2O(l);ΔH= -57.3kJ·mol -1NN2(g) +O2(g)=NO2(g);ΔH= +180.7kJ·mol -12NO(g) +O2(g)=2NO2(g);ΔH= -113kJ·mol -13NO2(g) +H2O(l)=2HNO3(l) +NO(g);ΔH= -136kJ·mol -1.N2H4(g) +O2(g) =N2(g) +2H2O(g);ΔH= -534kJ·mol -1N2H4(l) +2H2O2(l) =N2(g) +4H2O(g);ΔH= -641.6kJ·mol -12N2H4(g) +2NO2(g) =3N2(g) +4H2O(g);ΔH= -1135.7kJ·mol -1.PP4(白磷,s) =4P(红磷,s);ΔH= -66.8kJ·mol -1.SSO3(g) +H2O(l) =H2SO4(l);ΔH= -130.3kJ·mol -1。