原子半径1分类
- 格式:ppt
- 大小:2.11 MB
- 文档页数:52

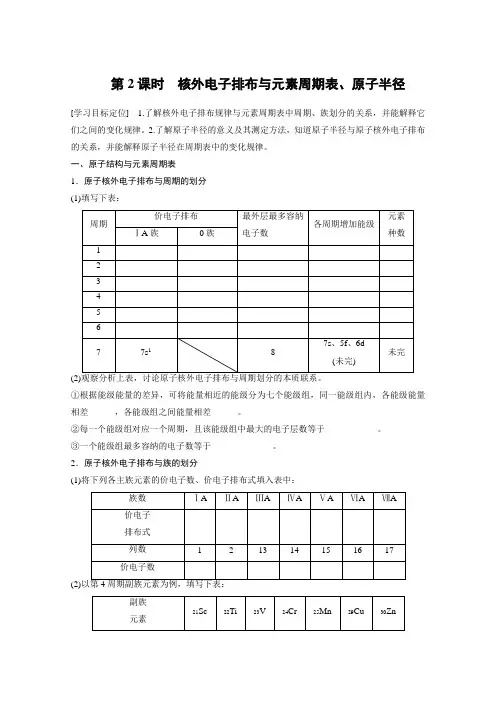
第2课时核外电子排布与元素周期表、原子半径[学习目标定位] 1.了解核外电子排布规律与元素周期表中周期、族划分的关系,并能解释它们之间的变化规律。
2.了解原子半径的意义及其测定方法,知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。
一、原子结构与元素周期表1.原子核外电子排布与周期的划分(1)填写下表:①根据能级能量的差异,可将能量相近的能级分为七个能级组,同一能级组内,各能级能量相差______,各能级组之间能量相差______。
②每一个能级组对应一个周期,且该能级组中最大的电子层数等于____________。
③一个能级组最多容纳的电子数等于______________。
2.原子核外电子排布与族的划分(1)将下列各主族元素的价电子数、价电子排布式填入表中:(2)(3)族的划分依据与原子的__________和__________密切相关。
①同主族元素原子的价电子排布______,价电子全部排布在最外层的________________轨道上。
族序数与价电子数______。
②稀有气体的价电子排布为__________________。
③过渡元素(副族和Ⅷ族)同一纵行原子的价电子排布基本相同。
价电子排布式为___________________________,ⅢB~ⅦB族的族序数与价电子数______,第ⅠB、ⅡB族的族序数=______轨道上的电子数,第Ⅷ族的价电子数分别为8、9、10。
3.原子核外电子排布与区的划分1.(1)周期序数=电子层数;(2)周期元素数目=相应能级组最多容纳的电子数。
2.原子核外电子排布与族的关系族序数由该元素原子的价电子数决定。
(1)主族(ⅠA~ⅦA)的族序数=价电子数=原子最外层电子数。
(2)0族:原子最外层电子数等于8或2。
(3)ⅠB、ⅡB族:族序数=原子最外层电子数。
(4)ⅢB~ⅦB族:族序数=价电子数=原子最外层n s电子数+次外层(n-1)d电子数=最高正价。

促敦市安顿阳光实验学校第2课时核外电子排布与元素周期表、原子半径1.认识核外电子排布与元素周期表的关系,了解元素周期表中各区、周期、族的划分依据。
2.了解原子结构与原子半径周期性变化的联系。
核外电子排布与元素周期表1.核外电子排布与周期划分的本质联系(1)周期与能级组、原子轨道的对关系(2)规律①7个能级组对7个周期。
②周期序数=□1________________。
③本周期所包含元素种数=对能级组所含原子轨道数的2倍=对能级组最多容纳的电子数。
2.核外电子排布与族的划分(1)划分依据:取决于原子的□2________和价电子排布。
(2)规律①主族元素②过渡元素③稀有气体→价电子排布:□9______(□10________除外)3.元素周期表的分区(1)根据核外电子排布根据核外电子排布,可把周期表里的元素划分成5个区:s区、p区、d区、ds区和f区。
除ds区外,区的名称来自最后填入电子的能级的符号。
(2)根据元素金属性与非金属性4.金属元素与非金属元素在元素周期表中的位置(1)金属元素和非金属元素的线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
(2)处于d区、ds区和f区的元素是金属元素。
s区的元素除氢、氦外,也是金属元素。
自我校对:□1最外层电子所在轨道的主量子数□2价电子数目□3n s1~2□4n s2n p1~6周期序数对能级组原子轨道数最多容纳电子数价电子排布式元素种数ⅠA族0族1 1s 12 1s11s2 22 2s2p 4 8 2s12s22p683 3s3p4 8 3s13s23p684 4s3d4p 9 18 4s14s24p6185 5s4d5p 9 18 5s15s25p6186 6s4f5d6p 16 32 6s16s26p6327 7s5f6d7p 16 32 7s1-不完全□5价电子数□6(n-1)d1~10n s0~2□7价电子数□8n s电子数□9n s2n p6□10He 1.判断正误(1)元素周期表中每一周期主族元素最外层电子都是由1个逐渐增加到8个。


一.原子的构成与排布构成:(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
(3)原子序数=核电核数=质子数=核外电子数(4)质量数(A)=质子数(Z)+中子数(N)(5)在化学上,我们用符号AZX来表示一个质量数为A,质子数为Z的具体的X原子。
排布:1.在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。
2.电子总是尽先排布在能量最低的电子层里。
3.核外电子的排布规律(1)各电子层最多容纳的电子数是2n2(n表示电子层)(2)最外层电子数不超过8个(K层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
(3)核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
总结:电子层 1 2 3 4 n电子层符号 K L M N ……离核距离近远电子的能量低高最多能容纳的电子数 2 8 18 32 2n2二.构成原子或离子的各基本粒子间的数量关系1.质子数 + 中子数 = 质量数 = 原子的近似相对原子质量2.原子的核外电子数 = 核内质子数 = 核电荷数3.阳离子核外电子数 = 核内质子数–电荷数4.阴离子核外电子数 = 核内质子数 + 电荷数5.核外电子数相同的粒子规律(1)与He原子电子层结构相同的离子有(2电子结构):H-、Li+、Be2+(2)与Ne原子电子层结构相同的离子有(10电子结构):阴离子有F-、O2-、N3-、OH-、NH2-;阳离子有Na+、Mg2+、Al3+、NH4+、H3O+;分子有Ne、HF、H2O、NH3、CH4(3)与Ar原子电子层结构相同的离子有(18电子结构):阴离子有P3-、S2-、Cl-、HS-;阳离子有K+、Ca2+;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4三.元素,核素与同位素(1)元素:具有相同核电荷数(质子数)的同一类原子的总称。

![化学元素周期表读音_规律_口诀[1]](https://uimg.taocdn.com/b5c4aa5e852458fb770b5625.webp)
化学元素周期表读音1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài)23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo)46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán)58铈(shì)59镨(pǔ)60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè)66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū)70镱(yì)71镥(lǔ)72铪(hā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(tā)82铅(qiān)83铋(bì)84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā)90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná)94钚(bù)95镅(méi)96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104钅卢(lú)105钅杜(dù)106钅喜(xǐ)107钅波(bō)108钅黑(hēi)109钅麦(mài)110钅达(dá)111钅仑(lún)口诀A、按周期分:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。

元素原子半径表元素的原子半径是描述原子尺寸大小的重要参数之一,它反映了原子中电子云分布的情况,也可以用来推测物质的结构和性质。
在化学领域,了解各个元素的原子半径对于理解元素之间的化学结合、晶体结构等方面具有重要意义。
本文将介绍一些常见元素的原子半径,并且列出它们在晶体结构中的应用。
氢(H)氢是最简单的元素,其原子半径约为25 pm。
在晶体结构中,氢原子通常是以离子的形式存在,如在氢键中。
氦(He)氦的原子半径约为31 pm,是惰性气体中原子半径最小的元素之一,由于其具有完整的电子外层,很少参与化学反应。
氧(O)氧的原子半径约为60 pm,氧是地球上最丰富的元素之一,它在大气中占据重要位置,并且在许多氧化物中广泛存在。
氟(F)氟的原子半径约为72 pm,是一种高度反应性的元素,常见于氟化合物中,在生物体系中具有重要的生物学作用。
钠(Na)钠的原子半径约为154 pm,是一种常见的金属元素,具有较低的密度和较低的熔点,常用于制备各种合金。
氯(Cl)氯的原子半径约为99 pm,是一种重要的卤素元素,广泛用于消毒、制备有机化合物等领域。
铜(Cu)铜的原子半径约为128 pm,是一种重要的过渡金属元素,具有良好的导电性和热导性,在工业和电子领域有广泛的应用。
锌(Zn)锌的原子半径约为133 pm,在锌的晶体结构中,锌通常呈四键结构存在,具有良好的耐腐蚀性。
银(Ag)银的原子半径约为144 pm,是一种重要的贵金属元素,具有良好的导电性和抗菌性,在珠宝和货币制造等领域有广泛应用。
碘(I)碘的原子半径约为133 pm,是一种卤素元素,具有紫色气味刺激性的性质,在药物制备和染料工业有重要应用。
以上便是一些常见元素的原子半径及其在晶体结构中的应用。
随着科学技术的发展,人们对元素的了解不断深入,元素原子半径表也在不断完善和更新,为科学研究和工程应用提供了重要参考依据。


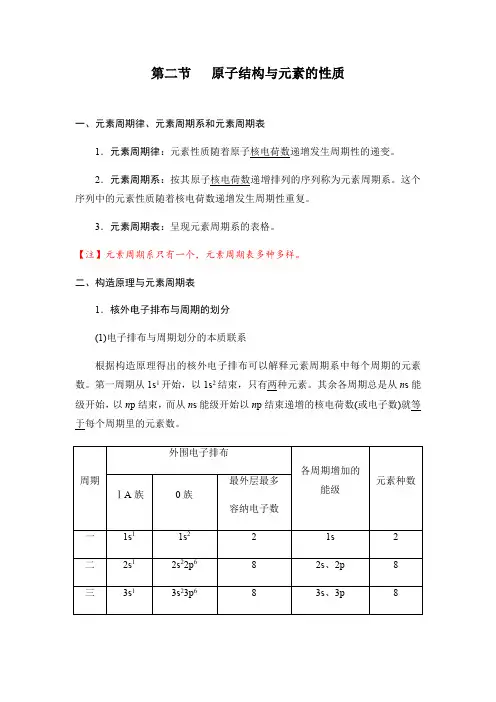
第二节原子结构与元素的性质一、元素周期律、元素周期系和元素周期表1.元素周期律:元素性质随着原子核电荷数递增发生周期性的递变。
2.元素周期系:按其原子核电荷数递增排列的序列称为元素周期系。
这个序列中的元素性质随着核电荷数递增发生周期性重复。
3.元素周期表:呈现元素周期系的表格。
【注】元素周期系只有一个,元素周期表多种多样。
二、构造原理与元素周期表1.核外电子排布与周期的划分(1)电子排布与周期划分的本质联系根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。
第一周期从1s1开始,以1s2结束,只有两种元素。
其余各周期总是从n s能级开始,以n p结束,而从n s能级开始以n p结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
(2)规律:①周期序数=电子层数。
②本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分(1)划分依据:取决于原子的价电子数目和价层电子排布。
(2)特点:同族元素的价电子数目和价层电子排布相同。
(3)规律①对主族元素,同主族元素原子的价层电子排布完全相同,价层电子全部排布在n s 或n s 、n p 轨道上(见下表)。
价层电子数 = 族序数。
③稀有气体元素:价电子排布为n s2n p6(He除外)。
三、元素周期表1.元素周期表的结构2.元素周期表的分区(1)根据核外电子排布根据核外电子排布式中最后填入电子的能级符号可把周期表里的元素划分成4个区:s区、p区、d区和f区(除ΙB、ⅡB族外。
)(2)根据元素金属性与非金属性①金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
②处于d区、ds区和f区的元素全部是金属元素。
s区的元素除氢外,也全部是金属元素。
【注】p区元素价电子不都是n s2n p1~6,如He元素的价电子为2s2。
co原子半径一、什么是CO分子?CO是一种化学式为CO的分子,它由一个碳原子和一个氧原子组成。
这种分子在自然界中非常普遍,可以在大气中、燃烧产物中、生物体内等多个环境中被发现。
二、CO分子的性质1. 物理性质CO分子是一种无色、无味的气体,在常温常压下为不易液化的气体。
它比空气轻,密度约为0.97 g/L。
2. 化学性质CO分子具有很强的还原性,能够与氧气反应生成二氧化碳。
此外,它还可以与金属形成金属卡宾配合物,在有机合成反应中扮演重要角色。
三、什么是原子半径?原子半径指的是一个原子的半径大小。
由于原子并不是一个完美球形,所以其半径大小并不十分明确。
通常情况下,我们使用几何平均值来描述一个原子的大小。
四、CO分子的原子半径1. 碳原子半径碳原子是CO分子中较大的那个原子,其几何平均值约为0.077 nm。
2. 氧原子半径氧原子是CO分子中较小的那个原子,其几何平均值约为0.066 nm。
3. CO分子的分子半径由于CO分子是由碳原子和氧原子组成的,因此其分子半径应该介于碳原子半径和氧原子半径之间。
根据几何平均值计算,CO分子的分子半径约为0.072 nm。
五、影响CO分子原子半径的因素1. 化学键类型CO分子中碳原子与氧原子之间形成了三重键,这种化学键比单重键和双重键更紧密,因此碳原子和氧原子之间的距离更短,对应的几何平均值也更小。
2. 分析方法不同的实验方法会导致不同的结果。
例如,X射线衍射法和电镜技术都可以用来测量物质中各个元素之间的距离和大小,但它们所得到的结果可能会有所不同。
3. 环境条件温度、压力等环境条件也会影响CO分子中碳原子和氧原子之间的距离和大小。
在高温高压下,化学键会变得更加松散,导致分子半径增大。
六、CO分子原子半径的应用CO分子的原子半径可以用于计算化学键能和电荷密度等参数。
此外,它还可以用于研究CO分子在不同环境下的行为,例如在大气中的传输和反应,以及在生物体内的代谢过程等。
同一周期原子半径大小如何判断在化学中,原子半径是一个重要的物理性质,它决定了原子在化学反应和结构中的行为。
在同一周期内,原子的半径大小会受到原子核电荷数和电子排布等因素的影响。
在判断同一周期内原子半径大小的问题上,我们可以通过以下几个方法进行分析和比较。
原子序数大小在同一周期内,原子序数越大,原子半径越小。
这是因为同一周期内,原子核电荷数增加,电子云受到更强的吸引力,进而导致原子半径减小。
因此,通过比较原子的原子序数大小可以初步判断其原子半径的大小顺序。
电子排布原子的电子排布方式也会对原子半径大小产生影响。
在同一周期内,如果元素的电子排布更接近稳定的电子排布方式(如惰性气体的电子排布方式),那么其原子半径可能会相对较大。
因为电子排布更接近稳定状态时,电子云可能会更多地分布在外层轨道上,从而增大原子的半径。
原子核电荷数原子核电荷数的增加会使得电子受到更强的吸引力,从而使得原子半径减小。
因此,在同一周期内,如果元素的原子核电荷数更大,那么其原子半径可能较小。
通过比较元素的原子核电荷数,可以初步推测其原子半径大小的顺序。
结合离子半径当元素形成离子时,离子半径也会有所改变。
通常情况下,正离子的半径比原子小,而负离子的半径比原子大。
因此,通过比较元素形成的正负离子的半径大小,也可以间接地推测同一周期内原子半径的大小关系。
综上所述,要判断同一周期内原子的半径大小,可以通过比较原子序数大小、电子排布方式、原子核电荷数以及结合离子半径等因素来进行分析和推测。
通过综合考虑这些因素,我们可以较为准确地判断同一周期内原子半径的相对大小,达到更深入地理解元素性质的目的。