2氨基硫脲的合成
- 格式:pdf
- 大小:241.90 KB
- 文档页数:4

1,3-二氨基硫脲的制备
盛梅;蒋燕清;陆峥伟
【期刊名称】《常州大学学报(自然科学版)》
【年(卷),期】2004(016)001
【摘要】以水合肼和二硫化碳为原料合成了1,3-二氨基硫脲(简称TCH).确定了合成中间体HDTC的最适宜工艺条件为水合肼∶CS2=2.2∶1(物质的量比)、温度20 ℃、反应时间45 min.重点对HDTC分解生成最终产物TCH的工艺进行了改进,结果表明:当HDTC分解反应在水合肼溶液中进行,并加入适量的抑制剂,不仅可使反应时间从20 h缩短至8 h,而且第一步反应结束后不必除去过量的水合肼即可进行第二步反应, TCH的产率接近90%.
【总页数】5页(P35-39)
【作者】盛梅;蒋燕清;陆峥伟
【作者单位】江苏工业学院,精细石油化工重点实验室,江苏,常州,213016;江苏工业学院,精细石油化工重点实验室,江苏,常州,213016;江苏工业学院,精细石油化工重点实验室,江苏,常州,213016
【正文语种】中文
【中图分类】O623.54+2
【相关文献】
1.2-烯丙基-1,3-二苯基-1,3-丙二酮的制备工艺条件的优化 [J], 叶紫君;王意婷;徐存进
2.基于双PMBP缩1,3-二氨基硫脲希夫碱电化学传感器的研究 [J], 曹小红;刘云海;马建国
3.1,3-二氨基硫脲对粟酒裂殖酵母细胞作用的热动力学研究 [J], 蒋建宏;肖圣雄;王艳兰;向珂;胡钞粟;刘莉;肖碧源;周菊峰;李强国
4.双链梯形聚(1,3-二甲基-1,3-二氧二硅氧烷)的制备 [J], 贾修伟;容敏智;章明秋
5.1,3-二氨基硫脲合成新工艺放大试验研究 [J], 孙晓红;刘源发
因版权原因,仅展示原文概要,查看原文内容请购买。

1,3-二氨基硫脲的制备
1,3-二氨基硫脲是一种常见的重要有机分子,它的制备在合成有机物的领域中占有重要的位置。
本文将介绍1,3-二氨基硫脲的常规制备方法。
1,3-二氨基硫脲一般可以通过由氨和硫化钠在水热中进行反应而得到。
实验首先用氨水和硫化钠(约等份)混合溶解在水中,其次加入硼砂溶液搅拌均匀,温度稳定在100-120℃之间,经一定时间(通常搅拌4-5小时),开始产生1,3-二氨基硫脲。
反应结束时,外加少量冷却剂,常温下结晶沉淀即可分离出1,3-二氨基硫脲晶体。
此外,1,3-二氨基硫脲还可以用其他方法制备,如熔渣法、vilsmeier-haack反应、液体氮法和乙醇酸法等。
对于那些不耐受温度高的有机物质,也可以采用低温法制备1,3-二氨基硫脲。
总之,通过本文的介绍,我们可以了解1,3-二氨基硫脲是一种重要的有机分子,熔渣法、vilsmeier-haack反应、液体氮法和乙醇酸法等均可用于它的制备,其中以水热方法制备1,3-二氨基硫脲最为常见和适用。

氨基硫脲的合成及其对阴离子识别作用研究
2-氨基硫脲是一种重要的有机化合物,在药物合成和生物化学研究中都扮演着重要的角色。
2-氨基硫脲是一种碱性有机化合物,它可以与各种阴离子结合,通过识别阴离子
来调节生物体内各种化学反应,用于药物设计,成为一种新型的药物。
2-氨基硫脲的合成方法有多种,其中最常用的是硫氰酸酯的水解反应。
该反应以硫氰酸酯为原料,经过水解反应,可以生成2-氨基硫脲。
此外,还可以利用硝酸钠、氨水和硫酸钠反应来合成2-氨基硫脲,也可以用硫酸钠、氨水和硝酸钠反应来合成2-氨基硫脲。
2-氨基硫脲具有较强的阴离子识别作用,它可以与许多阴离子结合,如氯离子、硫酸根离子、氨基离子等,能够极其有效地调节生物体内的各种生化反应,并在药物设计中发挥重要作用。
例如,2-氨基硫脲可以与蛋白质结合,形成一种类似药物的结构,可以与酶或受体结合,从而抑制酶和受体的活性;它还可以形成非常稳定的结合体,可以被用来靶向某些特定的细胞。
因此,2-氨基硫脲可以用来设计新型药物,具有针对性、有效性和
安全性。
通过以上介绍可以看出,2-氨基硫脲在药物合成和生物化学研究中都起着重要作用,其强大的阴离子识别作用使其成为一种新型的药物设计利器,为药物研究提供了新的思路。


2-氨基-1,3,4-噻二唑(敌枯唑)的合成[实验原理]2-氨基-1,3,4-噻二唑通常采用甲酸作原料,以盐酸作催化剂一步法合成 [反应式]NH 2NHCNH 2 + HCOOHSNH 2N N SNH 2HClN OHN N S NH 2S[试剂]硫代氨基脲2.3g(0.052mol),甲酸1.4g ,浓盐酸2.5mL ,氢氧化钠溶液(572g/L) [实验步骤]1.向50mL 三口圆底烧瓶中加入2.3克(0.025mol )氨基硫脲、1.4克(0.03 mol )甲酸及2.5 mL (0.052mol )36%浓盐酸(质量分数),摇匀加沸石。
2.安装回流装置及尾气接收装置,NaOH 水溶液吸收盐酸尾气及温度计。
接通冷凝水,在电热套上缓慢加热至80℃,搅拌反应2h 。
继续升温至反应物沸腾回流,反应3 h 后,观察现象变化。
3.反应液冷至室温,用14.3mL(572g/L) NaOH 水溶液调节至pH 到9-10,冰水冷却结晶。
抽滤得初产物。
4.用10-15 mL 水对初产品进行重结晶(包括热过滤和冷却结晶)。
最后得到白色晶体。
红外灯烘干。
计算产率。
5.用显微熔点仪测量所得晶体熔点,判断晶体纯度。
文献值:190-192 o C6.所得样品做红外光谱测试,核磁共振谱测试。
(文献值:IR:3315.41; 3295.90; 3098.90; 1615.93; 1504.76; 1336.12; 684.45 .13C NMR:142.489;168.132) [思考题]该反应的成环机理是怎样的? 成环机理:NH 2SC H 2N N SHH N HC OH --H 2O H N N SNH 2HCl[拓展]目前,2-氨基-1,3,4-噻二唑通常采用甲酸作原料,以盐酸作催化剂一步法合成(乐长高,丁健桦,杨思金.5-烷基-2-氨基-1,3,4-噻二唑的合成及应用[J].化学世界,2002,7:366-368),这种合成方法简单易行,但甲酸通常为液态水溶液,酸性、腐蚀性很强,又有难闻的刺激气味,在工业生产过程中不便运输保存,并且生产废料不利于回收利用.06年郑浩,董慧民等人在河南师范大学学报上发表了一篇关于2-氨基-1,3,4-噻二唑合成新方法。

![氨基硫脲和甲、氨基硫脲的制备方法[发明专利]](https://uimg.taocdn.com/4dd89ef6cc7931b764ce158d.webp)
专利名称:氨基硫脲和甲、氨基硫脲的制备方法专利类型:发明专利
发明人:傅德才,王志辉,史兰香,周鸿娟,刘世军申请号:CN96114284.7
申请日:19961227
公开号:CN1186069A
公开日:
19980701
专利内容由知识产权出版社提供
摘要:本发明涉及氨基硫脲和甲、氨基硫脲的制备方法。
本发明使用硫酸肼或水合肼及硫酸甲基肼,以及硫氰酸碱金属盐或硫氰酸铵盐为原料,利用溶剂法或固相法直接合成。
其原理是依据肼或甲基肼与硫氰酸成盐后,在加热的条件下可以转化成氨基硫脲或甲、氨基硫脲。
本发明的优点是工艺简单,易于操作,收率较高。
并且固相法还具有不用有机溶剂,减少污染等优点。
申请人:傅德才,王志辉
地址:050018 河北省石家庄市富强大街副一号3栋2单元702室
国籍:CN
代理机构:河北省专利事务所
代理人:陈建民
更多信息请下载全文后查看。

一种合成硫脲的方法是硫脲是一种重要的有机化合物,广泛应用于农药、医药、染料和胶粘剂等领域。
在工业生产中,合成硫脲的方法有很多,其中一种常用的方法是通过氨水和硫代硫酸钠反应合成。
材料准备为了合成硫脲,我们需要准备以下材料:1. 硫代硫酸钠:作为反应的硫源,一般可在化工原料市场购买得到。
2. 氨水:用于供应氨基,也可在化工原料市场购买。
实验步骤1. 量取一定量的硫代硫酸钠,加入到适量的水中,并充分搅拌溶解。
这个步骤可以在室温下进行。
2. 在搅拌的同时,将适量的氨水缓慢加入到溶液中。
注意要保持适当的搅拌速度,以确保反应充分进行。
3. 反应进行一段时间后,溶液会变得浑浊,并产生白色沉淀。
这是硫脲的生成产物。
4. 将反应过程中生成的硫脲沉淀过滤出来,并用冷水洗涤干净。
5. 最后,将硫脲沉淀放置在通风处,静置一段时间,使其干燥。
注意事项在进行以上实验操作时,需要注意以下几点:1. 在实验过程中,应该佩戴适当的防护措施,如实验室手套和眼镜,以防止对皮肤和眼睛的损伤。
2. 氨水是一种腐蚀性较强的化学品,使用时要小心操作,避免直接接触皮肤和吸入其气体。
3. 在进行搅拌和加入氨水的过程中,要注意控制反应温度,避免剧烈的剧烈剧烈生成。
4. 在过滤沉淀时,可以使用玻璃纤维滤纸或滤纸,将硫脲沉淀分离出来。
结论通过以上步骤,我们成功地合成了硫脲。
合成的硫脲可以用于农药和医药领域的研究和生产中,具有重要的应用价值。
在合成硫脲的过程中,我们需要注意安全使用化学试剂,并掌握好实验的操作技巧,以确保实验的顺利进行。
此外,我们还可以对合成方法进行改进和优化,以提高合成效率和产品质量。

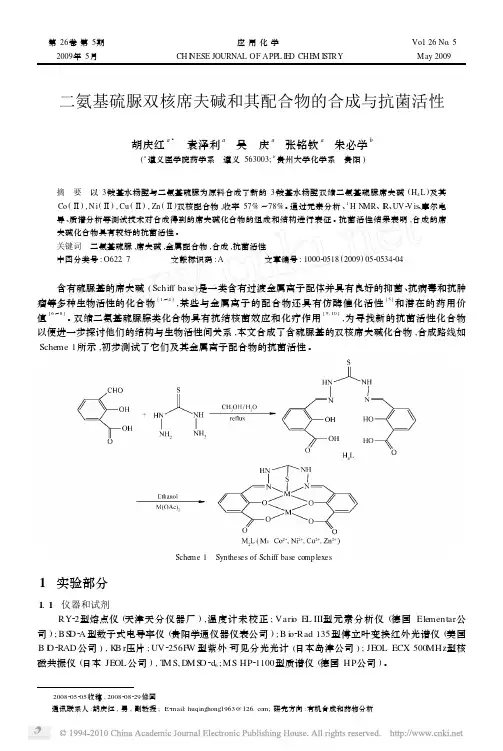
二氨基硫脲双核席夫碱和其配合物的合成与抗菌活性胡庆红a3 袁泽利a 吴 庆a 张铭钦a 朱必学b(a遵义医学院药学系 遵义563003;b贵州大学化学系 贵阳)摘 要 以32羧基水杨醛与二氨基硫脲为原料合成了新的32羧基水杨醛双缩二氨基硫脲席夫碱(H4L)及其Co(Ⅱ),N i(Ⅱ),Cu(Ⅱ),Zn(Ⅱ)双核配合物,收率57%~78%。
通过元素分析、1H NMR、I R、UV2V is、摩尔电导、质谱分析等测试技术对合成得到的席夫碱化合物的组成和结构进行表征。
抗菌活性结果表明,合成的席夫碱化合物具有较好的抗菌活性。
关键词 二氨基硫脲,席夫碱,金属配合物,合成,抗菌活性中图分类号:O622.7 文献标识码:A 文章编号:100020518(2009)05205342042008205205收稿,2008208229修回通讯联系人:胡庆红,男,副教授;E2mail:huqinghong1963@;研究方向:有机合成和药物分析含有硫脲基的席夫碱(Schiff base)是一类含有过渡金属离子配体并具有良好的抑菌、抗病毒和抗肿瘤等多种生物活性的化合物[1~4],某些与金属离子的配合物还具有仿酶催化活性[5]和潜在的药用价值[6~8]。
双缩二氨基硫脲腙类化合物具有抗结核菌效应和化疗作用[9,10],为寻找新的抗菌活性化合物以便进一步探讨他们的结构与生物活性间关系,本文合成了含硫脲基的双核席夫碱化合物,合成路线如Sche me1所示,初步测试了它们及其金属离子配合物的抗菌活性。
Sche me1 Syntheses of Schiff base comp lexes1 实验部分1.1 仪器和试剂RY22型熔点仪(天津天分仪器厂),温度计未校正;Vari o EL III型元素分析仪(德国Ele mentar公司);BS D2A型数子式电导率仪(贵阳学通仪器仪表公司);B i o2Rad135型傅立叶变换红外光谱仪(美国B I O2RAD公司),K B r压片;UV2256F W型紫外2可见分光光计(日本岛津公司);JEOL ECX500MHz型核磁共振仪(日本JEOL公司),T MS,DMS O2d6;MS HP21100型质谱仪(德国HP公司)。

制备氨基硫脲的方法
制备氨基硫脲的方法
氨基硫脲是一种具有许多不同用途的烃类化合物。
它也被称为三甲基硫脲,广泛用于医药、农药、氯丁橡胶等领域.
氨基硫脲的合成方法有多种,这里介绍一种简单实用的合成方法——基于三甲基硫酰氯和三甲基胺的反应。
首先,将三甲基硫酰氯加入实验室烧杯中,用三甲基胺混合溶液,浓度为90%,温度保持在室温。
接着,使用中性条件,将三甲基硫酰胺煮沸一段时间(4分钟),冷却到室温,开始搅拌,直到搅拌液完全混合,即可得到氨基硫脲溶液。
为了将氨基硫脲从溶液中分离出来,可以将溶液置于0℃冰水中冷却,当溶液变得浑浊时,就可以将氨基硫脲从溶液中沉淀出来,即成功地分离出氨基硫脲。
之后,再将氨基硫脲置于干燥剂中,反复融化和滴萃,使其完全干燥,得到氨基硫脲的固体样品。
总之,基于三甲基硫酰氯和三甲基胺的反应,是一种简单实用的氨基硫脲合成方法,它可以得到纯度较高的氨基硫脲分离物,满足生产要求。
单缩和双缩二氨基硫脲类化合物的合成与表征单缩和双缩二氨基硫脲类化合物是一类重要的含硫杂环化合物,具有广泛的应用价值。
本文将从合成与表征两个方面介绍这类化合物的相关知识。
一、合成1、单缩二氨基硫脲类化合物的合成以单缩二氨基硫脲为例,通常采用氯乙酸和硫脲反应得到,反应中采用异丙醇作溶剂,反应温度在80℃左右。
反应结束后用水将沉淀洗涤干净即可。
反应方程式如下所示:ClCH2COOH + NH2CSNH2 → NH2CSNHCCH2Cl + H2O2、双缩二氨基硫脲类化合物的合成以1,4-二叔丁基-2,3,5,6-四氮杂环己烷-7,8-二酮和硫脲为原料反应,采用二甲苯作溶剂,反应温度为130℃,反应时间为48小时,反应结束后用冷水将沉淀冲洗干净并晾干,得到产物。
反应方程式如下所示:H2NCSNH2 + 1,4-C8H12N4O2 → 1,4-C8H10N4O2S + 2H2O二、表征化合物单缩二氨基硫脲类和双缩二氨基硫脲类都是白色结晶粉末,可以通过一系列实验手段对化合物进行表征。
1、红外光谱从红外光谱中,我们可以获得物质在红外辐射下的吸收信息,明确取样品的基团和它们之间的键。
单缩二氨基硫脲类和双缩二氨基硫脲类都展现出较为特征的吸收峰,在1590-1660 cm-1处为C-N的拉曼标记,而在1180-1360 cm-1处为S-N单键的振动模.Gua.如果出现2900-2980 cm-1处的吸收峰,表示有C-H键的拉曼标记。
2、核磁共振核磁共振可以分析分子的结构,检测化合物中氢和碳的个数、位置和类型。
对于单缩二氨基硫脲或双缩二氨基硫脲类,核磁共振可以明确它们的结构。
3、元素分析元素分析可以获得化合物中各元素的相对含量和相对分子量,及其氧化还原数。
总之,单缩和双缩二氨基硫脲类化合物的合成与表征都是研究该类化合物的重要步骤,只有了解它们的物理化学性质,才能更好地应用于实际生产中。
第1篇一、引言硫脲作为一种重要的有机化工原料,广泛应用于医药、农药、染料、塑料等领域。
硫脲的合成方法主要有氨法、硫磺法、硫化氢法等。
本文将对硫脲的合成方法进行总结,并对各种方法的优缺点进行分析。
二、硫脲的合成方法1. 氨法氨法是硫脲合成的主要方法之一,其原理是氨和硫磺在高温、高压条件下反应生成硫脲。
反应方程式如下:2NH3 + S → (NH2)2S(1)反应条件氨法合成硫脲的反应条件如下:- 反应温度:250-300℃;- 反应压力:1.5-2.0MPa;- 反应时间:1-2小时。
(2)反应过程氨法合成硫脲的过程如下:- 将氨和硫磺按照一定比例混合,送入反应器;- 在反应器内,氨和硫磺在高温、高压条件下反应,生成硫脲;- 反应产物经过冷却、过滤、洗涤、干燥等工序,得到硫脲。
(3)优缺点氨法合成硫脲的优点:- 反应条件温和,易于控制;- 产品质量稳定,纯度高;- 生产成本低。
氨法合成硫脲的缺点:- 反应时间较长;- 需要高压设备,设备投资较大;- 对环境有一定的污染。
2. 硫磺法硫磺法是另一种常见的硫脲合成方法,其原理是硫磺和氢气在高温、高压条件下反应生成硫脲。
反应方程式如下:2H2 + S → (NH2)2S(1)反应条件硫磺法合成硫脲的反应条件如下:- 反应温度:300-400℃;- 反应压力:1.5-2.0MPa;- 反应时间:1-2小时。
(2)反应过程硫磺法合成硫脲的过程如下:- 将硫磺和氢气按照一定比例混合,送入反应器;- 在反应器内,硫磺和氢气在高温、高压条件下反应,生成硫脲;- 反应产物经过冷却、过滤、洗涤、干燥等工序,得到硫脲。
(3)优缺点硫磺法合成硫脲的优点:- 反应条件较为温和,易于控制;- 产品质量稳定,纯度高;- 生产成本低。
硫磺法合成硫脲的缺点:- 反应时间较长;- 需要高压设备,设备投资较大;- 对环境有一定的污染。
3. 硫化氢法硫化氢法是硫脲合成的一种较新方法,其原理是硫化氢和氨在高温、高压条件下反应生成硫脲。
化学通报990311
Page 1 of 4
化学通报
CHEMISTRY 1999年 第3期 No.3 1999
1,3-二氨基硫脲的合成研究
孙晓红 关键词 二氨基硫脲 合成 催化 刘源发
1,3-二氨基硫脲(简称TCH)是一种重要的有机合成中间体,在一些杂环类医药、 农药的合成中有广泛的用途,同时它的一些金属衍生物也具有较大的应用价值。
关于 其合成方法文献已有报道[1],且一直受到研究工作者的重视。
在几种不同的合成方 法中,通常采用的是以二硫化碳和水合肼为原料,经两步反应制得TCH,以反应式表示 如下:
从原料来源及工艺条件来看,这是一条合理的工艺路线,二硫化碳与水合肼在较 低温度下反应,先生成二硫代肼基甲酸钅 井(简称HDTC),后者经加热分解,放出硫 化氢,冷却后过滤,即可得到TCH。
但此种方法早期文献报道收率一般低于70%[2,3], 如加热温度控制不当,反应剧烈,难以控制,TCH的收率会更低,且不安全,目前国内 有关生产厂家仍采用此工艺路线。
后有一些文献报道了有关此方法的改进研究,发现 过量的水合肼存在可提高收率[4],加入水及一些低烷基醇有利于反应进行,但并不 增加反应收率;一些胺或强碱如四亚甲基二胺、氢氧化钠存在下可增加TCH的收率 [5];在巯基乙醇存在下,二硫化碳与过量水合肼反应不仅可提高收率,同时可减少 副产物生成,可使水合肼循环套用次数增加,TCH的平均收率~90%[6]。
但是以上方 法存在反应时间过长,一般需20h左右及催化剂巯基乙醇价格贵,来源困难的问题。
我们在文献[6]的基础上,对此方法进行了改进研究,研究成功以氯乙醇等卤代 醇代替巯基乙醇,并适当提高脱硫化氢的反应温度,使反应时间大为缩短,在10h以内 即可完成反应,过量的水合肼可循环套用的工艺条件,TCH的收率一般均在90%以上。
1 实验部分
1.1 主要原料及规格 二硫化碳,化学纯; 80%水合肼,化学纯; 2-氯乙醇,分析纯; 1,3-氯-2丙醇,自制; 巯基乙醇,化学纯。
1.2 实验步骤 1.2.1 操作方法 在装有搅拌器、温度计、滴液漏斗及冷凝器(上口连有尾气导出管) 的四口烧瓶中加入80%水合肼3mol及适量水,2-氯乙醇12g,冰水浴冷却至15℃左右, 搅拌下滴加二硫化碳1mol,约1h加完,然后在室温下搅拌30min,此时有黄色结晶HDTC 析出。
加入6g氢氧化钠,加热升温并控制反应温度在75~85℃之间反应10h,所放出的 硫化氢气体经导气管用稀氢氧化钠吸收。
冷却至室温,过滤析出的白色颗粒状TCH。
用 150mL甲醇洗涤,干燥,得产物重97.5g,收率92%。
将过滤所得母液及甲醇洗涤液合并,加入反应瓶,搅拌下于15℃左右,30min之 内,滴加0.52mol二硫化碳,继续在此温度下反应1h。
冷却至0℃,30min后,过滤析出 /web/chemistry/2000//col/1999/hxtb/hxtb9903/... 2011-10-27
化学通报990311
Page 2 of 4
的HDTC。
另取80%水合肼2mol及8g 2-氯乙醇加入四口反应瓶中,于15℃左右,30min之内滴 加二硫化碳0.5mol,加完后再搅拌30min,然后加热升温并加入上述所得到的湿的HDTC 至75~85℃反应10h。
冷却至室温,过滤所得的TCH,用甲醇洗涤,得TCH干重96.2g, 收率90.8%,母液循环套用。
1.2.2 测试结果 TCH为白色或淡黄色颗粒状结晶,m p171~172℃(文献报道值 [1]:171℃) 元素分析结果:S% C% H% N% 计算值: 30.19 11.32 5.66 52.83 分析值: 30.09 11.31 5.70 52.87
2 结果与讨论
从二硫化碳与水合肼反应生成TCH的反应式可知,反应实际上是经过以下三个步骤 完成的:
因此,二硫化碳与水合肼的投料比至少应该是1∶2(摩尔比),而且水合肼的投料量增 加应该有利于反应进行,这不仅有利于二硫化碳与水合肼反应生成的肼基二硫代甲酸 在足够量的水合肼溶液中相互作用生成肼基二硫代甲酸钅 井(HDTC),保证○ A 、 ○ B 两步反应的充分进行,同时如文献[5]所述,胺或碱(B)(包括过量肼)的存 在,反应可按下式进行:
当B为水合肼时,只存在后两步反应。
胺或过量水合肼的作用是接收反应生成的 H2S,有利于钅 井盐分解脱去H2S,以加快反应速度,提高收率。
通过对二硫化碳与水合肼不同投料比的试验,结果表明,二硫化碳与水合肼的摩 尔比为1∶3为佳。
采用2-氯乙醇和一些卤代醇以替代文献[6]报道的巯基乙醇作为催化剂,经试验 证明是完全可行的,实验结果见表1。
这应该是在HDTC脱H2S过程中,反应介质中存在 着的H2S在氢氧化钠存在下有下列反应发生
生成巯基乙醇。
/web/chemistry/2000//col/1999/hxtb/hxtb9903/... 2011-10-27
化学通报990311 表1 催化剂种类 TCH收率% 不同催化剂对TCH收率的影响 巯基乙醇 90.5 2-氯乙醇 1,3-二氯-2-丙醇 0.2 91.8 0.1 91.4 0.15 92.4 0.2 0.15 92.1 90.8
Page 3 of 4
催化剂用量mol 0.15
投料:CS 1.0mol; 反应时间 10h;反应温度 80±5℃ 从上表可见,不同的催化剂收率相当,考虑2-氯乙醇原料易得,且价格便宜, 因而采用2-氯乙醇为好。
在实验中发现,二硫化碳∶水合肼=1∶3(摩尔比)投料比情况下,不同温度和 反应时间对TCH的收率均有影响,其中反应温度对收率的影响较为显著;同时发现 HDTC的脱H2S反应,在反应温度低于60℃时已开始,升高温度可加快脱H2S反应的进 行,反应温度在70℃左右时有70%左右的脱H2S反应可在5h内完成,但其余未反应的 HDTC仍需在较长的时间内完成脱H2S生成TCH。
为保证不致于由于反应温度过高,脱 H\-2S反应过于剧烈而引起冲料、分解等现象,同时提高反应温度又可加速反应速 度以缩短反应时间,经条件试验,确定反应温度80±5℃,反应时间10h为佳。
试验结果所选择的较佳反应条件为: 投料比 二硫化碳∶水合肼=1∶3(摩尔比);反应温度 75~85℃;反应时间 10h;脱H2S催化剂 2-氯乙醇,用量0.15mol/CS2mol. 以所选用的较佳合成条件进行了水合肼循环套用试验,实验结果见表2,投料 0.5mol CS2,十次循环实验,1,3-二氨基硫脲的平均收率>90%(以CS2计)。
表2 母液循环次数 TCH得量g TCH收率% 0 1 循环套用实验结果 2 3 4 5 6 7 8 9
48.8 48.1 48.7 48.3 48.4 48.4 48.0 48.7 47.9 48.2 92 90.8 91.8 91.1 91.4 91.4 90.5 91.8 90.4 91.0
注释:陕西省教育委员会重点资助项目 作者简介:孙晓红 女,39岁,高级工程师,从事有机合成以及精细化工产品的开 发研究。
作者单位:(陕西省化学研究所 西安 710069)(西北大学农药研究与开发中心 西安 710069)
参考文献
[1]Audrieth L F, Scott Earle S, Kippur Perry S. Hydrazine Derivatives of the Carbonic and Thiocarbonic Acids 1 The Preparation and Properties of Thiocarbohydrazide. . Chem. 1954,19(2):733~741. [2]Audrieth Ludwig F, Kippur Perry R. U.S., US 2,726,263.1955. [3]Burns G R. Metetal Complexes of Thiocarbohydrazide Inorg. Chem. 1968,7(2):277~282. [4]Malone James R.U.S., US 4,172,092.1979. [5]Jackman Dennis E, Comds Gary W, Westphal Dietmar B, et al. U.S., US 4,946,995. 1990. [6]Jackman Dennis E, Comds Gary W, Westphal Dietmar B, et al. U.S., US 4.943,660.1990. 1997-12-30收稿,1998-03-20修回
/web/chemistry/2000//col/1999/hxtb/hxtb9903/... 2011-10-27
化学通报990311 Mirror Site in USA Europe China CSTNet ChinaNet
Page 4 of 4
/web/chemistry/2000//col/1999/hxtb/hxtb9903/... 2011-10-27
。