盐酸、硫酸的性质比较
- 格式:ppt
- 大小:366.50 KB
- 文档页数:12



解。
几乎所有的硫化物也都可被硝酸溶解,但应先加入盐酸,使硫以H2S的形式挥发出去,以免单质硫将试样裹包,影响分解。
③硫酸(H2SO4)除钙、锶、钡、铅外,其它金属的硫酸盐都溶于水。
热的浓硫酸具有很强的氧化性和脱水性,常用于分解铁、钴、镍等金属和铝、铍、锑、锰、钍、铀、钛等金属合金以及分解土壤等样品中的有机物等。
硫酸的沸点较高(338℃),当硝酸、盐酸、氢氟酸等低沸点酸的阴离子对测定有干扰时,常加硫酸并蒸发至冒白烟(SO3)来驱除。
硫酸能将物质里的H、O元素以2:1脱去。
④磷酸(H3PO4)磷酸根具有很强的配位能力,因此,几乎90%的矿石都能溶于磷酸。
包括许多其它酸不溶的铬铁矿、钛铁矿、铌铁矿、金红石等,对于含有高碳、高铬、高钨的合金也能很好的溶解。
单独使用磷酸溶解时,一般应控制在500~600℃、5min以内。
若温度过高、时间过长,会析出焦磷酸盐难溶物、生成聚硅磷酸粘结于器皿底部,同时也腐蚀了玻璃。
⑤高氯酸(HClO4)热的、浓高氯酸具有很强的氧化性,能迅速溶解钢铁和各种铝合金。
能将Cr、V、S等元素氧化成最高价态。
高氯酸的沸点为203℃,蒸发至冒烟时,可驱除低沸点的酸,残渣易性质:仅知存在于某些溶剂中。
很不稳定,45℃分解,很易快速分解为硫酸、硫、硫化氢、多硫化氢和二氧化硫(混合物)。
硫代硫酸可看成是硫酸分子中的一个氧原子被硫原子所代替的产物。
两个硫原子的平均氧化数为+2。
其中一个硫原子氧化数为+6,另一个硫原子氧化数为-2,因此硫代硫酸及其盐类具有一定的还原性。
硫代硫酸根酸离子在碱性条件下很稳定,有很强的络合能力。
硫代硫酸可在低温(-78℃)下,在乙醚等有机溶剂(-78℃)或无溶剂(10℃以下)中用干燥的氯化氢处理(酸化)无水硫代硫酸钠而得(不能在水溶液中!);或者在0℃和无水条件下,在乙醚中使三氯化硫与硫化氢反应而制得。
由于它很不稳定,故仅用其盐。
主要用作还原剂、定影剂和络合剂等。
对于初中生,只要求掌握盐酸、硝酸、硫酸的一些简单的化学性质,比如酸的通性:使紫色石蕊试液变红、能和碱生成盐和水、能和碱性氧化物生成盐和水。
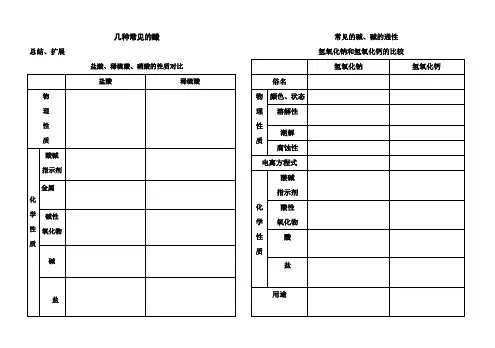
几种常见的酸
总结、扩展
盐酸、稀硫酸、硝酸的性质对比
常见的碱、碱的通性氢氧化钠和氢氧化钙的比较
常见的盐小结:
酸、碱、盐化学性质汇总(列举出相关化学方程式)
一、酸的化学性质
1、酸与指示剂的反应
2、酸与活泼金属的反应
3、酸与碱性氧化物的反应
4、酸与碱的反应
5、酸与盐的反应
二、碱的化学性质
1、碱与指示剂的反应
2、碱与酸性氧化物的反应
3、碱与酸的反应
4、碱与盐反应
三、盐的化学性质
1、盐与金属的反应
2、盐与酸的反应
3、盐与碱的反应
4、盐与盐的反应。

盐酸和硫酸的性质比较盐酸(HCl)和硫酸(H2SO4)是两种常见的无机酸,它们在化学实验室和工业生产中广泛应用。
尽管它们都是酸,但它们在性质上有一些明显的区别。
本文将比较盐酸和硫酸的性质,从而更好地了解它们的应用和特点。
一、化学结构盐酸的分子式为HCl,是一种单质化合物。
它由氢原子和氯原子组成,其中氯原子与氢原子形成共价键。
硫酸的分子式为H2SO4,是一种复合化合物。
它由氢原子、硫原子和氧原子组成,其中硫原子与氢原子形成离子键,氧原子与硫原子形成共价键。
二、物理性质1. 盐酸是一种无色无味的液体,有强烈刺激性气味。
它可以溶于水并迅速与水反应,放出大量热量。
2. 硫酸是一种无色至浅黄色的液体,有浓烈的刺激性气味。
它也可以溶于水,并且与水反应,释放出大量热量。
三、酸性1. 盐酸是一种强酸,可以完全解离成H+离子和Cl-离子。
溶液的pH值通常小于1,是一种较为浓烈的酸性溶液。
2. 硫酸也是一种强酸,可以完全解离成2H+离子和SO4^2-离子。
溶液的pH值通常小于1,也是一种较为浓烈的酸性溶液。
四、化学反应1. 盐酸与碱反应会产生盐和水,例如与氢氧化钠反应生成氯化钠和水。
反应示意为:HCl + NaOH -> NaCl + H2O。
2. 硫酸与碱反应也会产生盐和水,例如与氢氧化钠反应生成硫酸钠和水。
反应示意为:H2SO4 + 2NaOH -> Na2SO4 + 2H2O。
五、腐蚀性1. 盐酸具有较强的腐蚀性,能够腐蚀金属并与许多物质反应。
因此在使用和储存时需要格外小心。
2. 硫酸的腐蚀性更强,可以腐蚀许多有机物和无机物,包括金属。
与盐酸相比,硫酸在储存和使用时需要更加谨慎。
综上所述,盐酸和硫酸在化学结构、物理性质、酸性、化学反应以及腐蚀性等方面存在一些差异。
了解这些差异有助于我们更好地理解它们的特点和应用。
在实验室和工业上使用这两种酸时,必须谨慎操作,遵守安全操作规程,以免对身体和环境造成危害。

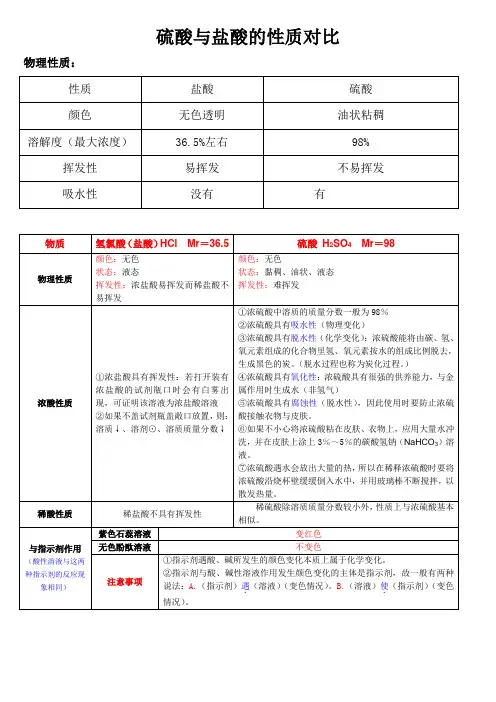
硫酸与盐酸的性质对比物理性质:42HCl化学性质:1.稀盐酸,稀硫酸具有酸的通性:①能和指示剂反应。
(使紫色石蕊试液变红,使酚酞不变色)②能和活泼金属反应(排在H前的金属,如铁,锌,镁,铝)对应训练1:实验室制取氢气,为什么一般选用锌和稀盐酸(或稀硫酸),而不用铁,也不用铝?③能和碱反应,生成盐和水。
(即中和反应)注意:生成盐和水的反应不一定都是中和反应。
例如:2NaOH+CO2 = Na2CO3+H2O④能和碱性氧化反应。
例如:CaO+2HCl = CaCl2+H2O⑤能和某些盐反应。
如:H2SO4+BaCl2 =BaSO4↓+2HCl(注意:该反应是复分解反应,反应物要可溶,生成物要有沉淀,气体或水,这三种物质中的其中一种)2.浓硫酸的浓度最高可达98%,所以此时浓硫酸具有它独特的性质。
①强氧化性。
②脱水性。
如何稀释浓硫酸?为什么不能将水倒入浓硫酸中?为什么要用玻璃棒不断搅拌呢?1.下列说法不正确的是()A.稀硫酸能和铁反应B.稀硫酸具有挥发性C.稀盐酸不能使酚酞试剂变红色D.浓盐酸放在空气中浓度会变低2.下列化学方程式书写正确的是()A. 2Fe +3 H2SO4 = Fe2(SO4)3 +3H2↑B. 2HCl + BaO =BaCl2 +H2OC. HCl + AgNO3 =AgCl +HNO3D.NaOH + CaCl2 =Ca(OH)2+ NaCl3.我们已经学过,实验室制取二氧化碳用石灰石和稀硫酸反应。
实验的反应方程式为:CaCO3+ 2HCl = CaCl2+ H20+ CO2↑请问:(1)能否用浓盐酸代替稀盐酸?————————————————————————————(2)请问稀硫酸能和石灰石反应吗?若能,写出化学方程式,若不能,请说明理由。
———————————————————(3)请问能用稀硫酸和石灰石制取二氧化碳吗?。

盐酸和硫酸的比较盐酸(Hydrochloric acid)和硫酸(Sulfuric acid)作为常见的无机酸,在实际应用中具有广泛的用途。
本文将对盐酸和硫酸的性质、用途及其比较进行论述。
一、性质比较盐酸和硫酸都是无色透明液体,在常温下呈强酸性。
它们的酸性是由于溶解在水中后释放出H+(氢离子)所致。
1. 盐酸:盐酸的化学式为HCl,在水中充分离解,并释放出氯离子(Cl-)。
盐酸具有刺激性气味,可溶于水和一些有机溶剂。
它具有较强的酸性和腐蚀性,可以与金属反应生成相应的盐和释放出氢气。
2. 硫酸:硫酸的化学式为H2SO4,它是一种具有很强酸性的无机酸。
在水中可以完全解离,产生两个H+(氢离子)和一个SO4^-2(硫酸根离子)。
硫酸是一种无色的油状液体,具有高黏度和吸湿性。
二、用途比较1. 盐酸的用途:盐酸作为一种重要的化学原料和试剂,在许多领域具有广泛的用途。
它可用于金属表面的清洗、废水的中和处理、皮革加工、食品工业、医药行业以及矿物冶金方面的应用。
盐酸还可以被用作实验室中的试剂和酸碱滴定的指示剂。
2. 硫酸的用途:硫酸是一种常用的化工原料,在工业生产和实验室中被广泛使用。
它可以用于制造肥料、染料、炸药、合成橡胶、玻璃纤维等化学产品。
此外,硫酸还可用作蓄电池的电解液和金属表面的腐蚀防护。
三、盐酸与硫酸的比较1. 酸性强度:硫酸比盐酸酸性更强,这是因为硫酸的离子解离程度更高。
在酸解离常数的比较中,硫酸的酸解离常数高于盐酸。
2. 腐蚀性:硫酸的腐蚀性较盐酸更强。
硫酸具有强烈的腐蚀性,可以与许多金属发生反应,甚至可以溶解一些金属。
而盐酸的腐蚀性相对较弱,对大部分金属并不具有明显的腐蚀作用。
3. 用量和价格:由于硫酸的酸性更强,相对来说使用硫酸所需的用量会少于盐酸。
然而,硫酸的制备成本较高,所以在市场价格上通常会比盐酸更昂贵。
总结:综合来看,盐酸和硫酸都是重要的无机酸,具有广泛的应用。
盐酸在实际应用中主要用于清洗、中和、皮革加工等领域,而硫酸则更常用于肥料、染料、炸药等化工生产中。


盐酸和硫酸的临界量概述及解释说明1. 引言1.1 概述盐酸和硫酸是常见的无机化合物,在工业生产、实验室研究以及日常生活中都有广泛的应用。
对于这两种酸来说,进行浓度调节是非常重要的,因为过高或过低的浓度可能会导致不良影响甚至危险。
1.2 文章结构本文将首先介绍盐酸的临界量相关知识,包括其特性、溶液浓度关系以及临界量的定义和计算方法。
接下来将对硫酸的临界量进行讨论,包括硫酸的性质特点、溶液浓度变化规律以及相关研究和数据统计。
最后,文章将比较分析盐酸和硫酸的临界量方面的异同,并回顾实验方法和数据,以得出结论并展望未来研究方向。
1.3 目的本文旨在通过系统性地探讨盐酸和硫酸在不同条件下达到临界点所需达到的浓度水平,从而为科学家、工程师和化学从业者提供关于这两种酸使用中合适浓度范围的重要参考。
同时,通过对比分析盐酸和硫酸的临界量,可以深入了解它们在化学结构和实验条件上的异同,进而为合理选择酸的使用方式和优化工艺提供有价值的信息。
2. 盐酸的临界量2.1 盐酸的特性盐酸是一种无机强酸,化学式为HCl。
它通常以溶液形式存在,具有刺激性气味和腐蚀性。
盐酸在水中极易溶解,并且能够与许多金属产生反应,生成相应的盐和氢气。
2.2 盐酸与溶液浓度关系盐酸的浓度可以通过计算在单位体积中含有多少盐酸分子来确定。
浓度越高,每单位体积中所含的盐酸分子数量就越多。
常用的表达方法是以百分数或摩尔浓度(mol/L)表示。
2.3 盐酸的临界量定义与计算方法盐酸的临界量是指在某一条件下使得反应发生明显变化的最小剂量。
该值可以用于评估各种反应过程中需要添加到体系中的最低可引起变化的盐酸量。
要计算盐酸的临界量,首先需要明确所研究对象和实验条件。
随后可以根据实验数据进行统计分析并建立相关模型或公式,从而得出临界量的估算值。
常见的计算方法包括利用化学反应速率方程和浓度变化规律,以及基于实验结果的统计方法。
在研究盐酸临界量时,还可考虑其他因素,例如温度、压力和溶液pH值等。

盐酸是氯化氢气体的水溶液纯净的浓盐酸是无色透明的液体,有刺激性气味,在空气是易挥发形成酸雾。
工业用的浓盐酸因含有铁离子(Fe3+)而显现黄色回顾我们学过的不同离子的颜色铜离子显蓝色、亚铁离子显浅绿色。
二、盐酸的化学性质盐酸可以使紫色石蕊变红,盐酸不能使无色酚酞变色盐酸与镁反应Mg + 2HCl == MgCl2 + H2↑盐酸与铁反应Fe + 2HCl == FeCl2 + H2↑(1)盐酸与氧化铁反应实验现象:红色的氧化铁逐渐消失,溶液由无色变成黄色。
反应的化学方程式:Fe2O3 + 6HCl == 2FeCl3 + 3H2O此反应常用于除铁锈(2)盐酸与氧化铜反应实验现象:黑色的氧化铜逐渐消失,溶液由无色变成蓝色。
反应的化学方程式:CuO + 2HCl == CuCl2 + 2H2O(1)盐酸与氢氧化钠反应反应的化学方程式:HCl + NaOH == NaCl + H2O(2)盐酸与氢氧化钙反应反应的化学方程式:2HCl + Ca(OH)2 == CaCl2 + 2H2O分析:在中和反应中酸碱指示剂所起的作用(1)指示反应的发生(2)判断反应的终点(1)盐酸与硝酸银反应实验现象:生成难溶于水且难溶于酸的白色沉淀反应的化学方程式:HCl + AgNO3 == AgCl↓ + HNO3(2)盐酸与碳酸钙、碳酸钠反应盐酸与碳酸钙反应的化学方程式:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑盐酸与碳酸钠反应的化学方程式:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑盐酸是__________气体的水溶液纯净的浓盐酸是无色透明的液体,有__________气味,在空气是__________形成酸雾。
工业用的浓盐酸因含有铁离子(Fe3+)而显现________回顾我们学过的不同离子的颜色铜离子显_______、亚铁离子显__________。
二、盐酸的化学性质盐酸可以使紫色石蕊变____________,盐酸不能使无色酚酞变色盐酸与镁反应______________________________________盐酸与铁反应_______________________________________(1)盐酸与氧化铁反应实验现象:红色的氧化铁逐渐消失,溶液由无色变成黄色。
盐酸、硫酸、环戊烷、间⼆甲苯、天然⽓、压缩空⽓等理化特性表表2.4-5 硫酸理化性质标识中⽂名:硫酸英⽂名:sulfuric acid 分⼦式:H2SO4分⼦量:98.08 CAS号:7664-93-9 危规号:81007 UN编号:1830 危险性类别:第8.1类酸性腐蚀品化学类别:硫酸理化性质外观和性状:纯品为⽆⾊透明油状液体,⽆臭。
相对密度(⽔=1):1.83,相对密度(空⽓=1):3.4,熔点:10.5℃;沸点:330℃;饱和蒸⽓压(kPa):0.13(145.8℃)溶解性:与⽔混溶。
主要⽤途:⽤于⽣产化学肥料,在化⼯、医药、⽯油提炼等⼯业也有⼴泛的应⽤。
燃烧爆炸危险性燃烧性:不燃闪点(℃):⽆意义爆炸下限(%):⽆意义爆炸上限(%):⽆意义引燃温度(℃):⽆意义最⼩点⽕能(mj):⽆意义最⼤爆炸压⼒(Mpa):⽆意义危险特性:遇⽔⼤量放热,可发⽣沸溅。
与易燃物(如苯)和可燃物(如糖、纤维素等)接触会发⽣剧烈反应,甚⾄引起燃烧。
遇电⽯、⾼氯酸盐、雷酸盐、硝酸盐、苦味酸盐、⾦属粉末等猛烈反应,发⽣爆炸或燃烧。
有强烈的腐蚀性和吸⽔性。
灭⽕⽅法:消防⼈员必须穿全⾝耐酸碱消防服。
灭⽕剂:⼲粉、⼆氧化碳、砂⼟。
避免⽔流冲击物品,以免遇⽔会放出⼤量热量发⽣喷溅⽽灼伤⽪肤。
包装与储运包装分类:Ⅰ包装标志:20包装⽅法:螺纹⼝或磨砂⼝玻璃瓶外⽊板箱;耐酸坛、陶瓷罐外⽊板箱或半花格箱。
储运注意事项:储存于阴凉、⼲燥、通风良好的仓库内。
应与易燃物或可燃物、碱类、⾦属粉末等分开存放。
不可混储混运。
搬运时要轻装轻卸,防⽌包装及容器损坏。
分装和搬运作业要注意个⼈防护。
毒性危害中国MAC:2mg/m3前苏联MAC:1mg/m3美国TVL-TWA:ACGIH 1mg/m3美国TLV-STEL:ACGIH 3mg/m3侵⼊途径:吸⼊、⾷⼊急性毒性:LD50:2140mg/kg(⼤⿏经⼝)LC50 510mg/m3 ,2⼩时(⼤⿏吸⼊)320mg/m3,2⼩时(⼩⿏吸⼊)健康危害:对⽪肤、粘膜等组织有强烈的刺激和腐蚀作⽤。
鉴别稀硫酸和稀盐酸的方法
稀硫酸和稀盐酸都是常见的无机酸,但它们的化学性质有所不同,因此可以通过一些简单的方法来鉴别它们。
在下面的文章中,我们将介绍鉴别稀硫酸和稀盐酸的方法。
1. 用BaCl2溶液检验
将一小滴稀硫酸滴在一滴BaCl2溶液上,观察是否会产生白色的BaSO4沉淀。
如果出现白色沉淀,则说明这个液体是硫酸。
2. 将铜结算
将一小片铜片放在管子里,加入少量液体,观察铜片是否变黑。
如果铜片变黑,则说明这个液体是硫酸,因为硫酸可以与铜反应生成CuSO4。
3. 使用菜叶检验
将一片菜叶蘸上液体,再加入几滴浓盐酸。
如果菜叶变成了黄色,说明这个液体是硫酸。
1. 使用银镜反应
将一滴液体混合在AgNO3溶液中,并且添加几滴NaOH溶液。
如果会在溶液中形成黑色的沉淀,则说明这个液体是盐酸。
这是因为NaOH和AgNO3溶液中的剩余离子反应生成白色的Ag2O沉淀。
Ag2O和盐酸反应生成黑色的Ag沉淀。
2. 使用苯酚红指示剂
将几滴苯酚红指示剂滴在液体中,如果液体变成了黄色,则说明这个液体是盐酸。
这是因为盐酸是一种酸性液体,能够使苯酚红指示剂变成黄色。
将液体倒入试管中,并且小心地嗅一下它的气味。
如果气味有刺激性,则说明这个液体是盐酸。
这是因为盐酸是一种有刺激性的气味。
综上所述,鉴别稀硫酸和稀盐酸的方法有很多,但这里介绍的方法都是常见的方法。
通过这些方法,我们可以轻松地鉴别出它们。
另外要注意的是,这些实验都涉及到化学试剂,初学者一定要小心操作,保证实验的安全。
盐酸、硫酸储存使用的安全管理上海国清生物科技有限公司盐酸、硫酸储存使用的安全管理一、目的及适用范围1。
目的:规范盐酸、硫酸的储存使用管理,消除各类事故隐患.2.适用范围:与盐酸、硫酸有关的各个部门和环节.二、盐酸、硫酸的理化性质1.盐酸的理化性质中文名称: 盐酸英文名称: Hydrochoric acid;Chorohydric acid别名: 氢氯酸分子式:HCl 分子量: 36。
46 熔点:—114。
8℃沸点:—84。
4℃相对密度(水=1):1.20;溶解性:与水混溶,溶于碱液稳定性:稳定外观与性状:无色或微黄色发烟液体,有刺鼻的酸味危险标记:酸性腐蚀品对环境的影响: 健康危害对人体危害:接触其蒸气或烟雾,可引起急性中毒,出现眼结膜炎,鼻及口腔粘膜有烧灼感,鼻衄、齿龈出血,气管炎等。
误服可引起消化道灼伤、溃疡形成,有可能引起胃穿孔、腹膜炎等。
眼和皮肤接触可致灼伤。
慢性影响:长期接触,引起慢性鼻炎、慢性支气管炎、牙齿酸蚀症及皮肤损害。
2。
硫酸的理化性质中文名称:硫酸英文名称:sulfuric acid 分子式:H2SO4分子量:98.08熔点(℃):10。
5 沸点(℃):330相对密度(水=1):1。
83 (空气=1):3。
4 溶解性:与水混溶外观与性状:纯品为无色透明油状液体,无臭,具有强氧化性、脱水性、强酸腐蚀性。
危险标记:酸性腐蚀品对环境的影响: 健康危害对人体危害:对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。
蒸气或烟雾可引起结膜炎、结膜水肿、角膜混浊,以致失明;引起呼吸道刺激,重者发生呼吸困难和肺水肿;高浓度引起喉痉挛或声门水中而窒息死亡。
误服后引起消化道烧伤以致溃疡形成;严重者可能有胃穿孔、腹膜炎、肾损害、休克等.皮肤灼伤轻者出现红斑、重者形成溃疡,愈后癍痕收缩影响功能。
溅入眼内可造成灼伤,甚至角膜穿孔、全眼炎以致失明.慢性影响:牙齿酸蚀症、慢性支气管炎、肺气肿和肺硬化.三、管理原则1。