水化学成分组成
- 格式:ppt
- 大小:4.46 MB
- 文档页数:32

第三章地下水中的无机化学成分地下水是一种复杂的溶液,地下水中含有70多种元素,地下水中的无机化学成分,按其存在形式和数量可分为四组:(1)大量组分一般含量大于100mg/L,主要是常规的离子形式,Cl-、SO2-4、HCO-3、CO3-、Na+、K+、Ca2+、Mg2+等,另外H+、、NH4+、NO2-、NO3-、H3SiO4-Fe3+、Fe2+等也列入大量组分。
大量组分决定水化学类型。
(2)微量组分一般含量小于10mg/L,常见的是Br、I、F、B 、Mo 、Li 、Cu、Pb 、Zn、P、As、Sr、Ba 、Ni 、Co等数十种。
微量组分不决定水化学类型。
(3)放射性组分U 、Th、Ra、Rn等。
(4)气体组分N2、O2、CO2、CH4、H2S、H2等。
第一节地下水中的大量组分一、氯离子(Cl-)1、迁移性能Cl-具有很强的迁移性能,其原因有三个方面:(1)不形成难溶化合物,Cl-离子与水中大量组分的阳离子(K、Na、Ca、Mg)所形成的化合物溶解很大,例如,30o C时,CaCl2=1020mg/L,NaCl=361.5mg/L,MgCl2=553mg/L。
(2)不被胶体所吸附。
(3)不被生物所吸附。
2、分布规律地下水中的Cl-含量从几mg/L至100mg/L以上均有。
地下水中的Cl-含量随地下水矿化度的增高而增高。
在高矿化度水中,占阴离子首位,形成氯化物水。
3、来源主要有三个方面:(1)有机来源:三废水、化肥、农药、动物及人类的排泄物。
(2)无机来源:盐矿、含盐的沉积物、岩浆岩中含Cl矿物、火山喷出物等。
(3)大气降水:二、硫酸根(SO42-)1、迁移性能迁移性能较强,仅次于Cl -。
SO 42-的迁移性能受下列四个因素控制: (1)水中SO 42-易与Ca 2+、Ba 2+、Sr 2+等离子形成难溶盐。
(2)热带潮湿地区土壤中的Fe(OH)2-、Al(OH)22+胶体可以吸附SO 42-。



地球上水的化学性质人所共知,养鱼(虾)就是养水。
现连载一些关于水的文章,希望对大家有帮助。
地球上水的化学性质一、天然水的化学成分天然水经常与大气、土壤,岩石及生物体接触,在运动过程中,把大气、土壤、岩石中的许多物质溶解或挟持,使其共同参与了水分循环,成为一个极其复杂的体系。
目前各种水体里已发现80多种元素。
天然水中各种物质按性质通常分为三大类:1)悬浮物质粒径大于100纳米(10-7米)的物质颗粒,在水中呈悬浮状态,例如泥沙、粘土、藻类、细菌等不溶物质。
悬浮物的存在使天然水有颜色、变浑浊或产生异味。
有的细菌可致病。
2)胶体物质粒径为100—1纳米的多分子聚合体,为水中的胶体物质。
其中无机胶体主要是次生粘土矿物和各种含水氧化物。
有机胶体主要是腐殖酸。
3)溶解物质粒径小于1纳米的物质,在水中成分子或离子的溶解状态,包括各种盐类、气体和某些有机化合物。
天然水中形成各种盐类的主要离子是K+、Na+、Ca2+、Mg2+四种阳离子还有Fe、Mn、Cu、F、Ni、P、I等重金属、稀有金属、卤素和放射性元素等微量元素;水中溶解的气体有O2、CO2、N2,特殊条件下也有H2S、CH4等。
总之,无论哪种天然水,八种主要离子的含量都占溶解质总量的95—99%以上。
天然水中各种元素的离子、分子与化合物的总量称为矿化度。
各种溶解质在天然水中的累积和转化,是天然水的矿化过程。
二、天然水的矿化过程地壳中含有87种化学元素,目前在天然水中基本都已发现。
这些元素在天然水中的含量与岩石圈的平均组成相差很大。
多种化合物溶于水,又随着水文循环一起迁移,经历着不同环境,其数量、组成及存在形态都在不断变化。
这个过程受到两方面因素的制约:一是元素和化合物的物理化学性质;二是各种环境因素,如天然水的酸碱性质、氧化还原状况、有机质的数量与组成,以及各种自然环境条件等。
天然水的主要矿化作用如下:1)溶滤作用土壤和岩石中某些成分进入水中的过程称溶滤作用。

☆大气降水中所含溶解气体十分稳定,浓度几乎不变,但CO2成分不稳定。
☆大气降水中二氧化硅含量很小,一般不超过0.5mg/L。
大气降水的pH值一般为5.5-7.0左右。
☆目前,酸雨已成为全球性的重大环境问题之一。
海水占地球总水量的97.2%,世界各地海洋水质基本相似和稳定。
各种天然存在的元素,在海水中几乎都能发现,它们以单离子、络合离子、分子等各种形式存在。
海水占地球总水量的97.2%,世界各地海洋水质基本相似和稳定。
各种天然存在的元素,在海水中几乎都能发现,它们以单离子、络合离子、分子等各种形式存在。
34g 3☆宏量组分海水中宏量组分的含量按其顺序为Cl、Na、SO4、Mg、Ca、K、HCO3、Br,它们的总量占海水溶解物质的绝大部分,即99.94%。
☆中量组分它们是指含量为0.1-10mg/L的组分,这些组分是:Sr、SiO2、B、F、NO3、Li、Rb、C(有机)。
☆微量组分它们是指其含量小于0.1mg/L的组分。
它们包括P、I、Ba、Zn、Ni、As等30多种。
☆海水的含盐度大到在34‰-36‰范围内,只有含量范围变化很大,Na和Cl比也有些变化。
☆海水中含有溶解的和悬浮的有机物,一般有机碳含量在0.1-2.7mg/L范围。
2、海水的成分特征2、海、海水的成分特征3、河水的成分特征☆不同地区的岩石、土壤组成决定着该地区河水的基本化学成分。
在结晶岩地区,河流水中溶解离子含量较少;在石灰岩地区,河水中富含Ca2+及HCO3;若河流流经白云岩及燧石层时,水中Mg、Si含量增高;河流流经石膏层时,使水中富含SO4,且总含盐量有所增加;富含吸附阳离子的页岩及泥岩地区则向河水提供大量溶解物质,如Na、K、Ca、Mg。
☆河水中总含盐量在100-200mg/L间,一般不超过500mg/L,有些内陆河流可以有较高的含盐量。
河水中主要离子关系与海水相反,即其次序为Ca>Na,HCO3> SO4>Cl。


c n u第一章 地球上水的性质与分布第一节地球上水的物理性质一、水的结构1.气态水的结构z以单水分子(H2O)、双水分子([H2O]2)和三水分子([H2O]3)存在。
z水分子具有极性结构。
z单水分子(H2O)的键角是104º31¹,O-H键的键长是0.96Å。
2.固态水的结构(冰)z水分子通过氢键与另外四个水分子连结,具有较为完整的正四面体结构形态。
z键角增为109º28¹,键长增为1.01Å,故其密度较低。
3.液态水的结构液态水的结构较复杂,目前广泛接受的是“闪动簇团”模型。
把液态水看成以氢键结合的水分子的闪动簇团,在略为“自由”的水中游泳的一种液态体系,这些簇团的尺寸较小,且处于不断转化成“闪动”的状态,因而整个液体是均匀的,稳定流动的。
液态水的结构既包含有水分子的缔合体(簇团),又包含着水分子的微粒,此二者在液态温度0—100℃的条件下共居共存,且处于连续的转化“闪动”中。
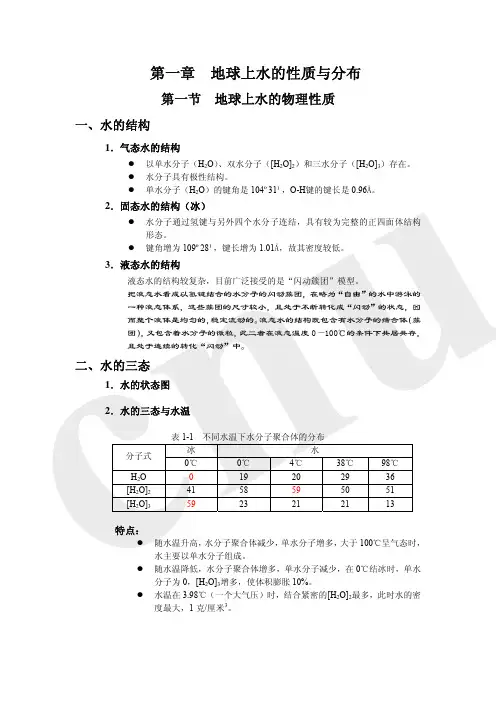
二、水的三态1.水的状态图2.水的三态与水温表1-1 不同水温下水分子聚合体的分布冰水分子式0℃0℃4℃ 38℃ 98℃H2O 0 19 20 29 36 [H2O]241 58 59 50 51 [H2O]359 23 21 21 13 特点:z随水温升高,水分子聚合体减少,单水分子增多,大于100℃呈气态时,水主要以单水分子组成。
z随水温降低,水分子聚合体增多,单水分子减少,在0℃结冰时,单水分子为0,[H2O]3增多,使体积膨胀10%。
z水温在3.98℃(一个大气压)时,结合紧密的[H2O]2最多,此时水的密度最大,1克/厘米3。
三、水的热学性质1.热容量2.潜热z水是所有固体和液体中热容量较大的物质之一;z水的三态转化要吸收或放出热量;z冰的融解和水的蒸发,其潜热都较其它液体大,这与水分子的结构有关。
四、水温(一)海水的水温1.海水的热量收支z太阳辐射是海水最重要的热量来源c n uz海面蒸发、海面辐射是海水最重要的热量消耗z每年热量的收支平衡,海水年均温度几乎相同,但不同季节、不同海区的热量收支并不平衡。
