腺病毒的整合1
- 格式:docx
- 大小:12.22 KB
- 文档页数:1

汉恒生物科技(上海)有限公司 400‐092‐0065 1汉恒生物---腺相关病毒操作手册一、腺相关病毒(Adeno-Associated Viral Vector ,AAV )简介腺相关病毒属微小病毒科( parvovirus),为无包膜的单链线状 DNA 病毒。
AA V 的基因组约 4700bp ,包括上下游两个开放读码框架(ORF),位于分别由 145 个核苷酸组成的2个反向末端重复序列(ITR)之间。
基因组中有 3 个启动子(P5、P19 和 P40) 和 2 个开放阅读读框(ORF),rep 和 cap ,如图 1 所示。
rep 编码 4 个重叠的多功能蛋白,即 Rep78、Rep68、Rep52 和 Rep40,其中 Rep78 与 Rep68 参与 AA V 的复制与整合,Rep52 和 Rep40 具有解螺旋酶和 ATP 酶活性,与 Rep78、Rep68 共同参与单链基因组的复制;cap 编码的 VP1、VP2、VP3是装配成完整病毒所需要的衣壳蛋白,它们在 AA V 病毒整合、复制和装配中其重要作用。
图 1. AA V 基因组结构二、腺相关病毒的优点1. 安全性高:迄今从未发现野生型A A V 对人体致病,重组A A V 基因组序列上去除了大部分的野生型A A V 基因组元件,进一步保证了安全性;2. 免疫原性低:AA V2 的基因组仅 4681 个核苷酸,便于用常规的重组 DNA 技术进行操作,而且进行动物实验时造成的免疫反应小;3. 宿主范围广:能感染分裂细胞和非分裂细胞;4. 表达稳定:能介导基因的长期稳定表达;5. 物理性质稳定:在60℃不能被灭活,能抗氯仿;三、重组腺相关病毒载体系统简介汉恒生物科技(上海)有限公司 400‐092‐0065 2AAV 是一种复制缺陷型微小病毒,其增殖复制需要腺病毒或疱疹病毒的辅助。
AAV 无辅助病毒系统(AAV Helper-Free System )可以在无辅助病毒的条件下生产出重组腺相关病毒。

腺病毒和腺相关病毒有哪些区别?腺病毒和腺相关病毒(AAV)是用于基因传递的两种不同类型的病毒载体。
这两个重组病毒系统都具有感染广泛宿主的能力,包括分裂和非分裂细胞,而无需与宿主基因组整合。
它们两之间有几个主要区别:包装能力、水平,基因表达的起效和持续时间以及免疫应答。
腺病毒简介腺病毒有约8.5千碱基的容量,具有高水平的蛋白质表达和瞬时基因表达。
表达的发作时间可早于感染后16-24小时。
腺病毒系统的局限性主要在于靶细胞的高免疫应答。
尽管如此,由于它们对大多数组织有高效转导作用,仍被广泛用于研究中。
腺病毒不能整合至宿主基因组,仅能瞬时表达。
它可以对分裂期及非分裂期细胞进行感染。
其包装片段至多8 kb,浓缩滴度至多为1011-1012TU/mL,片段越大,滴度越低,表达水平还是比较高的。
腺病毒优势宿主范围广:能够感染分裂期细胞与静止期细胞;对上皮细胞有高度嗜性,尤其适用于感染原代细胞、悬浮细胞等难转染细胞类型感染效率高:优于其他病毒载体和转染系统的高感染能力,能达到近100%的效率包装容量大:最高可插入7.5 kb的外源片段表达水平高:1-2d即开始高水平表达安全系数高:去除病毒蛋白编码序列,降低细胞毒性和免疫反应;双质粒转染系统,生物安全性高无整合风险:无插入致突变性腺相关病毒简介AAV的包装容量约为4.5千碱基,蛋白质表达水平相对较低,有长效基因表达的潜力。
AAV的趋向性也可以通过不同的血清型增强。
AAV的主要缺点是其对目的基因的包装容量较小,并且表达起效较晚(体外2-7天,体内3-21天),然而,该传递系统所产生的免疫应答水平却非常低。
腺相关病毒可以稳定整合至宿主基因组,并且可以在特定基因产物存在的条件下整合至人类19号染色体中的特定位点。
它能对分裂期及非分裂期细胞进行感染。
其包装片段至多8 kb,浓缩滴度至多为1011-1013TU/mL,片段越大,滴度越低。
腺相关病毒可以应用Tet-on等诱导表达系统,表达水平也是比较高的。

汉恒重组腺病毒操作手册目录腺病毒安全使用和注意事项腺病毒储存与稀释的注意事项一、整体实验流程二、实验材料三、腺病毒包装和浓缩四、重组腺病毒滴度(PFU)的测定五、重组腺病毒感染目的细胞六、重组腺病毒用于动物实验附1:汉恒生物腺病毒载体附2:腺病毒感染细胞最佳MOI的摸索(表达荧光的病毒) 附3:汉恒生物常见三种病毒感染目的细胞比较腺病毒安全使用和注意事项➢腺病毒安全使用注意事项(*非常重要*)1) 腺病毒相关实验请在生物安全柜(BL-2级别)内操作。
2) 操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
3) 操作病毒时需要特别小心病毒溅出。
如果操作时超净工作台有病毒污染,请立即用70%乙醇加 1%的SDS溶液擦拭干净。
4) 接触过病毒的枪头、离心管、培养板及培养瓶请用84消毒液浸泡后统一处理。
5) 如实验过程中需要离心,应使用密封性好的离心管,必要时请用封口膜封口后离心。
6) 病毒相关的废弃物需要特殊收集,统一经高温灭菌后处理。
7) 实验完毕后请用香皂清洗双手。
➢腺病毒储存与稀释的注意事项1)腺病毒的储存收到病毒液后若在短期内使用,可将病毒放置于 4℃保存(一周内使用完最佳);如需长期保存请分装后放置于 -80 ℃ 。
注:a.反复冻融会降低病毒滴度(每次冻融会使病毒滴度降低10%~50%),因此在病毒使用过程中尽量避免反复冻融。
汉恒生物对病毒已进行分装(200 μl/tube),收到后请直接放置-80℃冰箱保存即可。
b.若病毒储存时间超过6个月,汉恒生物建议在使用前重新测定病毒滴度(参见附表2-慢病毒滴度测定方法)。
2)腺病毒的稀释需要稀释病毒时,请将病毒取出置于冰浴融解后,使用PBS或培养目的细胞用的无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后置于 4℃保存(一周内使用完最佳)。
重组腺病毒是一种复制缺陷的腺病毒载体系统,在基因治疗、基础生命科学研究等领域被广泛应用。

腺病毒转染细胞步骤及方法腺病毒(Adenovirus,ADV)是一种线性双链DNA 病毒。
腺病毒不仅可以作为哺乳动物基因转移载体而得到广泛应用,亦可被用来在人体细胞中过量表达蛋白(Massie et al., 1998a,b)。
迄今为止已有大量关于腺病毒及其应用的综述表明:重组腺病毒在科学研究和治疗应用领域都具有很大的潜力,同时作为基因转移工具相对于其他病毒载体有多方面的优势。
运用了去除5' ITR、包装信号和E1 序列的全新的腺病毒骨架基因,无需进行细菌体内的同源重组步骤,无需使用多蚀斑分离方法分离目的重组腺病毒的步骤,因此较其他系统生长更快,并且大大降低了重组形成野生型可复制腺病毒的危险;无E1a,不产生复制型腺病毒,因此更为安全。
二、腺病毒载体优势1)可感染的细胞种类多,宿主范围广,几乎可以感染所有类型的细胞;2)感染效率高,重组腺病毒被广泛应用于使用脂质体转染效率较低细胞的基因转导和蛋白表达;3)包装外源基因的片段大,高达8kb;4)腺病毒载体构建及包装容易操作,易于制备出滴度高的大量病毒;5)当腺病毒感染细胞后,病毒基因组存在于细胞染色体外,不整合到细胞染色体中,避免了因整合引起的基因突变及激活致癌基因,生物安全性高。
三、流程描述制备腺病毒颗粒的穿梭质粒及其骨架质粒,上述质粒载体分别进行高纯度无内毒素抽提,用转染试剂RNAi-Mate 进行共转染293A 细胞,转3染6小时后更换为完全培养基,培养7-15 天,每3天左右补充一次新鲜培养基,然后收集细胞和上清液置于离心管中,冻融三次,4000 rpm 离心10 分钟,取上清即为病毒液初代原液。
连续三代反复扩增收集病毒后,腺病毒的大量扩增,而后对其纯化和浓缩后得到高滴度的腺病毒浓缩液,在293A 细胞中测定并标定病毒滴度。
在一定滴度范围内的腺病毒颗粒可以满足大部分体内体外实验需求。
四、具体步骤细胞培养活细胞计数用无血清培养基把细胞悬液稀释到200~2000 个/ml (一般稀释倍数为100 倍),在0.1 ml 的细胞悬液中加入0.1 ml 的0.4%的台盼蓝溶液。

汇总了腺病毒的一些常见问题及解答!1.目前,对于基因治疗的载体选择,很难有一个统一的结论,文章也很多,我将在如下给出。
本人认为,无论选择哪种载体,关键在于此载体在局部的表达效率。
无论是采用IN VIVO 或者EX VIVO的方法,因为我们最终的目的是要在局部表达我的目的基因,并且使其具有一定的作用。
而对于载体的副作用,目前较为公认的就是病毒载体转染效率高,但副作用大;质粒载体毒性小,但转染效率比较低。
同时,对于目前所常用的一些带有报告基因的表达载体如BD公司所开发的系列载体,pEGFP、pDsRed、pEYFP和pECFP等:这些载体如果用于细胞水平的检测,也许会更加的方便、直观,但是,如果用于体内的基因治疗,那就不是一个理想的载体了。
而传统的表达载体如INVITROGEN公司()的pCDNA载体系列,会更好一些。
同时,为了获得更加高效的表达,一些公司也开发出了具有信号肽的表达载体,以增加外源基因的分泌表达。
/vcore/Plasmids/pUMVC6a.htm/vcore/Plasmids/pUMVC7.htm正如一个疾病的治疗一样,治疗的方法越多,就证明还没有一个最有效地治疗手段。
基因治疗的载体也是同样,很难说哪个载体具有高转染、高表达、低毒性的全部优点。
以上是本人的一点愚见,还请各位同道指正。
2.转染过小鼠肝癌细胞H22,请赐教:用什么方法可以达到最佳效果,脂质体、电转还是重组病毒?如果用脂质体,哪家的最好?H22细胞为悬浮细胞,用病毒(逆转录病毒和腺病毒)最为理想,一是转染效率高,二是不用筛选直接用于实验。
但逆转录病毒的转染效率并不能达到100%,且影响因素多,而腺病毒感染效率高,几乎可达100%,但只能短期表达(7-10天),随着细胞传代,外源基因会逐渐丢失。
当然,H22也可用脂质体进行转染,筛选应在96孔板上进行,由于培养液少、细胞相对静止,两周后可见细胞克隆生长,在倒置显微镜下用吸管吸取克隆,进行扩大培养。

汇总了腺病毒的一些常见问题及解答!1.目前,对于基因治疗的载体选择,很难有一个统一的结论,文章也很多,我将在如下给出。
本人认为,无论选择哪种载体,关键在于此载体在局部的表达效率。
无论是采用IN VIVO 或者EX VIVO的方法,因为我们最终的目的是要在局部表达我的目的基因,并且使其具有一定的作用。
而对于载体的副作用,目前较为公认的就是病毒载体转染效率高,但副作用大;质粒载体毒性小,但转染效率比较低。
同时,对于目前所常用的一些带有报告基因的表达载体如BD公司所开发的系列载体,pEGFP、pDsRed、pEYFP和pECFP等:aaaclontechaaa这些载体如果用于细胞水平的检测,也许会更加的方便、直观,但是,如果用于体内的基因治疗,那就不是一个理想的载体了。
而传统的表达载体如INVITROGEN公司(aaainvitrogenaaa)的pCDNA载体系列,会更好一些。
同时,为了获得更加高效的表达,一些公司也开发出了具有信号肽的表达载体,以增加外源基因的分泌表达。
bbb:///vcore/Plasmids/pUMVC6a.htmbbb:///vcore/Plasmids/pUMVC7.htm正如一个疾病的治疗一样,治疗的方法越多,就证明还没有一个最有效地治疗手段。
基因治疗的载体也是同样,很难说哪个载体具有高转染、高表达、低毒性的全部优点。
以上是本人的一点愚见,还请各位同道指正。
2.转染过小鼠肝癌细胞H22,请赐教:用什么方法可以达到最佳效果,脂质体、电转还是重组病毒?如果用脂质体,哪家的最好?H22细胞为悬浮细胞,用病毒(逆转录病毒和腺病毒)最为理想,一是转染效率高,二是不用筛选直接用于实验。
但逆转录病毒的转染效率并不能达到100%,且影响因素多,而腺病毒感染效率高,几乎可达100%,但只能短期表达(7-10天),随着细胞传代,外源基因会逐渐丢失。
当然,H22也可用脂质体进行转染,筛选应在96孔板上进行,由于培养液少、细胞相对静止,两周后可见细胞克隆生长,在倒置显微镜下用吸管吸取克隆,进行扩大培养。

第一节AAV病毒的生活周期腺病毒伴随病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一。
这一家族成员是一类微小、无被膜及具有二十面体结构的病毒。
病毒颗粒的直径在20~26nm之间,含有大小在4. 7~6kb之间的线状单链DNA基因组。
从昆虫到人类都已分离到微小病毒。
AAV病毒属于依赖性病毒类(De pendovirus),最初是在纯化的腺病毒液中发现的一种污染成分(Atchinson et al. 1965), 顾而得名。
从鸟类到许多哺乳动物包括人的体内都分离到各种血清型的AAV病毒。
大多数成年人都感染过AAV病毒,但尚未发现该病毒是任何疾病的致病因素。
在多数情况下,AAV在培养的正常细胞中不发生产毒性感染,只有在有辅助病毒包括腺病毒或疱疹病毒共同感染时才发生产毒性感染(Hoggan et al. 1966; Buller et al. 1981)。
因此,AAV病毒长期以来被认为是一种缺陷性病毒。
进一步的研究发现AAV病毒并非缺陷性病毒,而是在正常细胞中偏向于建立潜伏感染,仅在宿主细胞受到刺激时才被诱发进行感染性增殖。
AAV的生活周期有两种不同的胞内期。
在无辅助病毒存在时,AAV病毒颗粒进入细胞,脱衣壳后AAV的调节蛋白发生有限的表达,并抑制病毒基因的进一步表达和病毒DNA的复制。
这种负调节作用的结果是促进病毒基因组整合到宿主的基因组中建立潜伏感染。
AAV病毒偏向于整合到人基因组19号染色体q臂的特定位置(Kotin et al. 1990,1991,1992; Samulski et al. 1993)。
研究被AAV病毒潜伏感染的细胞发现,AAV对细胞表型往往有微弱影响,并影响细胞对刺激的反应能力(Yalkinoglu et al. 1988; Yakobson et al. 1987,1989; Bantel-Schaal et al. 1992, 1991)。
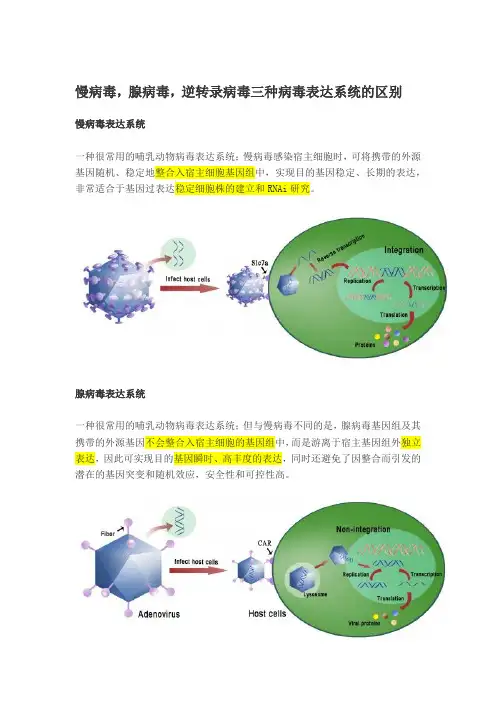
慢病毒,腺病毒,逆转录病毒三种病毒表达系统的区别
慢病毒表达系统
一种很常用的哺乳动物病毒表达系统;慢病毒感染宿主细胞时,可将携带的外源基因随机、稳定地整合入宿主细胞基因组中,实现目的基因稳定、长期的表达,非常适合于基因过表达稳定细胞株的建立和RNAi研究。
腺病毒表达系统
一种很常用的哺乳动物病毒表达系统;但与慢病毒不同的是,腺病毒基因组及其携带的外源基因不会整合入宿主细胞的基因组中,而是游离于宿主基因组外独立表达,因此可实现目的基因瞬时、高丰度的表达,同时还避免了因整合而引发的潜在的基因突变和随机效应,安全性和可控性高。
逆转录病毒表达系统
逆转录病毒将自身基因组及其携带的外源基因随机、稳定地整合入宿主细胞基因组中,可实现目的基因稳定、长期的表达逆转录病毒表达系统根据不同的包装细胞系可分为单嗜性、双嗜性和泛嗜性,不同包装细胞产生的逆转录病毒能够特异性地感染某一个或某一类宿主细胞。
辉骏生物采用的病毒包装细胞系为plat E 细胞系,该细胞系包含gag、pol和env基因,因此转染单一表达质粒就可以包装出逆转录病毒,但是该病毒具有很强的针对性,只适用于大鼠、小鼠细胞稳定株的建立。
三种病毒表达系统的特点。

腺病毒包装的原理和具体步骤及方法
腺病毒包装
1 特点:
1.1 几乎可以感染所有类型的细胞。
1.2 可以获得复制缺陷型(E1和E3缺失)的腺病毒。
1.3 病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效地进行增殖。
1.4 腺病毒载体感染宿主的范围比较广。
1.5 感染细胞时,不整合到染色体中,不存在激活致癌基因或插入突变等危险,生物安全性高。
2原理:
腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
3 腺病毒包装简要流程
3.1 含有目的基因的腺病毒穿梭载体的构建和质粒纯化提取。
注:客户也可以提供构建好的重组腺病毒穿梭载体。
3.2 穿梭载体与腺病毒骨架质粒重组及鉴定。
3.3 重组腺病毒质粒的酶切线性化。
3.3 线性化的重组腺病毒质粒转染包装细胞,收获细胞以制备病毒粗提液。
3.4 腺病毒扩增并纯化。
3.5 分装,- 80 oC保存。
3.6 滴度测定及无菌检测。

腺病毒-降低其高免疫原性的办法上期文章中讲到,腺病毒作为基因治疗载体有如下优点:a对分裂和非分裂细胞均具有高转导效率;b不能整合到宿主基因组,使其具有非常低的插入突变风险;c非常大的载体包装容量:8 to 30 kilobase (kb)但是,也提到了缺点:腺病毒载体的高免疫原性。
也是由于这个原因,限制了腺病毒用于基因治疗的应用范围。
病毒载体在用于治疗骨骼肌或肝脏等大器官系统的各种疾病,实体瘤治疗都需要通过血液系统。
在这个过程中,人体有各种免疫机制防止病原体入侵,引发免疫反应,导致人体会快速清除腺病毒颗粒(外来物质),其严重阻碍基于病毒载体的系统临床应用及其效果,同时很大可能人体的防御机制会引发急性毒性反应。
图1表达的病毒载体与宿主之间复杂的相互作用网络。
而今天的重点就是:如何降低腺病毒载体的高免疫原性。
图片1来源DOI:10.1007/s11262-017-1498-z在开始今天的介绍前,先了解腺病毒基因产物的主要功能。
简单介绍腺病毒的早期蛋白(Early proteins)和晚期蛋白(Late proteins)。
早期蛋白由腺病毒连续产生,可以同时增强和抑制免疫应答。
E1(包括E1A和E1B)和E2是腺病毒复制所必需的蛋白,但同时也引起强烈的免疫反应。
E4是一种p70抗原,会促进病毒mRNA的早期和晚期转运并且具有高度免疫原性。
E3也具有免疫原性,同时E3产生的产物能够抑制主要组织相容性复合物-I(MHC-I)转运到抗原呈递细胞(APC)表面,从而破坏免疫反应。
晚期蛋白主要是腺病毒的结构蛋白,腺病毒结构蛋白在细胞核内聚集形成病毒衣壳。
衣壳(Capsid)含有240个六联体(Hexon)、12个五联体(Penton)及12根纤毛(Fiber),除此之外还有其他一些小蛋白,如VI、VIII、IX、IIIa和IVa2等。
研究表明,腺病毒的高免疫原性主要是由其衣壳蛋白(如五联体)和晚期基因表达产物(L1~L5)引起的。

腺病毒简介1 简介 ⼈体腺病毒已知有52种,分别命名为adl~ad52,研究得最详细是ad2。
腺病毒基因组转录产⽣mRNA,已知的转录单位⾄少有5个:EⅠ区位于病毒基因组左侧,可再分成EⅠA和EⅠB,与细胞转化有关;EⅡ区编码DNA结合蛋⽩,参与病毒的复制;EⅢ区编码出现在宿主细胞表⾯的⼀种糖蛋⽩;EⅣ区位于ad2基因组右端,受EⅡ区编码的DNA结合蛋⽩质调控;第5个转录单位在病毒感染中期合成ad2蛋⽩质Ⅳ。
腺病毒对啮齿类动物有致癌能⼒,或能转化体外培养的啮齿类动物细胞。
使细胞转化只需要腺病毒基因组的⼀部分,这些基因位于基因组的左端,约占整个基因组的7%~10%。
尽管腺病毒分布很⼴,但对⼈体不出现致癌性。
⼈体细胞是⼀类允许细胞(permissive cell),即这类细胞允许感染⼊侵的病毒在细胞内复制增殖,最后细胞裂解死亡⽽释放出⼤量⼦代病毒。
在体外培养的多种⼈体肿瘤细胞中均未查出腺病毒颗粒,但在⼈的1号染⾊体上有adl2的整合位点,这意味着⼈体细胞对于腺病毒也可能是⾮允许细胞,即这类细胞在病毒感染后,病毒不能在细胞内复制增殖,但可整合在受感染细胞的基因组内。
这些细胞被病毒转化,表型发⽣改变,且可在体外⽆限期地培养传代。
2 化学组成 腺病毒是⼀种⽆包膜的双链DNA病毒,基因组长约25-45kb,理论上可编码22-40个基因。
⾐壳(capsid)呈规则的20⾯体结构,直径约80-110nm。
⾐壳含有240个六联体(hexon)、12个五联体(penton)及12根纤⽑(fiber),除此之外还有其他⼀些⼩蛋⽩,如VI、VIII、IX、IIIa和IVa2等。
六联体是形成病毒⾐壳20个三⾓形⾯的主要蛋⽩,12个顶端是5个五联体亚单位和3个纤⽑蛋⽩构成的复合物,12根纤⽑以五联体蛋⽩为基底由⾐壳表⾯伸出,纤⽑顶端形成头节区(knob)。
五联体和纤⽑的头节区可与细胞表⾯的病毒受体结合,在病毒感染细胞过程中起着⾮常重要的作⽤。
腺病毒载体治疗技术进展腺病毒载体(Adeno-associated virus,AAV)治疗技术是一种近年来快速发展的基因治疗技术,它利用AAV这种天然存在而又不会引起人体免疫反应的病毒作为载体,将需要治疗的基因序列植入到人体细胞中,达到治疗疾病的目的。
经过多年的实践和研究,AAV治疗技术已成为基因治疗领域最重要的技术之一,对多种罕见遗传疾病、神经退行性疾病、癌症等疾病的治疗取得了重要的进展。
一、AAV的优势AAV作为一种病毒,有着天然存在且不会引起人体免疫反应的特点,因此成为了基因治疗的一种理想载体。
AAV的基因序列较小,仅为4.7kb,但可以携带外来基因序列,且其在非细胞因子诱导的条件下高效地感染到人体细胞,对多种细胞和组织类型具有广泛的适应性。
AAV的稳定性也很高,对于外界环境的影响不敏感,而且其整合到人体细胞的基因组中的概率非常低,也减少了潜在的基因毒性。
二、AAV治疗技术的现状目前,AAV治疗技术在多个领域有着广泛的应用和研究。
其中最重要的是在罕见遗传病的治疗方面,比如肌肉萎缩症、糖原贮积病、囊性纤维化、黑色素瘤等多种遗传疾病。
此外,AAV治疗技术也在神经系统疾病、心血管疾病、器官损伤修复、癌症等领域的治疗和研究中得到了广泛的应用。
一些治疗在临床前试验中已经显示出了显著的治疗效果,例如在亚致死疾病疗法方面,AAV治疗技术已经显示出显著的效果。
例如,肌肉萎缩症等病种的治疗效果均已显著地提高,并且这种治疗方法也成为了其他疾病治疗的借鉴。
而对于一些不可治愈的疾病,AAV的基因治疗方法则为疾病的管理和控制提供了有效的手段。
三、AAV治疗技术的难点虽然AAV治疗技术取得了一些研究上的成果以及一些临床应用的效果,但技术仍有很多的难点需要克服。
AAV载体的设计和构建是其中一个重要的难点,因为AAV载体所能携带的基因序列往往受到构建载体的限制。
此外,AAV载体的制备和净化也是技术难点之一,因为AAV所需的纯度非常高,同时纯化的方法也非常复杂。
腺病毒感染细胞具体步骤及方法操作工具•慢病毒•腺病毒•腺相关病毒•悬浮细胞专用病毒•质粒基因调控•CRISPR/Cas9•RNA干扰•过表达•非编码基因•组织特异性启动子•Cre-loxp疾病研究•心血管领域•肝脏•眼•肺•脂肪、骨、肾脏神经领域•神经系统•光遗传•化学遗传•钙离子成像腺病毒腺病毒(Adenovirus)是一种线性双链DNA无包膜病毒,对分裂期细胞和非分裂期细胞均具有感染能力,且具有嗜上皮细胞性。
重组腺病毒载体是以腺病毒为基础发展起来的工具病毒载体,它可通过受体介导的内吞作用进入细胞内,但腺病毒基因组不整合进入宿主细胞基因组中。
腺病毒作为一种常用的基因操作工具,在心血管领域、肝脏、肌肉、肺、肿瘤及其他领域广泛应用。
优势腺病毒与其他病毒工具比较,具有以下优势:a. 是研究原代非增殖细胞基因表达的最佳系统:腺病毒感染细胞后,1-2 天即可表达,是研究原代非增殖细胞基因表达的最佳系统;b. 滴度高:腺病毒系统在转有E1 基因的HEK293 细胞中可进行自我复制,可产生滴度为1010到1011 PFU/mL 的病毒;c. 载体容量大:可容纳不超过5kb 的片段;d. 不整合到染色体中,无插入致突变性:腺病毒除卵细胞以外,几乎在所有已知细胞中都不整合到染色体中,因此避免了因整合而引发的潜在的基因突变和随机效应。
包装服务质量检测载体选择粒成提供完善的腺病毒产品体系,用于操作编码基因和非编码基因,如lncRNA、microRNA、circRNA。
应用案例1. 细胞感染。
腺病毒载体操作手册中文版腺病毒重组系统AdEasyTM操作手册目录第一章简介 1第二章应用重组腺病毒的优点 2第三章 AdEasyTM 技术 3技术概况 3AdEasyTM系统中产生重组腺病毒的时程 3 第四章主要流程 4将基因克隆入AdEasyTM转移载体 44.1.1 克隆的一般原则 4构建重组AdEasyTM转移载体 5细菌内AdEasyTM重组子的产生 5共转化的一般原则 5共转化方法 5预期结果 5AdEasyTM重组质粒的筛选和扩增 6AdEasyTM重组子转染QBI-293A细胞 6 细胞铺板 6磷酸钙转化技术 7第五章常用技术 8QBI-293A细胞培养 8QBI-293A细胞的初始培养 8QBI-293A细胞的维持培养和增殖 8QBI-293A细胞的冻存 8QBI-293A细胞的转染和病毒空斑的产生 9 感染QBI-293A细胞 9病毒空斑形成 9琼脂糖覆盖被感染细胞 9MOI测定 10腺病毒感染力测定 10X-Gal染色 11重组腺病毒的筛选和纯化 11挑选最佳重组腺病毒:表达和基因输送 11 病毒空斑挑选和小量扩增 12Western杂交 13Southern杂交和点杂交 13病毒裂解产物PCR 14免疫测定 14功能测定 14病毒颗粒在QBI-293A细胞中的大量扩增 15 两次氯化铯密度梯度离心纯化重组腺病毒 16 不连续密度梯度离心 17连续密度梯度离心 17病毒溶液去盐和浓集 17病毒滴度测定 18nm (VP/ml) 19空斑测定法 2050%组织培养感染剂量法 20第六章疑难解答 22QBI-293A细胞培养 22感染力测定 22转移载体克隆 23在BJ5183细胞中共转化和重组 24转染QBI-293A细胞 25筛选和测定 25在QBI-293A细胞中表达 26重组腺病毒的扩增 26纯化 26病毒滴度测定 27缩写英文全称中文全称Ad Adenovirus 腺病毒Ad5 Adenovirus serotype 5 血清5型腺病毒AdV Adenoviral Vector 腺病毒载体Amp Ampicillin 氨苄青霉素β-Gal β-Galactosidase β-半乳糖苷酶bp Base Pair 碱基对BSA Bovine Serum Albumin 小牛血清白蛋白cDNA Complementary DNA 互补DNAcccDNA Closed Circular Coiled DNA 闭环螺旋DNA CPE Cytopathic Effect 细胞病理效应CsCl Cesium Chloride 氯化铯DMEM D ulbecco’s Modified Eagle Medium DMEM培养基DMSO Dimethyl Sulfoxide 二甲基亚砜DTT Dithiothreitol 二硫苏糖醇EDTA Ethylene Diamine Tetraacetic Acid 乙二胺四乙酸EtBr Ethidium Bromide 溴化乙锭FBS Fetal Bovine Serum 胎牛血清Hr Hour 小时ITR Inverted Terminal Repeat 反向末端重复Kan Kanamycin 卡那霉素kb Kilobases 千碱基对KDa KiloDaltons 千道尔顿LB Luria-Bertani ( broth ) LB培养基MCS Multiple Cloning Site 多克隆位点Min Minute 分钟MOI Multiplicity of Infection (Virus/Cell ) 感染复数mRNA Messenger RNA 信使RNAMWCO MOIecular Weight Cut-offPAGE PolyAcrylamide Gel Electrophoresis 聚丙烯凝胶电泳PBS Phosphate Buffered Saline 磷酸盐缓冲液PFU Plaque Forming Unit 空斑形成单位pi Post Infection 感染后RCA Replication Competent Adenovirus 增殖性腺病毒RITR Right Inverted Terminal Repeat 右侧反向末端重复SDS Sodium Dodecyl Sulfate 十二烷基硫酸钠TBE Tris Borate/EDTA 三羟甲基氨基甲烷硼酸盐/乙二胺四乙酸TCID50 Tissue Culture Infectious Dose 50 50%组织培养感染剂量TCP Total Cellular Protein 细胞总蛋白TE Tris/EDTA TE溶液wt Wild Type 野生型X-Gal5-bromo-4-chloro-3-indolyl-D-Galactopyranoside 5-溴-4-氯-3-吲哚-β-D-半乳糖苷第一章简介当今基因输送技术的发展日趋复杂,一些治疗药物(生长激素、干扰素、抗病毒和抗癌复合物)和诊断性蛋白(单克隆抗体)的设计、发展与合成需要更高效的基因输送工具。
腺病毒载体为大分子双链DNA,,36KB,所以一般不会整合到细胞基因组中,典型的腺病毒载体系统,如穿梭质粒pCA13/腺病毒基因组质粒pBHG11/包装细胞293细胞。
pCA13/的HCMV IE启动子-多克隆位点-SV40 AN(poly A)构成外源基因的表达盒,该表达盒的插入使腺病毒E1基因缺失,但是保留其两端侧翼序列(左侧的1~3bp的ITR,右侧从3.5kb到末端的维持病毒装配和活力必须的蛋白IX的基因),也保留了腺病毒的包装信号φ(194~358bp);pBHG11则保留了腺病毒基因组的绝大部分,但是缺失了包装信号φ、0.5~3.7图距(mu)部分的E1区、77.5~86.2mu的E3区,293细胞是整合有Ad5 E1基因的人胚肾细胞系。
pBHG11因为缺失包装信号及E1区而不能复制,pCA13带有包装信号及E1的侧翼序列,但是缺失E1区及腺病毒绝大部分基因组,同样不能复制。
外源目的基因插入pCA13后,与pBHG11共转染,进入293细胞。
pCA13与pBHG11在细胞内发生同源重组,同时,293细胞提供E1蛋白,从而包装产生腺病毒颗粒。
该病毒的蛋白质外壳同野生型腺病毒相似,具有同样的感染力进入靶细胞的能力,但是基因组DNA的E1区被外源目的基因取代,即进入靶细胞后病毒不能复制,但可以表达目的蛋白。