浙江工业大学801物理化学2003--2010_2012--2015年考研真题/研究生入学考试试题
- 格式:pdf
- 大小:16.76 MB
- 文档页数:93



刚上大学的时候,我的家人希望我能考研,因为我的本科学校很普通。
当时,我并没有想过。
直到这几年的学习,出于自身对专业课的兴趣越来越浓厚,想要继续深入系统的学习,而我们本科对专业课的学习知识一点皮毛,是远远不够的!怀着专业的热爱,我毅然决定考研,在大三上册就开始准备复习。
充满信心地去下定决心做一件事情是做好它的前提,最开始自己像一只无头苍蝇一般,没有方向。
只能靠自己慢慢摸索,查资料、看考研经验分享、问学长学姐,虽然这个过程很繁琐,但是我已经下定决心考研,所以无所畏惧!对于考研来说最关键的就是坚持。
一年的考研时间,我想,对于这个词,我是有很多话要说的。
我以为自己是个能坚持的人,但是考研这一年来,真正让我体会到了坚持的不易!正如很多研友的分享所说,考研谁不是一边想放弃一边又咬牙坚持着,那些坚持到最后的人,都会迎来他们的曙光。
文章可能有点长,末尾我也加了一些真题和资料的下载方式,大家放心阅读即可。
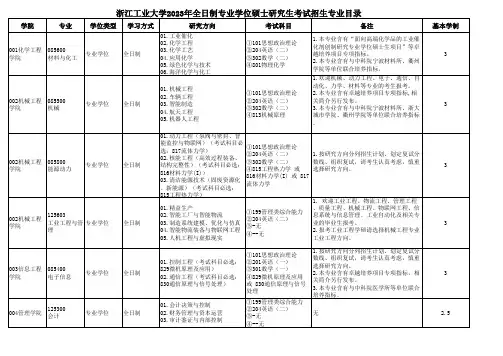
浙江工业大学材料与化工初试科目:(101)思想政治理论(204)英语二(302)数学二(801)物理化学或(803)化工原理(801)物理化学参考书:1. 物理化学(第五版),天津大学物理化学教研室,高等教育出版社2.物理化学(第一版),吕德义等编,化学工程出版社3. 物理化学简明教程(第四版),印永嘉,奚正楷,李大珍,高等教育出版社4. 物理化学(第五版),傅献彩,沈文霞,姚天扬编,高等教育出版社有关英语的一些经验大家都说“得阅读者得天下”。
阅读一共占40分,但如果把所有精力都花在阅读练习上,不注意其他题型的应试技巧,也是得不偿失的。
建议大家抽出3个小时的时间,完整地做一套题。
做完一套卷子之后,正确率是次要的,重点是发现自己的弱点,同时了解试卷结构并调整自己的时间安排与做题节奏。
对于真题,一定要做到“心中有数”!不能像无头苍蝇一样一下子就扎进了哪个老师的长难句网课或者哪本阅读书当中。
不是说辅助网课和书不好,而是说要有的放矢,先整体,后局部深入。


浙江工业大学2001年攻读硕士学位研究生入学试题试题科目:物理化学、、选择题(40%)(在以下的每小题后面均有A 、B 、C 、D4个答案供选择,请选择其中一个您认为是正确的答案,并将相应的字母写在题号前面的括号内。
注意:只选一个答案,多选不得分)1、在373.15kPa 时,1molH 2O (l )经可逆相变完全汽化为同温同压的H 2O (g )则下列结论正确的是(A )W =- RT ln() (B )W = - RT g l V V (C )dT=0 (D ) 21.T v m T U C ∆=⎰21.0T p m T H C dT ∆==⎰2、对任意一化学反应,等压热效应与等容热效应的关系为故()p V B g Q Q RT ν=+∑(A )> ( B) <p Q v Q p Q vQ (C ) = (D) 不一定大于p Q v Q p Q vQ (式中为反应中气体的计量系数)()B g ν3.298K 时,1.10287g 的苯甲酸(M=122.1)在弹式量热计中燃烧,反应完全后温度升高2.234K ,体系的热容为1.21710J ⋅K ,则苯甲酸的为⨯41-c H ∆(A) =3227kJ ⋅mol ( B)=-3227 kJ ⋅mol c H ∆1-c H ∆1-(C ) =-3228 kJ ⋅mol (D)=3228 kJ ⋅mol c H ∆1-c H ∆1-4.等温等压下,体系对外所作非体积功的绝对值W '(A)可以大于体系G 降低的绝对值 (B) 等于体系G 降低的绝对值(C)可以大于体系A 降低的绝对值 (D).不能大于体系G 降低的绝对值5.已知298K ,反应H 2(g )+ O 2(g )H 2O (l )的=-237.19 kJ ⋅mol ,21→r m G ∆1-=-163.2 J ⋅K -1⋅mol ,假设,则398K 时,反应的等于r m S ∆ 1-,0r p m C ∆=r m G ∆(A )-237.19 kJ.mol (B )-253.51 kJ.mol 1-1-(C )-220.87 kJ.mol (D )253.51 kJ.mol 1-1-6.理想气体混合物中任一组分B 的化学势与压力的关系是(A)=RT (B) =p B,()B T n p μ∂∂,(BT n p μ∂∂(C )= (D) = p (体系的总压),(BT n p μ∂∂BRT p ,(BT n p μ∂∂7.对N ,O 混合气体(视为理想气体)进行绝热可逆压缩,则22(A)=0 (B) G =0 (C)U =0 (D)H =0S ∆∆∆∆8.某晶体的两种晶形,在转换温度附近的蒸气压随温度变化的关系分别为lg p 1= -5082/T +11.364和lg p 2= -5555/T +12.564,则两晶体的转换温度为(A)375.2K (B)392.2K (C )394.2K (D)494.2K9.H 2O (l ,373K, p )H 2O (g,373K,−−−→向真空蒸发p ),判断该过程能否发生,可用的判据是(A)∆A (B) ∆G (C) ∆U (D) ∆S (体系)+ ∆S (环境)10.设有下列各状态1.373.2K ,101.325kPa 的液态水2. 373.2K ,202.650kPa 的液态水3.373.2K ,101.325kPa 的水蒸气4.373.2K ,55.660kPa 的水蒸气请指出上述各状态化学势的大小顺序是(A) (B)2134μμμμ>=>2134μμμμ<=<(C) (D)2143μμμμ>=>4321μμμμ>=<11.关于电解质溶液电导率的概念下列说法正确的是3(A) 1m导体的电导 (B)1mol电解质溶液的电导2(C)面积为1m相距1m的两平行电极之间的电导(D)两相距1m的平行电极之间导体的电导12.Na(汞齐,0.206%)|NaI(在酒精中)|Na(s)的电动势E是(A)正值 (B)负值 (C)零 (D)与NaI的活度有关13.对于(1)电解池的阴极;(2)原电池的正极;(3)电解池的阳极;(4)原电池的负极;由于极化而使电极电势负移的电极是其中的(A)(1)和(2) ( B)(1)和(4)(C)(2)和(3) ( D)(3)和(4)14.微小晶体与普通晶体相比较,下列性质不正确的是(A)微小晶体的蒸气压较大 (B)微小晶体的溶解度较大(C)微小晶体的溶解度较小 (D)微小晶体的熔点较低15.若需研究电解质对某一溶液的稳定性的影响,最好的方法是测定(A) 电泳速度 (B) 电渗速度(C) 电解质的聚沉淀 (D) 沉降速度16.丁达尔现象的本质是光的散射,下列说法中错误的是(A)大分子溶液中大分子的大小与胶粒相近,两者丁达尔效应的强弱也相近(B)小分子溶液中溶质粒子小,故丁达尔效应不明显(C)散射现象仅是光传播方向发生变化其波长不变(D)在超显微镜下观察到的光点不是胶粒的真实形象17.能润湿毛细管的液体,在管内的蒸气压为p r,同一液体在大烧杯中蒸气压为p o ,则(A) p r>p o (B) p r<p o(C) p r=0 (D) p r=p o18.反应A (g )+B (g )G (g )+R (g ),在350K 时 = -85 J ⋅mol -1⋅K-→r m S ≠∆ 1,=150kJ ⋅mol -1, 应为r m G ≠∆ r mH ≠∆ (A) 179.75 kJ ⋅mol (B) 120.25 kJ ⋅mol 1-1-(C) 29.9kJ ⋅mol (D) 29.6 kJ ⋅mol 1-1-19.一基元反应,正反应的活化能是逆反应活化能的2倍,反应时吸热120kJ ⋅mol ,正反应的活化能是1-(A) 120 kJ ⋅mol (B) 240 kJ ⋅mol 1-1-(C) 360 kJ ⋅mol (D) 60 kJ ⋅mol 1-1-20.某反应在一定条件下的平衡转化率为25%,当有催化剂存在时,其最高转化率(A) 大于25% (B) 小于25%(C) 等于25% (D) 有无改变不能确定二.(15分)1mol 单原子理想气体始态为273K ,p ,分别经历下列可逆变化:(a )恒温下压力加倍;(b )恒压下体积加倍;(c )恒容下压力加倍和(d )绝热不可逆反抗恒外压0.5⨯p 膨胀至平衡。
试计算上述各过程的Q 、W 、U 、H 、S 、G 、A 。
(已知273∆∆∆∆∆K ,p 下该气体的摩尔熵为100J ⋅K -1.mol )1-三、(5分)363K 时,甲苯(A )和邻二甲苯(B )的饱和蒸气压分别为53.32kPa 和20.00kPa ,某组成的该混合物在363K ,50.65kPa 下开始沸腾,该混合物是理想混合物,试计算在刚沸腾时、1、甲苯在液相中的物质的量分数x A (1)、2、甲苯在气相中的物质的量分数x A (g)四、(10分)已知汞的熔点为-39℃ ,铊的熔点为303℃,化合物Tl Hg 的熔点为15℃,8%的铊使汞的熔点降到最低温度-2560℃。
铊和Tl Hg 的最低共熔点温度为0.4℃,与之相应的低共熔混合物的组成25含41%的铊、1、试绘出Hg-Tl 体系的(T-w %)相图(示意图,但横纵坐标上关键点的数据应标出)、2、确定从含80%铊的10kg 铊汞齐中最多获得铊的质量(已知:铊原子量为204.37,汞原子量为200.59)五(10分)电池Pt , H ( p )|NaOH(aq)|HgO(s),Hg 在298K 时的电动势是0.9216V 2、1、写出电极反应及电池反应、2、求电池反应在298K 时的平衡常数、3、若HgO (s )和H 2O (l )的标准生成焓分别为-90.71kJ ⋅mol 和-285.841-kJ ⋅mol ,请计算此电池在308K 的电动势1-六(5分)292K 时,丁酸水溶液的表面张力与浓度的关系为=-σo σAln (1+B c ),式中为纯水的表面张力,c 为丁酸溶液浓度,A 、B 都是常数o σ、1、试求溶质表面过剩与浓度的关系式、2、若A=13.110N ⋅m ,B=19.62dm ⋅⨯3-1-3mol ;试计算丁酸溶液浓度为0.200mol.⋅dm -3时溶液表面过剩量。
1-七(10分)某一级反应A 产物,初速度(- )是110 mol ⋅dm -3.min -→dtdc A ⨯3-1,1小时后速度是0.2510 mol ⋅dm -3.min -1,求速度常数k 、半衰期t 和初始浓度c A⨯21八、(5分)反应N O (g )+NO (g )=3NO (g )的速率方程可表示为r=k (A :N 252n A p m Bp O ;B:NO),已知n =1,在一次实验中N O 和NO 的初始分压均为6600Pa ,NO 25252的初始压力为零,又反应体系在不同时刻的总压如下表0 2 4t h 13200 16500 18150a p p 总求m ?浙江工业大学2003年硕士研究生入学考试业务课试卷一.选择题(共计20小题,每小题3分,每小题选一个你认为最好的答案,注意,只能选一个,多选不得分)1.对于3A +2B →C ,当A 耗掉0.6mol 时,反应进度改变值为A 、0.6molB 、0.2molC 、0.3molD 、0.1mol2.判断某一化学反应绝热恒容条件下能否发生,可以使用的判据是(W 为除体积功以外的非体积功)'A 、0 B 、0 C 、 0 D 、 W A ∆≤i i μν∑≤S ∆≥A ∆≤'3.称作体系中B 物质偏摩尔量的是A 、B 、C 、D 、,,(C B T p n B Un ≠∂∂,,()C B T V n B A n ≠∂∂,,()C B T p n B n μ≠∂∂,,()C BS p n BHn ≠∂∂4.等压下由纯物质构成理想液态混合物时,其热力学函数的改变值应满足:A 、=0 , =0B 、=0 , =0mix H ∆mix G ∆mix H ∆mix S ∆C 、=0, =0 D 、=0, =0mix S ∆mix U ∆mix U ∆mix H ∆5.惰性气体影响平衡的原因是由于加入惰性气体使反应的A 、 K a 发生变化B 、K c 发生变化C 、K p 发生变化D 、 K x 发生变化6.反应+==+在973K 时压力平衡常数K p =0.71 CO()g 2H O()g 2CO ()g 2H ()g ,若此时各物质分压为=100Kpa, =50kPa , ==10kPa 则CO p 2H O p 2CO p 2H p A 、反应向右进行 B 、 反应向左进行C 、反应处于化学平衡状态D 、 反应进行的方向难以确定7.某物质的V m (s)< V m (l) ,当外压增大时,该物质的凝固点A 、升高B 、下降C 、不变D 、不能确定8某化学反应速率常数的单位是mol ⋅dm ⋅s ,则该反应的级数是:3-1-A 、零级 B 、一级 C 、二级 D 、三级9.对双分子反应A(g)+B(g) 产物 ,→在标准状态下过度状态理论中艾林方程的热力学表示式是:A 、B 、/()A B K c c c ≠≠=k K ν≠=C 、 D 、(/)exp(/)exp(/)B r m r m k k T hc S R H RT ≠≠=∆∆ '(/)k k T h K ≠=(注:是Boltzmann 常数,h 为普朗克常数)k '10.慢反应为速控步骤的复杂反应为:A 、平行反应B 、对峙反应C 、连串反应D 、链反应11.以银为阳极,Ag-AgCl 为阴极,电解食盐水,已知E (Ag +|Ag)=0.799V ,E (Cl 2|Cl -)=1.36V ,E (O 2|OH -)=0.401V ,E (AgCl|Ag)=0.222V ,则发生反应是:A 、阳极2Cl -2e Cl , 阴极2H +2e H --→2+-→2B 、阳极Ag+Cl -e AgCl ,阴极AgCl+e Ag+Cl --→→-C 、阳极2Cl -2e Cl , 阴极AgCl+e Ag+Cl --→2→-D 、阳极Ag-e Ag , 阴极2H +2e H -→++-→212.以AgNO 为稳定剂的AgI 溶胶,当达到等电点状态时,其胶粒结构为:3A 、(AgI)m B 、 (AgI)m ⋅n Ag +C 、[(AgI)m ⋅n Ag +(n -x )]x +D 、 [(AgI)m ⋅n Ag +(n -x )]x +⋅x3NO -3NO -3NO -13.确定基态能量为某一数值 时 ,分子配分函数以0ε表示,确定基态能量=0时,分子配分函数以q 0表示,下列诸试中错误的是0()q ε0ε:A 、=exp(-/kT )B 、 q 0=0()q ε0εexp(/)i i i g kT ε-∑exp(/)i i ig kT ε-∑C 、q ()= D 、 q ()=q 00εexp(/)i i ig kT ε-∑0ε0exp(/)kT ε-14.在描述恒沸物时,下列各点何者不正确A 、恒沸点的f =0,是一个无变量点B 、不具有确定的组成C 、平衡时气相和液相组成相同D 、其沸点随外压改变而改变15.各种运动形式的配分函数中与压力有关的是:A 、电子配分函数q (电)B 、转动配分函数q (转)C 、振动配分函数q (振)D 、平动配分函数q (平)16.以铜为电极,电解1.0mol ⋅dm CuSO (pH=3)溶液,在阴、阳极上的电解反应是3-4A 、阴极析出铜,阳极析出氧 B 、阴极析出氢气,阳极析出氧气C 、阴极析出铜,阳极铜溶解D 、阴极析出氢气,阳极铜溶解17.对连串反应A B C ,为使多得产物B ,当指前因子相同时,应选择1k −−→2k −−→A 、如果活化能E >E ,宜用较高反应温度12B 、如果E >E ,宜用较低反应温度12C 、如果E <E ,宜用较高反应温度 D 、如果k 1<k 2,宜用较低反应温度1218. 丁达尔现象的本质是光的散射,下列说法中错误的是A 、大分子溶液中大分子的大小与胶粒相近,两者丁达尔效应的强弱也相近B 、小分子溶液中溶质粒子小,故丁达尔效应不明显C 、散射现象仅是光传播方向发生变化,其波长不变D 、在超显微镜下观察到的光点不是胶粒的真实形象19.下列关于电解池的两个电极特征的说明中不正确的是A 、在阳极,其电位较高,进行氧化反应B 、电子密度较低的电极,称为阴极C 、电子密度较高的电极,进行还原反应D 、在阴极进行还原反应20.某溶液含有氧化性的物质,若利用电动势法测定该溶液的pH 值,现以饱和甘汞电极作为参比电极,最好选用下列哪种电极作为指示电极A 、玻璃电极B 、氢电极C 、铂电极D 、醌-氢醌电极二(15分)某理想气体1mol (沿pV =2477.6J 的可逆途径膨胀,体积从始态1dm 3变到终态10 dm 3,求该过程的、、、、、Q 及WG ∆A ∆U ∆H ∆S ∆三(15分)镉—甘汞电池反应为Cd+Hg 2Cl 2===Cd +2Cl +2Hg,如果式中所有组分都处在标准态,其电池电动势随温+2-度变化的关系式为:E =0.67-1.02×10-4(T -298)×2.4×10-6(T -298)21.写出电池的表示式2.试计算上述电池反应在313K 时的、、和热效应QH ∆S ∆G ∆四.(10分)反应NiO(s)+CO(g)===Ni(s)+CO (g)的/(J ⋅mol -1)=-20700-11.97T ,2r m G ∆求在101.325kPa 压力下,什么温度时平衡的气相产物中含有400ppm 的CO?(ppm 为百万分之一,即1/106)。