2012高考化学一轮复习课件:专题8第3单元盐类的水解知识研习苏教版
- 格式:ppt
- 大小:1.74 MB
- 文档页数:68
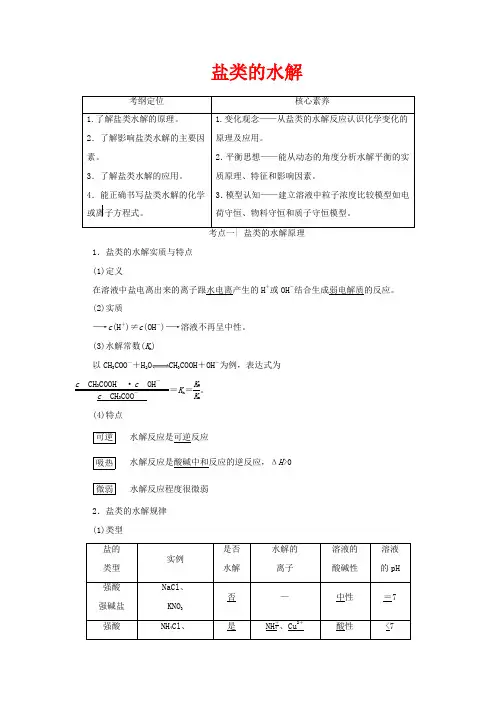
盐类的水解考纲定位核心素养1.了解盐类水解的原理。
2.了解影响盐类水解的主要因素。
3.了解盐类水解的应用。
4.能正确书写盐类水解的化学或离子方程式。
1.变化观念——从盐类的水解反应认识化学变化的原理及应用。
2.平衡思想——能从动态的角度分析水解平衡的实质原理、特征和影响因素。
3.模型认知——建立溶液中粒子浓度比较模型如电荷守恒、物料守恒和质子守恒模型。
考点一| 盐类的水解原理1.盐类的水解实质与特点(1)定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
(2)实质―→c(H+)≠c(OH-)―→溶液不再呈中性。
(3)水解常数(K h)以CH3COO-+H2O CH3COOH+OH-为例,表达式为c CH3COOH·c OH-c CH3COO-=K h=K WK a。
(4)特点可逆水解反应是可逆反应吸热水解反应是酸碱中和反应的逆反应,ΔH>0微弱水解反应程度很微弱2.盐类的水解规律(1)类型盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否—中性=7强酸NH4Cl、是NH+4、Cu2+酸性<7弱碱盐Cu(NO3)2弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性>7(2)规律:有弱才水解,越弱越水解;谁强显谁性,同强显中性。
提醒:弱酸弱碱盐的性质决定于酸、碱的相对强弱,水解性质仍显较强的性质,如NH4ClO 显碱性,CH3COONH4显中性。
[深度归纳] 酸式盐的性质判断方法归类(1)强酸的酸式盐只电离,不水解,溶液显酸性。
(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液呈碱性。
常见的有NaHCO3、NaHS、Na2HPO4等。
②若电离程度大于水解程度,溶液显酸性。
常见的有NaHSO3、NaH2PO4等。
3.水解离子方程式的书写(1)书写形式在书写盐类水解方程式时一般要用“”号连接,产物不标“↑”或“↓”,用离子方程式表示为盐中的弱离子+水弱酸(或弱碱)+OH-(或H+)。



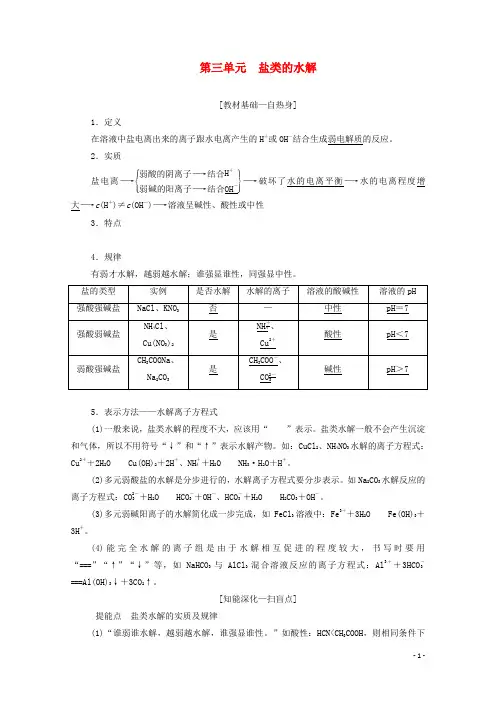
第三单元 盐类的水解[教材基础—自热身]1.定义在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性3.特点 4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
5.表示方法——水解离子方程式(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如:CuCl 2、NH 4NO 3水解的离子方程式:Cu 2++2H 2OCu(OH)2+2H +、NH +4+H 2ONH 3·H 2O +H +。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式:CO 2-3+H 2OHCO -3+OH -、HCO -3+H 2OH 2CO 3+OH -。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)3+3H +。
(4)能完全水解的离子组是由于水解相互促进的程度较大,书写时要用“===”“↑”“↓”等,如NaHCO 3与AlCl 3混合溶液反应的离子方程式:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
[知能深化—扫盲点]提能点 盐类水解的实质及规律(1)“谁弱谁水解,越弱越水解,谁强显谁性。
”如酸性:HCN<CH 3COOH ,则相同条件下碱性:NaCN>CH3COONa。
(2)强酸的酸式盐只电离,不水解,溶液显酸性。
如NaHSO4在水溶液中:NaHSO4===Na++H++SO2-4。
(3)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。




山东省高考化学一轮复习 第8章第3节 盐类的水解课时知能训练一、选择题1.下列叙述与水解无关的是( ) A .用明矾作为絮凝剂进行净化水 B .用FeCl 3制备Fe(OH)3胶体C .配制SnCl 2溶液时滴入少量稀盐酸D .防止钢铁生锈,在铁件表面镀一层锌【解析】 A 项,Al 3++3H 2O Al(OH)3(胶体)+3H +,Al(OH)3胶体吸附悬浮物净化水;B 项,Fe 3++3H 2O=====△Fe(OH)3(胶体)+3H +;C 项,Sn 2++H 2O===Sn(OH)Cl↓+HCl ,加入稀盐酸抑制Sn 2+水解成难溶物Sn(OH)Cl 。
【答案】 D2.下列离子方程式中,属于水解反应的是( )A .HCOOH +H 2O HCOO -+H 3O +B .CO 2+H 2O HCO -3+H +C .CO 2-3+H 2O HCO -3+OH -D .HS -+H 2O S 2-+H 3O +【解析】 A 、B 、D 三项离子方程式均表示电离方程式。
【答案】 C3.(2011·烟台高三质量调研)已知某温度下,K a (HCN)=6.2×10-10 mol·L -1,K a (HF)=6.8×10-4 mol·L -1,K a (CH 3COOH)=1.7×10-5 mol·L -1,K a (HNO 2)=7.1×10-4 mol·L -1。
物质的量浓度均为0.1 mol·L -1的下列溶液中,pH 由大到小的顺序是( )A .NaCN>NaNO 2>CH 3COONa>NaFB .NaF>NaNO 2>CH 3COONa>NaCNC .NaCN>CH 3COONa>NaNO 2>NaFD .NaCN>CH 3COONa>NaF>NaNO 2【解析】 由K a (HNO 2)>K a (HF)>K a (CH 3COOH)>K a (HCN)可知:酸性:HNO 2>HF>CH 3COOH>HCN ,水解能力:CN ->CH 3COO ->F ->NO -2,水解能力越强,溶液碱性越强,pH 越大。
